Слайд 2Связи между атомами молибдена
Структуру Mo2(O2CCH3)4 опубликовали Лоутон и Мэзон
Длина связи Mo –
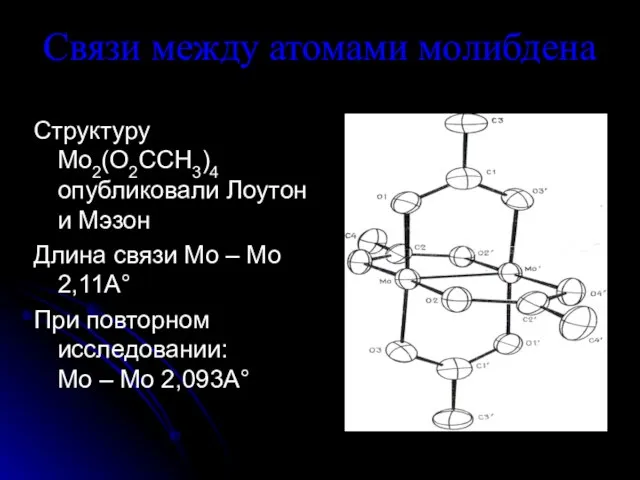
Mo 2,11А°
При повторном исследовании: Mo – Mo 2,093А°
Слайд 3Связи между атомами молибдена
Mo2(O2CCH3) + HCl = K2Mo2Cl8∙2H2O
Содержит анион [Mo2Cl8]4-
Длина связи Mo
![Связи между атомами молибдена Mo2(O2CCH3) + HCl = K2Mo2Cl8∙2H2O Содержит анион [Mo2Cl8]4-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397532/slide-2.jpg)
– Mo 2,138А°
Степень окисления молибдена +3
Слайд 4Связи между атомами молибдена
Соединения молибдена (III): [Mo2X8H]3-
Суммарное уравнение с галогеноводородными кислотами:
Mo2(O2CCH3)4 +
![Связи между атомами молибдена Соединения молибдена (III): [Mo2X8H]3- Суммарное уравнение с галогеноводородными](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397532/slide-3.jpg)
8HX → [Mo2X8H]3- + 3H+ + 4CH3COOH (t > 60°C, без доступа O2)
Рассматривают как сумму двух стадий:
Mo2(O2CCH3)4 + 7HX → [Mo2X7]3- + 3H+ + 4CH3COOH
[Mo2X7]3- + HX → [Mo2X8H]3-
Слайд 5Реакции с разрывом четверной связи молибден - молибден
π-акцепторные лиганды способны разрушать четверную
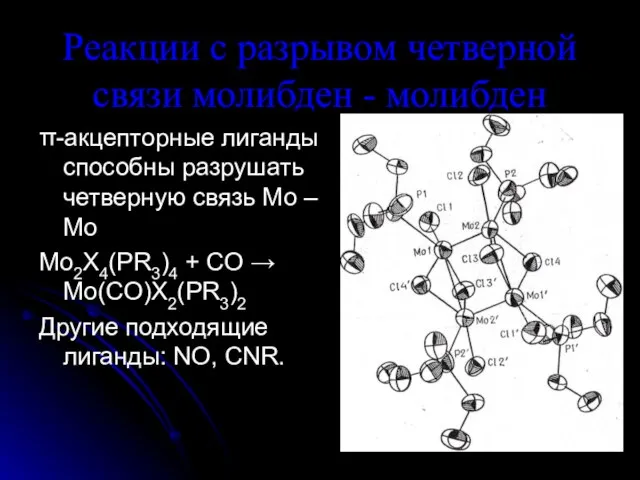
связь Mo – Mo
Mo2X4(PR3)4 + CO → Mo(CO)X2(PR3)2
Другие подходящие лиганды: NO, CNR.
Слайд 6Связи между атомами вольфрама
Невозможно получить устойчивый карбоксилат вольфрама (II) W2(O2CR)4
Соединения W24+ очень

легко окисляются
Попытки получить карбоксилаты типа W2(O2CR)4 привели к выделению и исследованию W2(O2CCF3)4
Слайд 7Карбоксилаты вольфрама
Получение:
W(CO)6 + CH3COOH + (CH3CO)2O → W2(O2CCH3)4
W2(O2CCH3)4 –коричневого или желтовато

– коричневого цвета
Среднее значение степени окисления вольфрама ≈ +3,6
Расстояния W – W равны 2,75А°.
Слайд 8Димеры без мостиковых лигандов
Получение фосфиновых производных W2Cl4(PR3)4:
1 метод
2WCl4 + 4Na/Hg + PR3

→ W2Cl4(PR3)4
где PR3 = PMe3, PMe2Ph, PMePh2
2 метод
WCl2(PMe3)4 → 0,5W2Cl4(PMe3)4 + 2PMe3 (Bu2O, кипячение)
WCl3(PMe3)3 → 0,25W2Cl4(PMe3)4 + 0,5WCl4(PMe3)4 + 0,5PMe3
Слайд 9Димеры без мостиковых лигандов
W2Cl4[(н-Bu)3P]4 + CH3COOH → W3O3Cl5(O2CCH3)-[(н-Bu)3P]4.
(в диглиме при 160°С)
Расстояние W
![Димеры без мостиковых лигандов W2Cl4[(н-Bu)3P]4 + CH3COOH → W3O3Cl5(O2CCH3)-[(н-Bu)3P]4. (в диглиме при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397532/slide-8.jpg)
– W составляет примерно 2,26А°
Слайд 10Димеры с мостиковыми лигандами
WCl4 + K2C8H8 → W2(COT)3 (в ТГФ)
Другие комплексы с

четверными связями: W2(mhp)4, W2(chp)4, W2(map)4, W2(dmhp)4, где:
mhp – анион 2-окси-6-метилпиридина
chp – анион 2-окси-6-хлорпиридина
dmhp – анион 2,4-диметил-6-оксипиримидина
map – анион 2-амино-6-метилпиримидина

![Связи между атомами молибдена Mo2(O2CCH3) + HCl = K2Mo2Cl8∙2H2O Содержит анион [Mo2Cl8]4-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397532/slide-2.jpg)
![Связи между атомами молибдена Соединения молибдена (III): [Mo2X8H]3- Суммарное уравнение с галогеноводородными](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397532/slide-3.jpg)




![Димеры без мостиковых лигандов W2Cl4[(н-Bu)3P]4 + CH3COOH → W3O3Cl5(O2CCH3)-[(н-Bu)3P]4. (в диглиме при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397532/slide-8.jpg)

 Тема 1: Введение в предмет
Тема 1: Введение в предмет Под сенью столетий…
Под сенью столетий… Об оказании медицинской помощи гражданам Республики Беларусь в медицинских учреждениях Российской Федерации в 2009-2010 годах
Об оказании медицинской помощи гражданам Республики Беларусь в медицинских учреждениях Российской Федерации в 2009-2010 годах Фотоискусство в эпоху Новейшего времени (XX – XXI вв.)
Фотоискусство в эпоху Новейшего времени (XX – XXI вв.) Компьютеромания: не виртуальная реальность
Компьютеромания: не виртуальная реальность Фотоальбом. От проекта до эксплуатации
Фотоальбом. От проекта до эксплуатации Экономический смысл налогообложения
Экономический смысл налогообложения Здоровье и физическое развитие ребенка
Здоровье и физическое развитие ребенка  Управление знаниями в компании: осмысление и подготовка
Управление знаниями в компании: осмысление и подготовка Teoria_nasilia
Teoria_nasilia Презентация на тему Адаптация растений к высоким температурам
Презентация на тему Адаптация растений к высоким температурам В 1273 г. сын А. Невского Даниил стал первым самостоятельным князем Москвы. При нем к Москве были присоединены Коломна и Переславль
В 1273 г. сын А. Невского Даниил стал первым самостоятельным князем Москвы. При нем к Москве были присоединены Коломна и Переславль Мальчишки. Девчонки. На их хрупкие плечи легла тяжесть невзгод, бедствий, горя военных лет. И не согнулись они под этой тяжестью, ста
Мальчишки. Девчонки. На их хрупкие плечи легла тяжесть невзгод, бедствий, горя военных лет. И не согнулись они под этой тяжестью, ста Исторический портрет Алексия II
Исторический портрет Алексия II Фовизм и кубизм
Фовизм и кубизм Шатилова Анна Николаевна
Шатилова Анна Николаевна Координаты вокруг нас
Координаты вокруг нас Презентация на тему Европейский ЮГ
Презентация на тему Европейский ЮГ Holidays Christmas
Holidays Christmas Тинькофф. 8 день
Тинькофф. 8 день Інформаційна система та її складові
Інформаційна система та її складові Военно-спортивный праздник, посвященный Дню защитников Отечества
Военно-спортивный праздник, посвященный Дню защитников Отечества Clothes. Shopping for clothes
Clothes. Shopping for clothes «Механизация сельского хозяйства»
«Механизация сельского хозяйства» Как построить технопаркМировой опыт
Как построить технопаркМировой опыт Операторство. Кто такой кинооператор?
Операторство. Кто такой кинооператор? Презентация на тему Закаливание детей
Презентация на тему Закаливание детей  Розы из пластиковой бутылки
Розы из пластиковой бутылки