Содержание
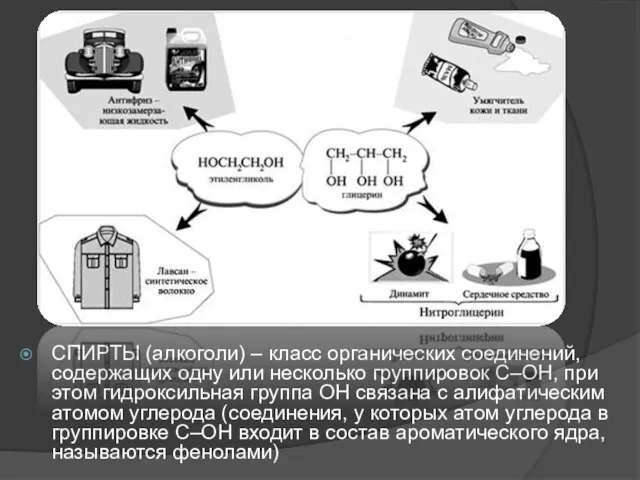
- 2. СПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа
- 3. Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу. 1. В зависимости
- 4. Соединения, в которых у одного атома углерода есть две гидроксильных группы, в большинстве случаев нестабильны и
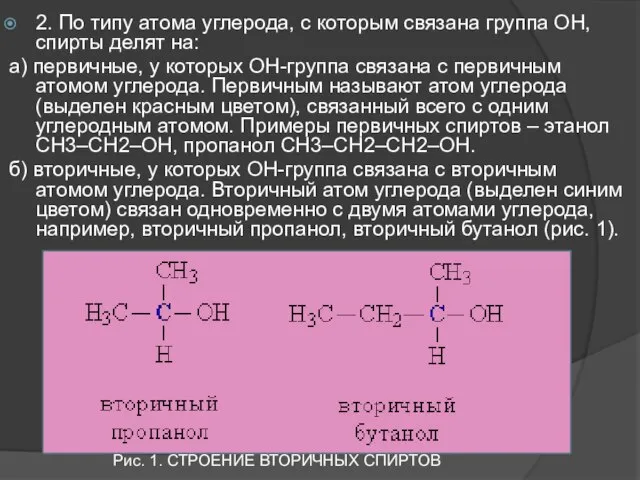
- 5. 2. По типу атома углерода, с которым связана группа ОН, спирты делят на: а) первичные, у
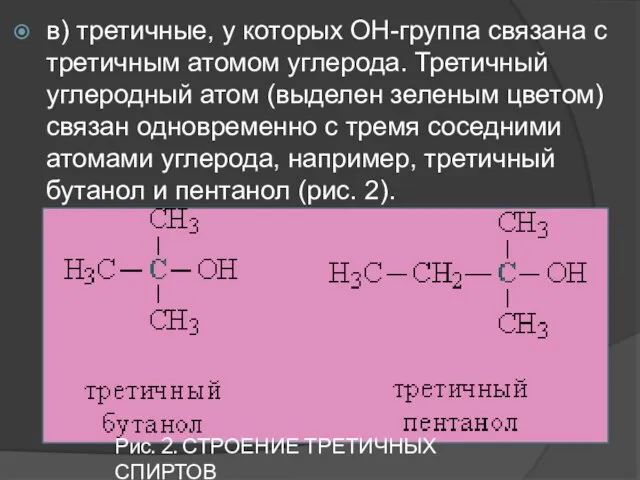
- 6. Рис. 2. СТРОЕНИЕ ТРЕТИЧНЫХ СПИРТОВ в) третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный
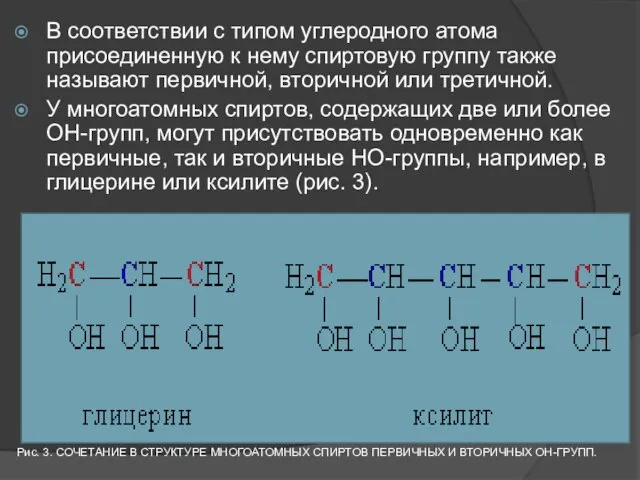
- 7. В соответствии с типом углеродного атома присоединенную к нему спиртовую группу также называют первичной, вторичной или
- 8. 3. По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например,
- 9. Номенклатура спиртов Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в
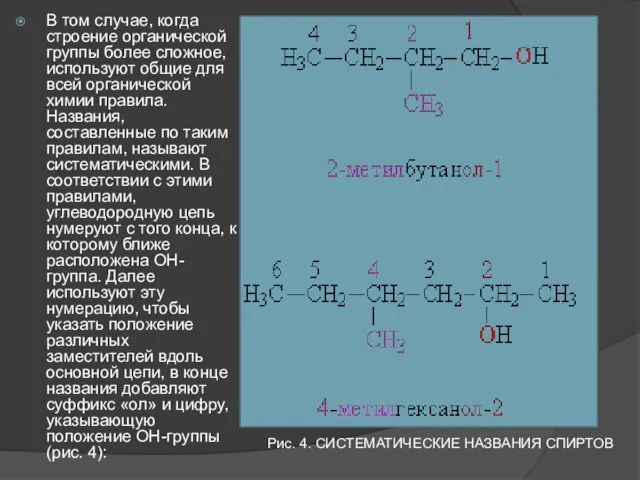
- 10. В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила.
- 11. Функциональные (ОН) и замещающие (СН3) группы, а также соответствующие им цифровые индексы выделены различающимися цветами. Систематические
- 12. Физические свойства спиртов Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол
- 13. Химические свойства спиртов Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных
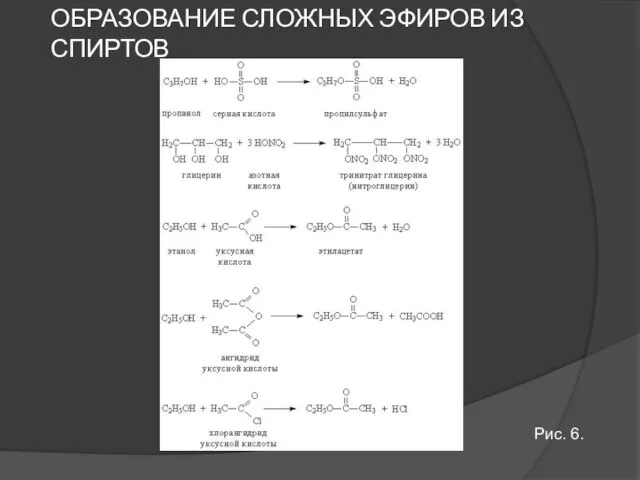
- 14. ОБРАЗОВАНИЕ СЛОЖНЫХ ЭФИРОВ ИЗ СПИРТОВ Рис. 6.
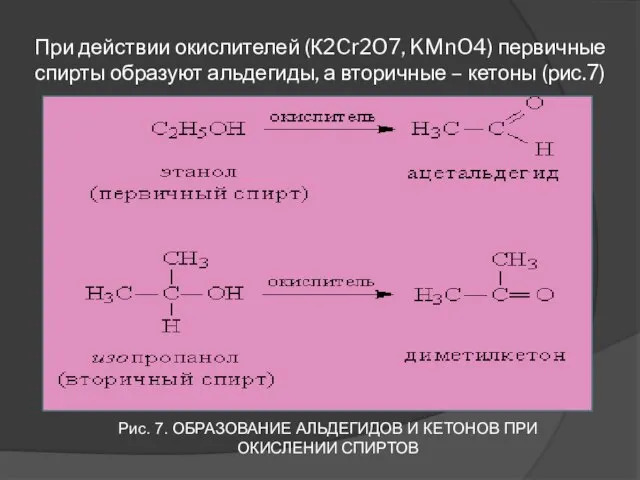
- 15. При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны (рис.7) Рис. 7.
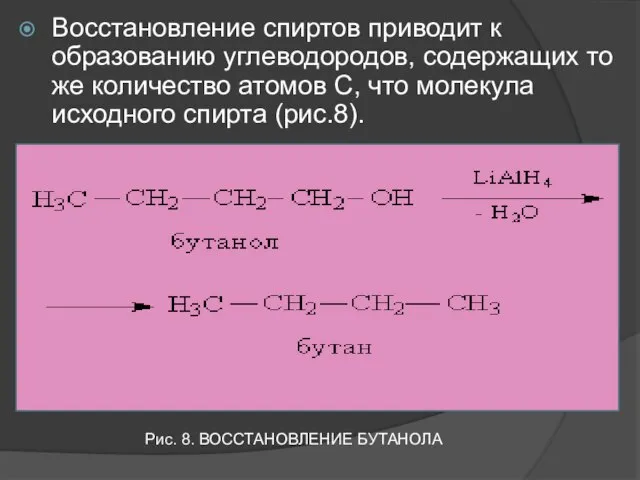
- 16. Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С, что молекула исходного спирта
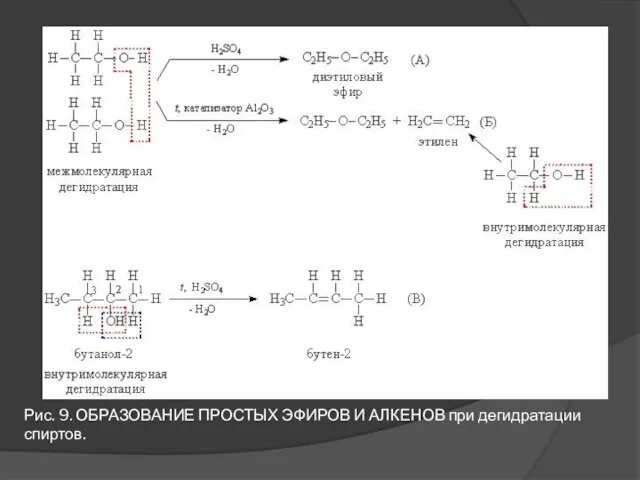
- 17. 2. Реакции, протекающие по связи С–О. В присутствии катализаторов или сильных минеральных кислот происходит дегидратация спиртов
- 18. Рис. 9. ОБРАЗОВАНИЕ ПРОСТЫХ ЭФИРОВ И АЛКЕНОВ при дегидратации спиртов.
- 19. Рис. 10. ЗАМЕНА ОН-ГРУППЫ В СПИРТАХ ГАЛОГЕНОМ ИЛИ АМИНОГРУППОЙ Простой эфир образуется при дегидратации двух молекул
- 20. Получение спиртов. Некоторые из показанных выше реакций (рис. 6,9,10) обратимы и при изменении условий могут протекать
- 21. Этанол образуется и при так называемом спиртовом брожении сахаров, например, глюкозы С6Н12О6. Процесс протекает в присутствии
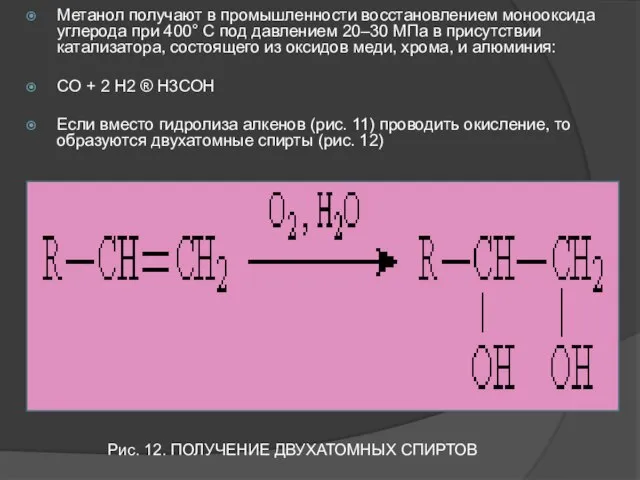
- 22. Метанол получают в промышленности восстановлением монооксида углерода при 400° С под давлением 20–30 МПа в присутствии
- 23. Применение спиртов. Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических
- 24. Метанол СН3ОН используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в
- 25. Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров
- 26. Бутанол используют как растворитель жиров и смол, кроме того, он служит сырьем для получения душистых веществ
- 27. Фенетиловый спирт С6Н5–CH2–CH2–OH обладает запахом розы, содержится в розовом масле, его используют в парфюмерии. Этиленгликоль HOCH2–CH2OH
- 28. Глицерин HOCH2–CH(OH)–CH2OH применяют для получения полиэфирных глифталевых смол, кроме того, он является компонентом многих косметических препаратов.
- 29. ЛИТЕРАТУРА Шабаров Ю.С. Органическая химия. Москва, «Химия», 1994
- 31. Скачать презентацию


















 Древние соборы Руси
Древние соборы Руси Хлеб. Булка хлеба
Хлеб. Булка хлеба Влияние модернизации на жизнь и быт сельских жителей
Влияние модернизации на жизнь и быт сельских жителей КТО БУДЕТ ЖИТЬ В РОССИИ? краткий обзор социальных трендов(по материалам исследований открытых источников)
КТО БУДЕТ ЖИТЬ В РОССИИ? краткий обзор социальных трендов(по материалам исследований открытых источников) Производственная практика на сублиматном заводе
Производственная практика на сублиматном заводе Автоматизированные системы управления цехом – постановка задачи и проблема внедрения
Автоматизированные системы управления цехом – постановка задачи и проблема внедрения Оксиды
Оксиды Паломництво_до_святинь_Польщі_–
Паломництво_до_святинь_Польщі_– МКОУ Ермоловская СОШ Лискинского района Воронежской области Шайкин Александр Николаевич
МКОУ Ермоловская СОШ Лискинского района Воронежской области Шайкин Александр Николаевич Черное и белое
Черное и белое Холдинг СЕТ
Холдинг СЕТ Діловий етикет спілкування
Діловий етикет спілкування Презентация на тему Облик земного шара
Презентация на тему Облик земного шара Разработка и реализация клинического испытания
Разработка и реализация клинического испытания 6 главных принципов управления капиталом на криптовалютном рынке
6 главных принципов управления капиталом на криптовалютном рынке Байкал глазами географа
Байкал глазами географа Мобильность, которой доверяют
Мобильность, которой доверяют Базовая информационная модель электронной медицинской карты для клинических центров РАМН
Базовая информационная модель электронной медицинской карты для клинических центров РАМН Модернизация ЛВС в рамках создания регионального фрагмента единой государственной информационной системы в сфере здравоохране
Модернизация ЛВС в рамках создания регионального фрагмента единой государственной информационной системы в сфере здравоохране Хостел Jumbo Stay. Стокгольм, Швеция
Хостел Jumbo Stay. Стокгольм, Швеция Математика иЕстественные Науки
Математика иЕстественные Науки Красивые рыбы. Монотипия
Красивые рыбы. Монотипия «Как защитить свой бизнес от претензий и исков потребителей» 21 апреля 2011г.
«Как защитить свой бизнес от претензий и исков потребителей» 21 апреля 2011г. ?
? Реклама в мобильных приложениях. Коммерческое предложение для СМИ
Реклама в мобильных приложениях. Коммерческое предложение для СМИ Процесс предоставления услугидо 1.10.2011 г.
Процесс предоставления услугидо 1.10.2011 г. Тренажер лексики
Тренажер лексики Федеральная целевая Программа «Модернизация транспортной системы России (2002-2010 годы)»
Федеральная целевая Программа «Модернизация транспортной системы России (2002-2010 годы)»