Содержание
- 2. Монографии по планированию и организации клинических исследований содержат от 300 до 600 страниц. «Организация, проведение и
- 3. Обзор клинического испытания (принимаются во внимание) Гипотеза и конкретные цели. Основополагающие/преклинические данные и данные, собранные в
- 4. Гипотеза и конкретные цели Должно существовать убедительное научное обоснование. Цели должны быть достижимыми. Данные должны поддаваться
- 5. Исходные данные: преклинические данные и данные, собранные в начальной стадии клинического испытания Чем больше известно о
- 6. КИ должно дать ответ на вопрос об эффективности терапевтического средства и неблагоприятных реакциях. План КИ должен
- 7. Общие положения плана исследования Цели исследования Экспериментальный курс лечения Контрольный (сравнительный) курс лечения Достоверность критериев определения
- 8. Цели исследования Определить терапевтические эффекты лекарственного вещества по сравнению с контролем. Выявить побочные эффекты лекарственного средства.
- 9. Типы контроля Контроль исходного состояния. Плацебо-контроль. Активный контроль. Контроль по архивной статистике.
- 10. Контроль исходного состояния Осуществляется с учетом безлекарственного периода наблюдения С учетом периода лечения плацебо (т.е. неактивным,
- 11. Активный контроль (позитивный контроль) Применяют когда назначать плацебо неэтично. В интересах маркетинга Сравнение эквивалентности для фармако-экономического
- 12. Контроль по архивной статистике (исторический контроль) Позволяет сравнивать экспериментальный курс лечения с существующими данными об исходах
- 13. Экспериментальный курс лечения Лекарственная форма Способ применения Режим приема Сроки лечения Анализ типа дозировки – Исследование
- 14. Испытуемые (критерии включения и исключения) Чем более строгие критерии отбора – тем легче интерпретировать данные, меньше
- 15. Испытуемые (критерии включения и исключения) Критерии включения - определяют основные характеристики, которые должны быть представлены в
- 16. Конечные точки исследования Твердые конечные точки – (снижение количества летальных исходов, увеличение продолжительности жизни, инвалидизация, КЖ,
- 17. Критерии надежности Критерий, подтверждающий стабильность полученных результатов в ходе нескольких курсов применения лекарственного средства. «…чем меньше
- 18. Определение степени воздействия Определяют параметры ожидаемого воздействия препарата на организм (степень снижения ДАД). Оценка ответной реакции
- 19. Выявление источников погрешности Рандомизация испытуемых лиц -помогает избежать погрешности лечения «ложное» лечение испытуемых лиц -помогает выявить
- 20. Контроль погрешности (слепое исследование, рандомизация, стратификация) Методики слепого исследования: Простое слепое Двойное слепое «Ослепление» третьих лиц
- 21. Рандомизация Метод непрозрачных запечатанных и последовательно пронумерованных конвертов; Централизованный компьютерный метод (процедура рандомизации на основе метода
- 22. Стратификация (стратификационная рандомизация) Обеспечивает распределение испытуемых по группам лечения с учетом факторов, существенно влияющих на исход
- 23. Некоторые этические вопросы клинических испытаний Определенные неразрешимые противоречия клинических испытаний -лечение с использованием плацебо -исследование с
- 24. Планирование клинического испытания: процесс информированного согласия Необходимость в рассмотрении со стороны ЭК соотношения между риском и
- 25. Основные стадии исследования Включение (после подписания ИС) Долечебный период (рандомизация): Скрининг на соответствие критериям включения/исключения Решение
- 26. Ликвидационный период (отмывочный) Используется при перекрестных исследованиях. Длительность отмывочного периода определяется периодом полувыведения препаратов. В качестве
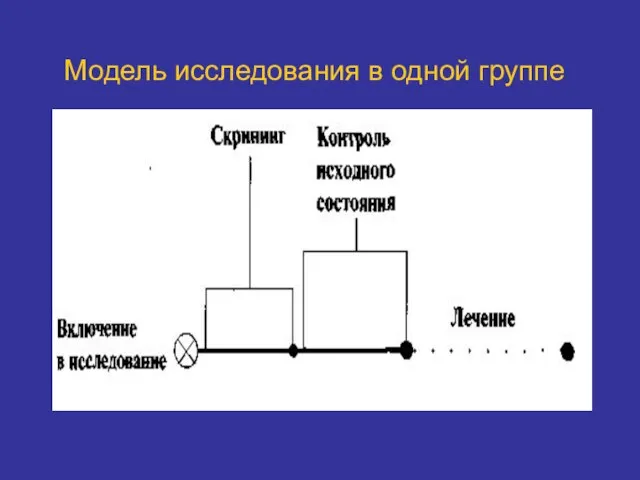
- 27. Модель исследования в одной группе
- 28. Модель исследования в одной группе Все испытуемые получают одинаковое лечение. Испытуемых не рандомизируют. Нет необходимости маскировать
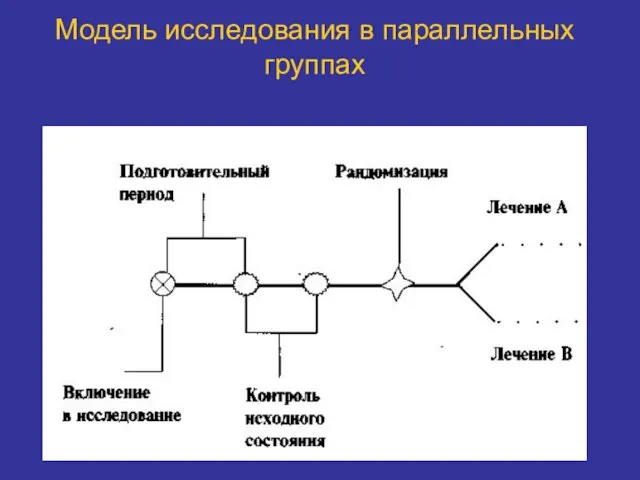
- 29. Модель исследования в параллельных группах
- 30. Модель исследования в параллельных группах Используют несколько групп лечения. Испытуемые получают либо разное лечение или разные
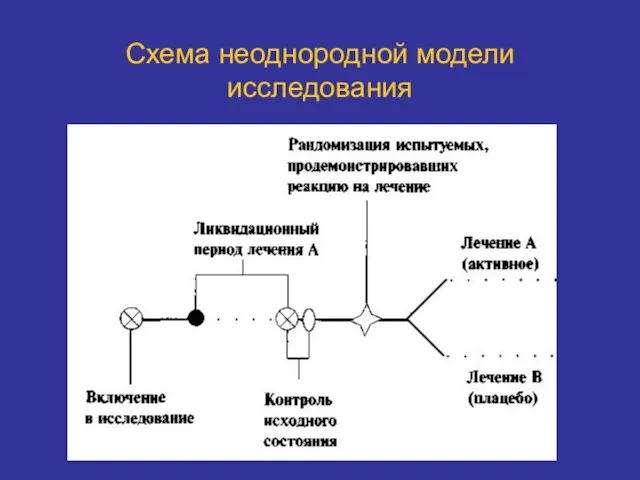
- 31. Схема неоднородной модели исследования
- 32. Схема неоднородной (прерываемой) модели «прекращения терапии» Наиболее эффективна при терапии трудноизлечимых болезней. Оценивают эффективность после прекращения
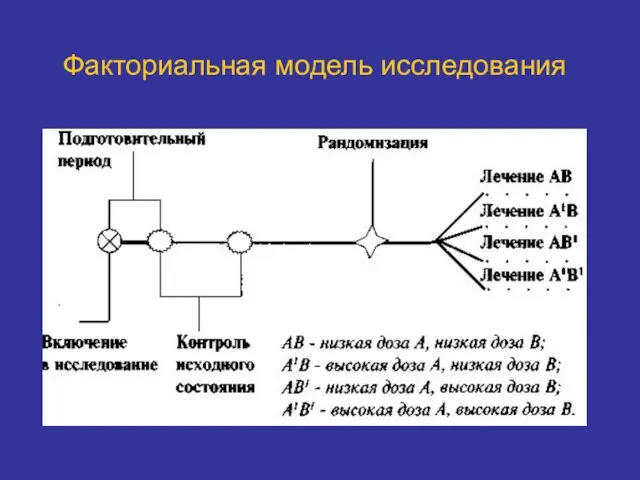
- 33. Факториальная модель исследования
- 34. Факториальная модель исследования Участвуют несколько групп пациентов. Наиболее полезна при изучении комбинаций препаратов и схем лечения
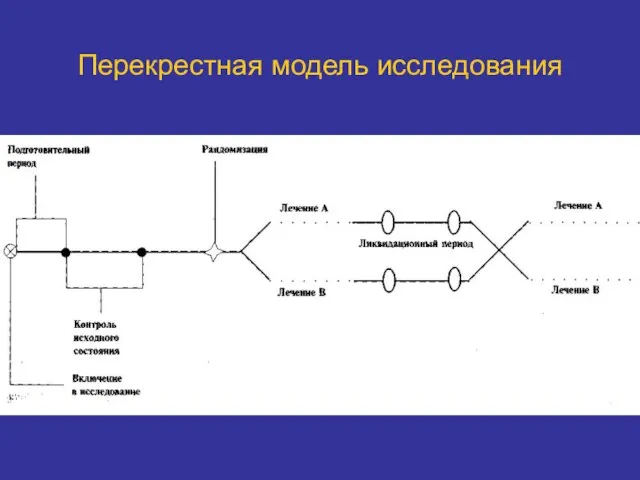
- 35. Перекрестная модель исследования
- 36. Перекрестная модель исследования Используют для изучения ф/динамики и ф/кинетики препаратов с учетом вариабельности в популяции. Требуется
- 37. Объем выборки Большинство проведенных к настоящему времени РККИ являются недостаточными по размеру для получения статистически значимых
- 38. Объем выборки Размер РККИ, в котором критерием эффективности лечения выбраны дискретные показатели исхода заболевания, обычно больше,
- 39. Объем выборки
- 41. Объем выборки
- 42. Анализ и интерпретация результатов В целом статистический анализ РККИ сводится к установлению разницы в исходах (конечных
- 43. Анализ и интерпретация результатов Практически в любом относительно крупном РККИ часть больных будет в силу тех
- 44. Толкование данных: Что обнаружено в ходе исследования? Отрицательный результат: отсутствие действенности или чрезмерная токсичность -пересмотр гипотезы
- 45. Толкование данных: Что обнаружено в ходе исследования? Результаты анализа дискретных показателей представляются в виде: снижения абсолютного
- 46. Толкование данных: Что обнаружено в ходе исследования? Пример: в гипотетическом рандомизированном контролируемом клиническом исследовании лечение тестируемым
- 47. Требования по КИ растительных средств (особенности) Отсутствуют данные о тератогенности – в противопоказания включают беременность и
- 48. Требования по КИ гомеопатических средств (особенности) Объем КИ определяет лек. форма –обязательно для инъекционной формы (150-200
- 49. Требования по КИ для БАД (особенности) Целесообразно разделять БАД на ВМК и парафармацевтики. Заключение Госэкспертизы не
- 50. Примеры формулировки целей и задач исследования (1) Целью исследования является сравнительная оценка антигипертензивного действия, безопасности и
- 51. Примеры формулировки целей и задач исследования (2) Цель исследования Первичная цель - определить влияние различных режимов
- 52. Примеры формулировки дизайна и структуры исследования Дизайн 1. Открытое, проспективное, сравнительное исследование с параллельными группами (сумамед).
- 53. Примеры формулировки дизайна исследования Двойное слепое, рандомизированное, амбулаторное исследование в параллельных группах. Сравнительное, многоцентровое, двойное слепое,
- 54. Примеры формулировки критериев эффективности исследования Определить клиническую эффективность и безопасность применения аспаркама-L на фоне стандартной терапии
- 55. Ошибки в планировании исследования Исследование «КОМПАС» - отсутствие плацебо. Опасность ориентирования на суррогатные исходы - испытания
- 56. Ошибки в планировании исследования Недостатки и преимущества исследования Сумамеда. Исследуемая популяция характеризовалась значительной неравномерностью формирования, переводами
- 57. Недостатки рандомизированных контролируемых КИ «Искусственность» формирования групп Отсев тяжелых больных (как не соответствующих критериям включения/исключения) Отсутствие
- 58. Эмпирические наблюдения показали, что использование парашюта снижает риск смертельного травмирования при падении с большой высоты. Однако
- 60. Скачать презентацию




















































 укр.м
укр.м Презентация на тему Экосистема Структура экосистемы
Презентация на тему Экосистема Структура экосистемы Приготовление завтрака
Приготовление завтрака Тема 1. Финансы как экономическая категория
Тема 1. Финансы как экономическая категория Огонь (9 класс)
Огонь (9 класс) ENGLAND
ENGLAND Презентация на тему Уменьшаемое. Вычитаемое. Значение разности
Презентация на тему Уменьшаемое. Вычитаемое. Значение разности Презентация на тему Комплексная работа. Игрушка Робот-трансформер
Презентация на тему Комплексная работа. Игрушка Робот-трансформер Путешествие в страну гимнастику
Путешествие в страну гимнастику Альтернативные, возобновляемые источники энергии и энергосбережение: естественное и принудительное
Альтернативные, возобновляемые источники энергии и энергосбережение: естественное и принудительное Vánoce v České republice
Vánoce v České republice кандидат технических наук, доцент Грекул Владимир Иванович
кандидат технических наук, доцент Грекул Владимир Иванович Цифровые вычислительные устройства и микропроцессоры приборных комплексов
Цифровые вычислительные устройства и микропроцессоры приборных комплексов Число и цифра 10
Число и цифра 10 1С-Битрикс: Сайт школы
1С-Битрикс: Сайт школы О новой системе оплаты труда, формировании фонда заработной платы педагогических и руководящих работников
О новой системе оплаты труда, формировании фонда заработной платы педагогических и руководящих работников Как реализовать задуманное?
Как реализовать задуманное? Приготування бутербродiв
Приготування бутербродiв «Методология образовательного процесса»
«Методология образовательного процесса» Информационные технологии в индустрии гостеприимства INTERNET
Информационные технологии в индустрии гостеприимства INTERNET Конфликты и пути их решения
Конфликты и пути их решения Механизмы возникновения и разрешения конфликтов
Механизмы возникновения и разрешения конфликтов Чтобы зубы не болели
Чтобы зубы не болели Урок- игра по творчеству М.Горького
Урок- игра по творчеству М.Горького Сравненительный анализ цен на сельскохозяйственную продукцию: Беларусь и мировые рынкиComparing agricultural prices: Belarus and internatioal markets
Сравненительный анализ цен на сельскохозяйственную продукцию: Беларусь и мировые рынкиComparing agricultural prices: Belarus and internatioal markets Безличные предложения (8 класс)
Безличные предложения (8 класс) Стилистическое использование средств словообразования
Стилистическое использование средств словообразования Кабинетное исследование
Кабинетное исследование