Содержание
- 2. Цели урока: Дать характеристику алюминия по его положению в периодической системе химических элементов. На основе строения
- 3. Из истории открытия алюминия… «Серебро из глины» В период открытия алюминия этот металл был дороже золота.
- 4. Интересные факты Немецкий учёный Ф.Велер (1827 г.) Памятник Дж. Вашингтону В лунном грунте обнаружен алюминий Самый
- 5. Применение алюминия
- 6. Авиастроение Применение алюминия и его сплавов во всех видах транспорта, а в особенности воздушного привело к
- 7. Кораблестроение Алюминий и его сплавы применяют при отделке и изготовлении корпусов и дымовых труб судов, спасательных
- 8. Машиностроение Моторы, блоки, головки цилиндров, картеры, коробки передач, насосы и многие другие детали также изготавливают из
- 9. Пищевая промышленность Алюминиевая фольга дешевле оловянной и полностью заменила ее как упаковочный материал для пищевых продуктов.
- 10. Электротехника Алюминий и его сплавы используют в электротехнической промышленности для изготовления кабелей, шинопроводов, конденсаторов, выпрямителей переменного
- 11. Военная промышленность Алюминий, а также его сплавы является стратегическим металлом и широко используется в военной промышленности
- 12. Строительство Алюминий и его сплавы применяются в промышленном и гражданском строительстве при изготовления каркасов зданий, ферм,
- 13. Периодическая система химических элементов Д.И.Менделеева Периоды 1 2 3 4 5 6 7 Ряды 1 2
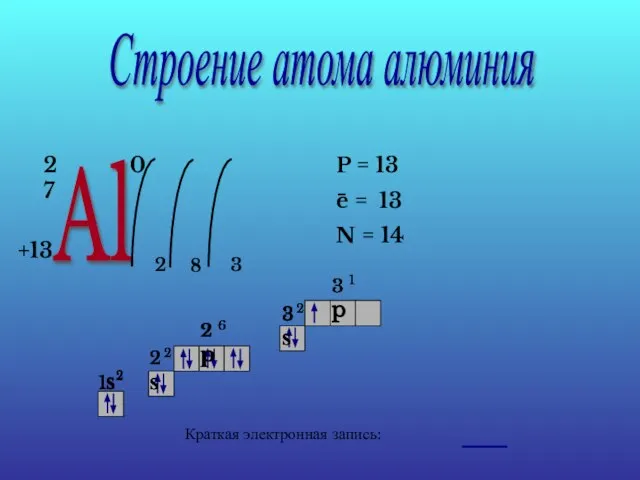
- 14. Строение атома алюминия Al 27 +13 0 2 8 3 P = 13 e = 13
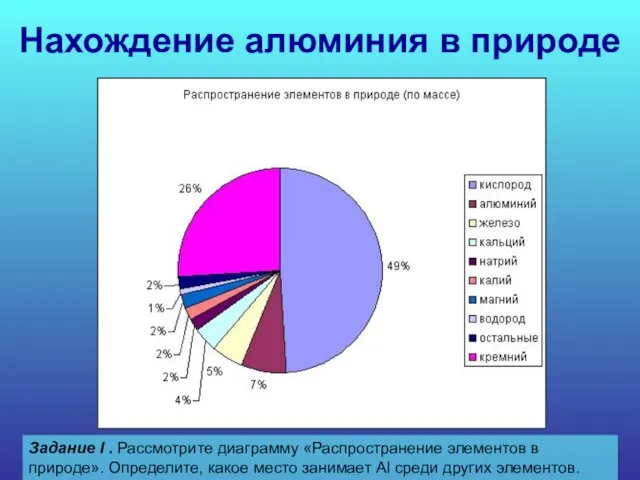
- 15. Нахождение алюминия в природе Задание I . Рассмотрите диаграмму «Распространение элементов в природе». Определите, какое место
- 16. Природные соединения алюминия Задание II. Рассмотрите образцы природных соединений, сравните их по твердости, прочности, цвету, рассчитайте
- 17. Физические свойства алюминия. Лабораторная работа. Инструктивная карта. 1. Рассмотрите алюминиевую пластинку. 2. Определите агрегатное состояние вещества
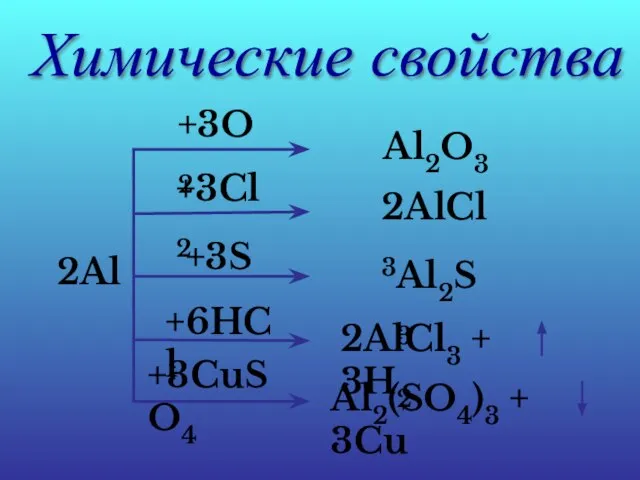
- 18. Химические свойства 2Al +3O2 Al2O3 +3Cl2 2AlCl3 +3S Al2S3 +6HCl 2AlCl3 + 3H2 +3CuSO4 Al2(SO4)3 +
- 19. Лабораторная работа: «Химические свойства алюминия». Инструктивная карта. 1. Возьмите две пробирки. В каждую положите по кусочку
- 20. Вывод: Алюминий является амфотерным элементом: взаимодействует с кислотами и со щелочами. 2Al + 6HCl = 2AlCl3
- 21. Получение алюминия в промышленности Алюминий получают электрохимическим методом из бокситов. 2Al2O3 ток> 4Al + 3O2
- 22. Тест 1.Какова электронная конфигурация атома алюминия? А) 1s22s22p1 Б)1s22s22p3 B) 1s22s22p63s23p1 Г) 1s22s22p63s23p63d14s2 2. С какими
- 23. Правильные ответы:
- 24. Домашнее задание: Учебник Г.Е.Рудзитиса, Ф.Г.Фельдмана «Химия 9 класс» 1) § 42 2) № 6, 7, стр.
- 26. Скачать презентацию




















 Архітектура України ХІХ ст
Архітектура України ХІХ ст Обучение правилам чтения
Обучение правилам чтения Презентация на тему Названия месяцев и дней недели
Презентация на тему Названия месяцев и дней недели  Нижний Новгород, 2020
Нижний Новгород, 2020 Weddings in different countries
Weddings in different countries Лев Николаевич Толстой
Лев Николаевич Толстой Название бизнес-плана
Название бизнес-плана 90 лет на планете Земля
90 лет на планете Земля Gli ospiti di Jerry. Chi è?
Gli ospiti di Jerry. Chi è? Первый день творения (земля, вода, небо)
Первый день творения (земля, вода, небо) Электроснабжение объектов
Электроснабжение объектов Генерация вероятностных автоматов методами Reinforcement Learning
Генерация вероятностных автоматов методами Reinforcement Learning Взаимодействие токов. Магнитное поле
Взаимодействие токов. Магнитное поле Летние Олимпийские игры 2012 в Лондоне
Летние Олимпийские игры 2012 в Лондоне Финансовый калькулятор
Финансовый калькулятор Абсцесс и гангрена легких
Абсцесс и гангрена легких Marshrutnaya set s perechnem ostanovochnyh punktov
Marshrutnaya set s perechnem ostanovochnyh punktov Nikolay Mikhaylovich Przhevalsky and Russian geography and exploration.
Nikolay Mikhaylovich Przhevalsky and Russian geography and exploration. Дисграфия как одна из причин школьной неуспешности по русскому языку
Дисграфия как одна из причин школьной неуспешности по русскому языку Отчет по производственной практике
Отчет по производственной практике Публичный отчет директора МВ(с)ОУ О(с)ОШ №1
Публичный отчет директора МВ(с)ОУ О(с)ОШ №1 СПБ 2018-2019. Наше маленькое путешествие
СПБ 2018-2019. Наше маленькое путешествие Иван Грозный
Иван Грозный Артериальная гипертония.Антигипертензивные препараты.
Артериальная гипертония.Антигипертензивные препараты. Буквы потерялись
Буквы потерялись МЕТОДЫ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
МЕТОДЫ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ Дом и вещи
Дом и вещи Презентация на тему Великая отечественная война на Кубани
Презентация на тему Великая отечественная война на Кубани