Содержание
- 2. Цель урока: Обобщать и систематизировать знания по теме. Знать о практическом использовании электролиза в промышленном производстве
- 3. План урока: I. Повторение тем: «Электролитическая диссоциация», «Сильные и слабые электролиты» II. Изучение материала по плану:
- 4. Повторение темы: «Электролитическая диссоциация» Электрический ток – это направленное движение электрически заряженных частиц. Вещества, в которых
- 5. По рисунку 1 объясните термин «Электролитическая диссоциация». Расскажите о процессе диссоциации. Как называют положительные и отрицательные
- 6. В водных растворах одни электролиты полностью распадаются на ионы, другие – частично (часть молекул электролита остается
- 7. Чем больше молекул электролита распадается на ионы, тем сильнее электролит. Диссоциация сильных электролитов – необратимый процесс,
- 8. II. Изучение нового материала. 1. Сущность процесса электролиза. Движение ионов в растворе или расплаве электролита является
- 9. Что такое электролиз? В чем заключается сущность электролиза? Электролиз – это окислительно – восстановительный процесс, протекающий
- 10. 2. Правила для определения результатов электролиза. а) Электролиз в расплавах (электроды нерастворимые). NaCl ↔ Na+ +
- 11. Электролиз в растворах. При электролизе водных растворов могут участвовать не только ионы растворенного вещества, но и
- 12. На катоде возможны восстановительные процессы: Ме+ + е = Ме (1) 2Н+ + 2е = Н2
- 13. На аноде возможны окислительные процессы: Окисл. анионов Аn- (4) 4ОН- – 4е = 2О2 + 4Н+
- 14. Какие из этих процессов будут преобладать? На катоде: В растворах процесс на катоде зависит от активности
- 15. На аноде: 1. Если анод активный, окисляется материал анода – процесс 7 На инертном аноде: 2.
- 16. 1-й закон Фарадея: Массы веществ, выделившихся на катоде и аноде, пропорциональны количеству прошедшего через раствор или
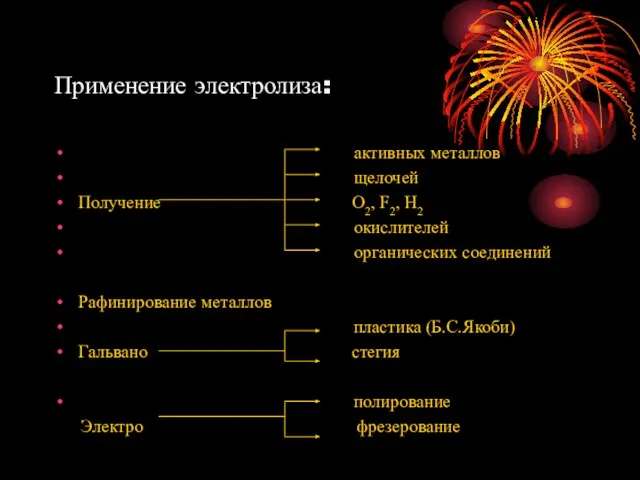
- 17. Применение электролиза: активных металлов щелочей Получение О2, F2, Н2 окислителей органических соединений Рафинирование металлов пластика (Б.С.Якоби)
- 18. Тест по теме «Электролиз» При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется: а)
- 19. 2. Объем кислорода (н.у.) выделившегося на инертном аноде при пропускании электрического тока силой 20 А в
- 20. 3. При электролизе 240 г 15%-го раствора гидро-ксида натрия на аноде выделилось 89,6 л (н. у.)
- 21. 4. При электролизе раствора хлорида натрия образуются: а)натрий и хлор; б)гидроксид натрия, хлор и водород; в)кислород
- 22. 5.При электролизе расплава гидроксида натрия на аноде выделяется: а) натрий; б) водород; в) кислород; г) вода.
- 23. 6.При электролизе раствора хлорида кальция на катоде выделилось 5,6 г водорода. Какова масса (в г) вещества,
- 24. 7.Медный купорос массой 100 г растворили в воде и провели электролиз до обесцвечивания раствора. объем (в
- 25. 8.Платиновый электрод: а)инертный; б)растворимый; в)расходуется в процессе в)расходуется в процессе электролиза; г)не расходуется в процессе электролиза.
- 26. 9.Процесс на катоде при электролизе растворов солей зависит от: а)природы катода; б)активности металла; в)состава аниона; г)не
- 27. 10.При электролизе раствора нитрата меди( П) с медными электродами на аноде будет происходить: а)выделение диоксида азота;
- 28. Правильно
- 30. Скачать презентацию


























 Презентация на тему День матери для начальной школы
Презентация на тему День матери для начальной школы  Делопроизводство. Организационные документы
Делопроизводство. Организационные документы Автоквест #Ёлки
Автоквест #Ёлки Панно «Прекрасная незнакомка»
Панно «Прекрасная незнакомка» Знайомтесь, наш 1-А клас!
Знайомтесь, наш 1-А клас! Влияние заимствованных слов на русский язык
Влияние заимствованных слов на русский язык Иностранные инвестиции и их влияние на состояние государственных финансов
Иностранные инвестиции и их влияние на состояние государственных финансов Азербайджан
Азербайджан Презентация на тему АЛЬБИНИЗМ
Презентация на тему АЛЬБИНИЗМ  Методическое объединение учителей естественно-географического цикла МОУ Даниловская СОШ имени А.С. Макаренко
Методическое объединение учителей естественно-географического цикла МОУ Даниловская СОШ имени А.С. Макаренко Проектирование технологического процесса изготовления детали класса рычагов в условиях крупносерийного производства
Проектирование технологического процесса изготовления детали класса рычагов в условиях крупносерийного производства Формирование вариативной части ОПОП по специальности 100801 Товароведение и экспертиза качества потребительских товаров
Формирование вариативной части ОПОП по специальности 100801 Товароведение и экспертиза качества потребительских товаров Адриано Челентано (Часть 2)
Адриано Челентано (Часть 2) Презентация на тему Формирование олигархического капитализма
Презентация на тему Формирование олигархического капитализма  Многоуровневый паркинг на проспекте Энергетиков
Многоуровневый паркинг на проспекте Энергетиков Разработка идеи
Разработка идеи Дизайн-проект школьного кафе
Дизайн-проект школьного кафе Формирование нравственных представлений у детей старшего дошкольного возраста
Формирование нравственных представлений у детей старшего дошкольного возраста Торт
Торт Аспекти комунікації
Аспекти комунікації Художественныйфильм
Художественныйфильм Комлевая Анна-презентация
Комлевая Анна-презентация Информатизация образования
Информатизация образования Правовое регулирование имущественных правоотношений
Правовое регулирование имущественных правоотношений Америго Веспуччи(1454-1512)
Америго Веспуччи(1454-1512) Запуск презентациинажатием клавиши..... F5!Завершить презентацию нажатием клавиши..... ESC!
Запуск презентациинажатием клавиши..... F5!Завершить презентацию нажатием клавиши..... ESC! ДВП и ДСП
ДВП и ДСП Пальчиковая гимнастика "Ворона и червячки"
Пальчиковая гимнастика "Ворона и червячки"