Слайд 2Закон сохранения энергии
Энергия не возникает из ничего и не исчезает бесследно, а

только переходит из одного состояния в другое.
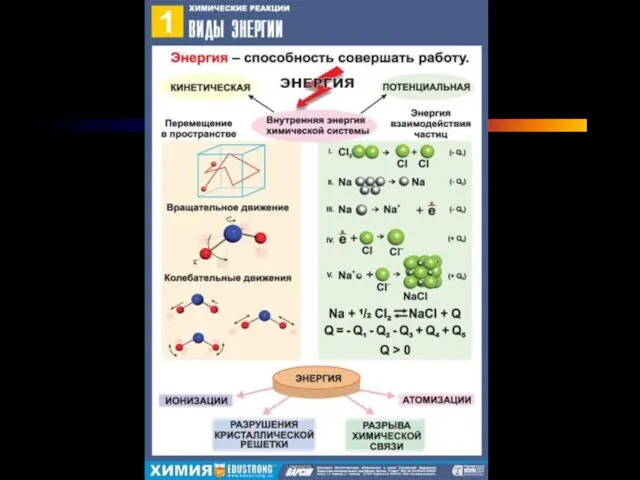
Энергия объекта складывается из: кинетической, потенциальной, внутренней.
Какой вид энергии важен при рассмотрении химической реакции?
Слайд 3Внутренняя энергия Е:
кинетическая энергия движения атомов, молекул, ионов;
энергия взаимного притяжения и оттталкивания

атомов, молекул, ионов;
энергия движения электронов, притяжения их к ядру, взаимного отталкивания электронов и ядер;
внутриядерная энергия.
Слайд 5Вопросы:
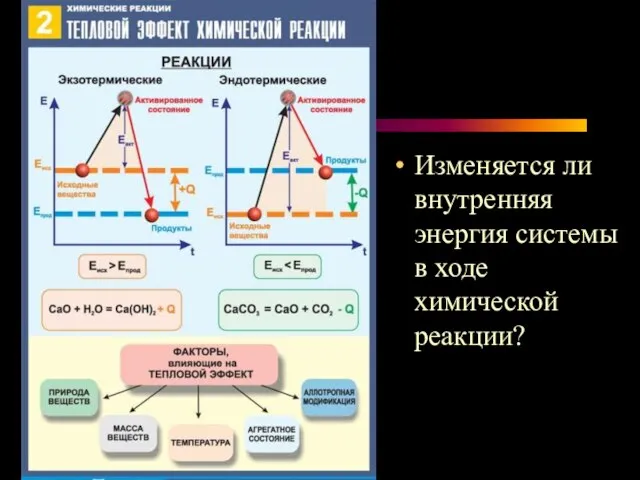
Какие реакции называются экзотермическими?
Какие реакции называются эндотермическими?
Что называют тепловым эффектом реакции?
В каких

единицах он измеряется?
Слайд 6Изменяется ли внутренняя энергия системы в ходе химической реакции?
Слайд 7Термохимическое уравнение
- это уравнение химической реакции, в котором указан тепловой эффект в

кДж.
2Н2 + О2 = 2Н2О + 484 кДж
Тепловой эффект – это сумма энергии, затраченной на разрыв химических связей и энергии, которая выделяется при их образовании.
Слайд 8Теплота образования Qобраз
- это тепловой эффект реакции образования одного моля соединения из

простых веществ, устойчивых в стандартных условиях (250С, 1 атм).
Теплота образования простых веществ равна нулю.
Будет ли численно совпадать тепловой эффект реакции и теплота образования?
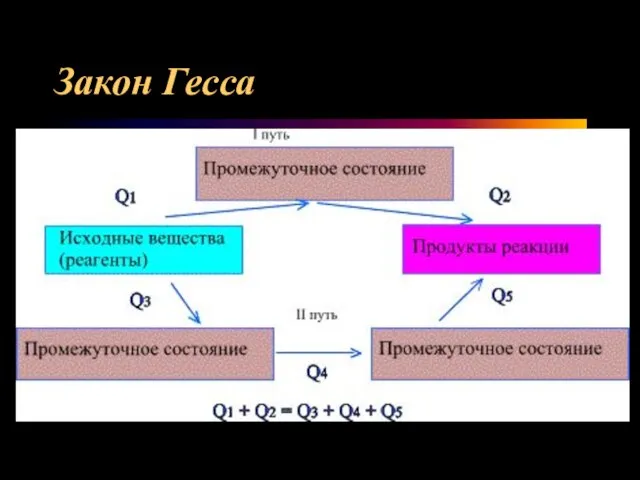
Слайд 10Закон Гесса
Гесс Генрих Иванович – петербургский академик
(1802-1850)

Слайд 12Закон Гесса
Тепловой эффект химической реакции не зависит от промежуточных стадий (при условии,

что исходные вещества и продукты одинаковые.
Тепловой эффект реакции равен сумме Qобраз всех продуктов реакции минус сумма Qобраз всех исходных веществ.
Слайд 13Решение задач
№1-4 на стр.125 базовый уровень.
№ 5-8 на стр. 126 профильный уровень.











 Материалы для автоворонки
Материалы для автоворонки Презентация на тему Плоские черви
Презентация на тему Плоские черви  Фотоискусство
Фотоискусство lektsia_6
lektsia_6 Методы развития внимания у детей дошкольного возраста
Методы развития внимания у детей дошкольного возраста  Буддизм
Буддизм Аэрозоль
Аэрозоль Энергосбережение при грануляции металлургического шлака
Энергосбережение при грануляции металлургического шлака История династии Романовых
История династии Романовых Аксиологические основы профессиональной подготовки студентов международного профиля
Аксиологические основы профессиональной подготовки студентов международного профиля Подарок юной рукодельнице
Подарок юной рукодельнице Белорусский костюм (1)
Белорусский костюм (1) Врачебный диагноз
Врачебный диагноз Wide Range of UPVC Windows & Doors
Wide Range of UPVC Windows & Doors Агляд-конкурс мастацкай самадзейнай творчасці сярод груп першага курса Я - беларус. Я - зерне, код народа
Агляд-конкурс мастацкай самадзейнай творчасці сярод груп першага курса Я - беларус. Я - зерне, код народа Информационное сообщениеВ.Н. Федулин
Информационное сообщениеВ.Н. Федулин Front Page
Front Page МАДОУ детский сад «Надежда» г.Кирово-Чепецк Кировская область Коррекционно-педагогическая работа с использованием ло
МАДОУ детский сад «Надежда» г.Кирово-Чепецк Кировская область Коррекционно-педагогическая работа с использованием ло «5 факторов эффективного поискового продвижения
«5 факторов эффективного поискового продвижения маркетинговые коммуникации
маркетинговые коммуникации  Олимпиады школьников по направлению «Информационная безопасность»
Олимпиады школьников по направлению «Информационная безопасность» От Сиднея вдоль Большого Водораздельного хребта
От Сиднея вдоль Большого Водораздельного хребта Презентация на тему Водоросли
Презентация на тему Водоросли  7 февраля 2006 г. Пресс-конференция «Вырваться из Сумрака!»
7 февраля 2006 г. Пресс-конференция «Вырваться из Сумрака!» Кластерный анализ. Метод к – средних
Кластерный анализ. Метод к – средних СЕМЕЙНЫЙ КЛУБ «МАМИНЫ ГЛАЗА»
СЕМЕЙНЫЙ КЛУБ «МАМИНЫ ГЛАЗА» Обзор зарплат по должностям дилерских авто центров
Обзор зарплат по должностям дилерских авто центров Преступление. Разновидности преступлений
Преступление. Разновидности преступлений