Слайд 2Суперионные проводники
Коэффициент диффузии в суперионных проводниках D ~ 10-5 cm2/sec (это коэффициент

диффузии молекулы сахара в горячем чае или тяжёлых газов, типа HSe, при комнатной температуре);
Коэффициент диффузии в твёрдых телах вдали от температуры плавления D ~ 10-12 – 10-15 cm2/sec
Известны суперионнные проводники с проводимостью по ионам H, Li, Na, K, Cu, Rb, Ag, Cs, O, F, Cl.
Типичные представители: Li2S, CuBr, AgI, Bi2O3, CaF.
Слайд 5Типичная изобарно-изотерическая зависимость ЭДС электрохимической ячейки для AgxTiTe2
Согласно правилу фаз Гиббса, участки
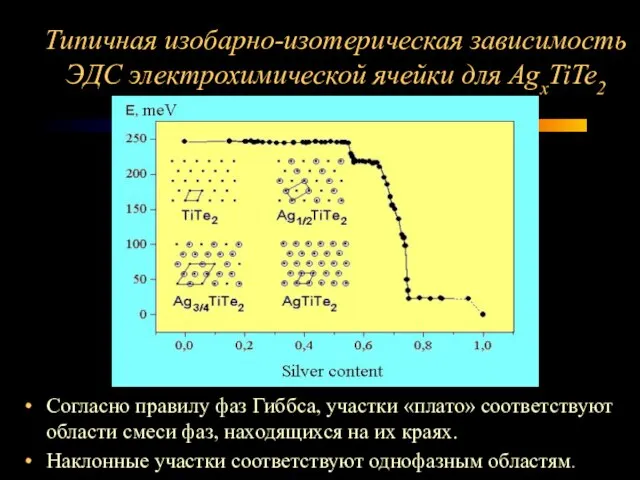
«плато» соответствуют области смеси фаз, находящихся на их краях.
Наклонные участки соответствуют однофазным областям.
Слайд 7Парциальные вклады в термодинамические функции

Слайд 9Структура дихалькогенидов титана МxTiX2, X=S,Se,Te
Красный кружок – халькоген,
Чёрный кружок –
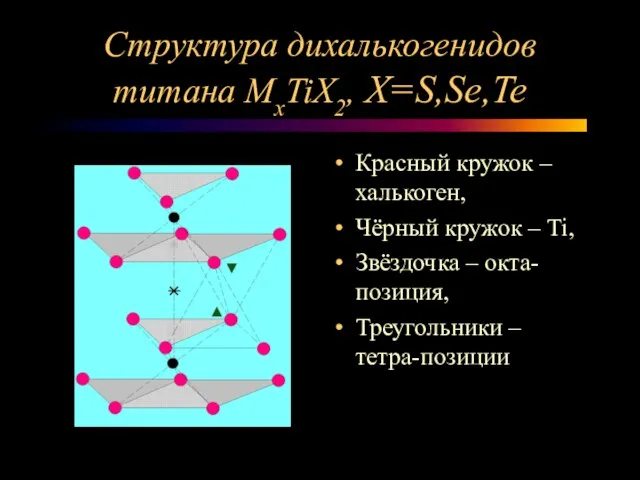
Ti,
Звёздочка – окта-позиция,
Треугольники – тетра-позиции
Слайд 10Интеркалация щелочных металлов
Интеркалация щелочных металлов приводит к переносу электронов на решётку-матрицу
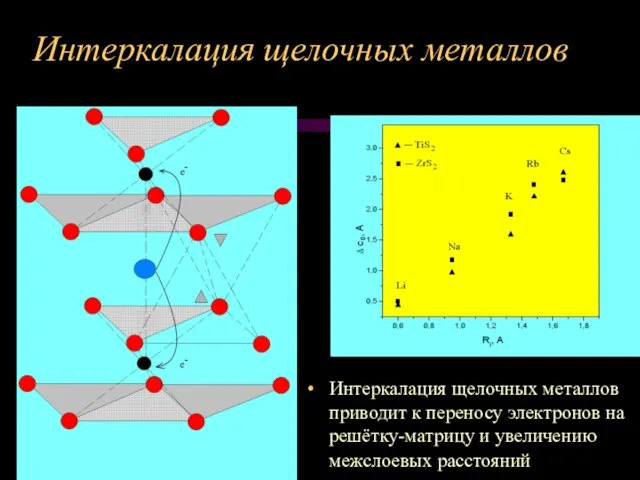
и увеличению межслоевых расстояний
Слайд 11Термодинамические функции AgxTiS2, стадии 1
Верхний график – концентрационая зависимость ЭДС электрохимической
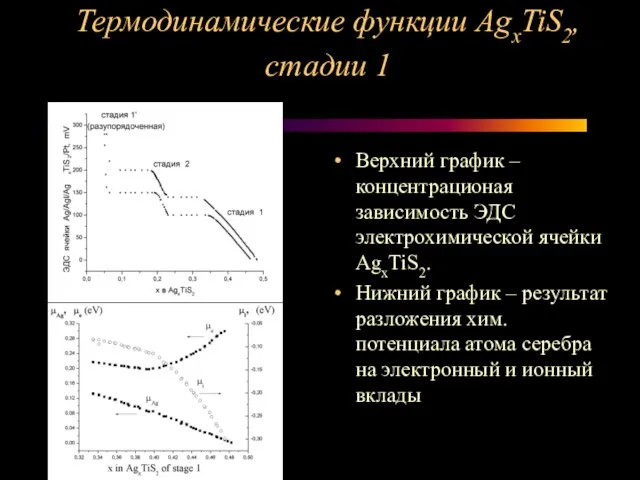
ячейки AgxTiS2.
Нижний график – результат разложения хим. потенциала атома серебра на электронный и ионный вклады
Слайд 12Энтальпия ионной, электронной и атомной подсистем AgxTiS2, стадии 1
Результат разложения энтальпии
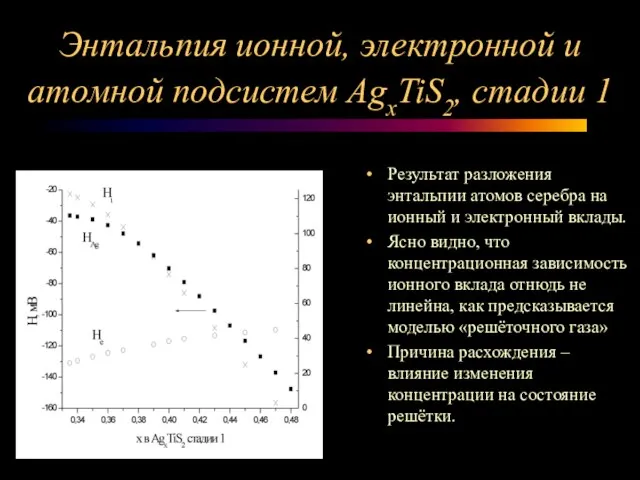
атомов серебра на ионный и электронный вклады.
Ясно видно, что концентрационная зависимость ионного вклада отнюдь не линейна, как предсказывается моделью «решёточного газа»
Причина расхождения – влияние изменения концентрации на состояние решётки.
Слайд 13Упругий вклад в свободную энергию интеркалированного иона

Слайд 14Энтальпия подвижных ионов с учётом упругого вклада
Концентрационная зависимость параметра с описывается в
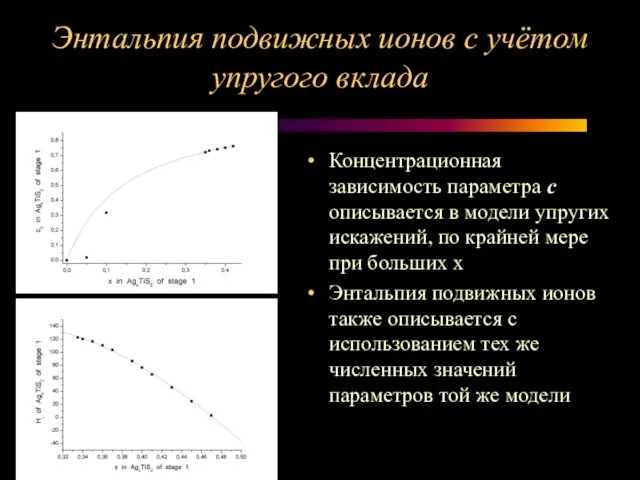
модели упругих искажений, по крайней мере при больших х
Энтальпия подвижных ионов также описывается с использованием тех же численных значений параметров той же модели
Слайд 15Энтальпия активации подвижного иона















 Электромобиль как распределенный накопитель энергии
Электромобиль как распределенный накопитель энергии Совершенствование эксплуатации МПП с модернизацией пропашного культиватора
Совершенствование эксплуатации МПП с модернизацией пропашного культиватора Стратегия продвижения социальной миссии Domestos
Стратегия продвижения социальной миссии Domestos Литературная викторина по повести Н. В. Гоголя «Тарас Бульба»
Литературная викторина по повести Н. В. Гоголя «Тарас Бульба» 3. Классификация ПК
3. Классификация ПК Наши права. Основные права потребителей
Наши права. Основные права потребителей Банковский счет
Банковский счет Глобальная угроза международного терроризма. Пути решения
Глобальная угроза международного терроризма. Пути решения Краснодарский архитектурно-строительный техникум
Краснодарский архитектурно-строительный техникум с эстетическими направлениями
с эстетическими направлениями Этикет в японской семье: от традиций к современностям
Этикет в японской семье: от традиций к современностям Шаг навстречу
Шаг навстречу Русская философия
Русская философия  Шолохов
Шолохов Презентация на тему Жизненные формы растений
Презентация на тему Жизненные формы растений Инфабрика. Первый частный музей современного сибирского искусства
Инфабрика. Первый частный музей современного сибирского искусства Занимательный русский язык
Занимательный русский язык Угол. Виды углов
Угол. Виды углов «Тип Членистоногие»
«Тип Членистоногие» Пенсионное обеспечение
Пенсионное обеспечение Дед Мороз
Дед Мороз Cash on Card Наличные за 15 минут_9
Cash on Card Наличные за 15 минут_9 Мягкая мебель собственного производства
Мягкая мебель собственного производства День Конституции РФ
День Конституции РФ Презентация на тему Что где когда по ПДД
Презентация на тему Что где когда по ПДД Подрядчики СГОК-v2
Подрядчики СГОК-v2 Дашинима Бальжанович Намдаков
Дашинима Бальжанович Намдаков Выбор и моделирование двигателя постоянного тока для скоростного следящего электропривода
Выбор и моделирование двигателя постоянного тока для скоростного следящего электропривода