Содержание
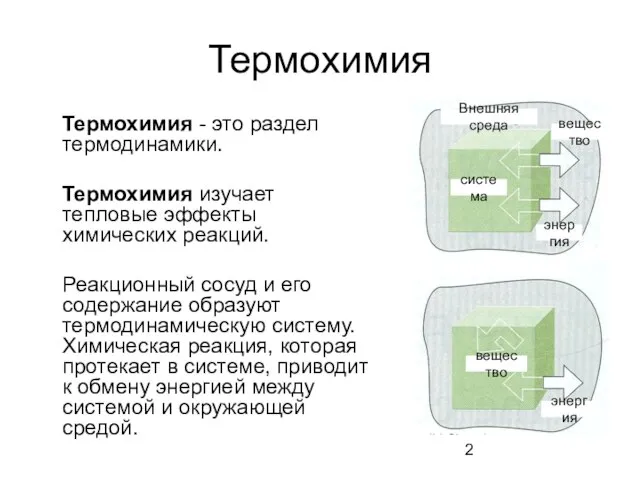
- 2. Термохимия Термохимия - это раздел термодинамики. Термохимия изучает тепловые эффекты химических реакций. Реакционный сосуд и его
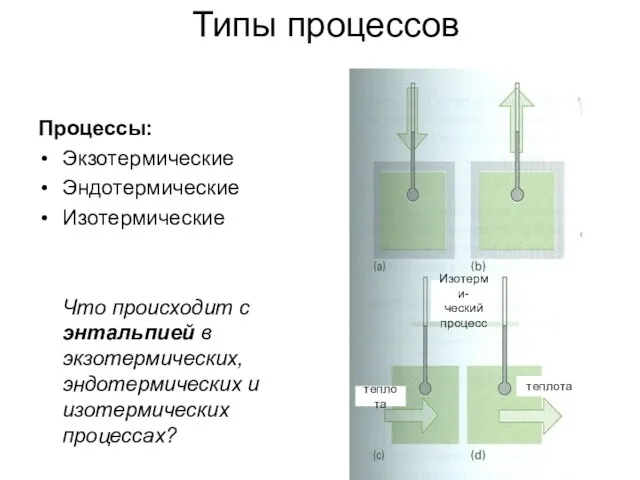
- 3. Типы процессов Процессы: Экзотермические Эндотермические Изотермические Что происходит с энтальпией в экзотермических, эндотермических и изотермических процессах?
- 4. Изменение энтальпии в экзотермических и эндотермических процессах Выделение теплоты приводит к уменьшению энтальпии системы (при Р
- 5. Измерение теплоты химической реакции H = U + PV Если для реакции известно ΔU или ΔH
- 6. Стандартная энтальпия и стандартное состояние Стандартное изменение энтальпии, ΔH°, - это изменение энтальпии для процесса, в
- 7. Энтальпия физических превращений Стандартная энтальпия образования вещества ΔfH° - это стандартная энтальпия химической реакции образования вещества
- 8. Энтальпия физических превращений Стандартная энтальпия фазового перехода ΔtrsH° – это изменение стандартной энтальпии при изменении физического
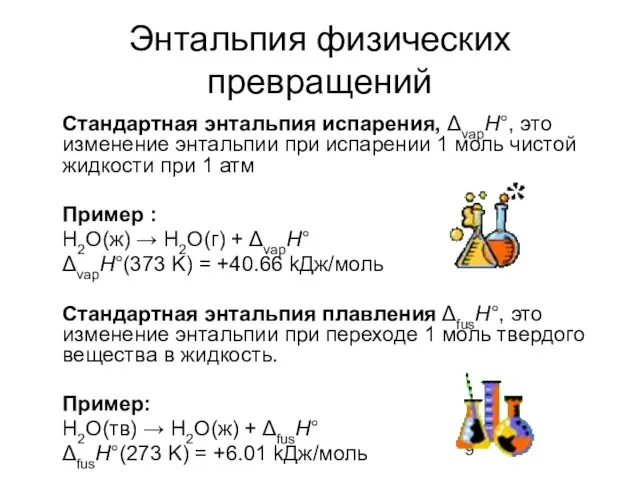
- 9. Энтальпия физических превращений Стандартная энтальпия испарения, ΔvapH°, это изменение энтальпии при испарении 1 моль чистой жидкости
- 10. Стандартная энтальпия возгонки H2O(тв) → H2O(г) + ΔsubH° Два этапа: H2O(тв) → H2O(ж) + ΔfusH° H2O(ж)
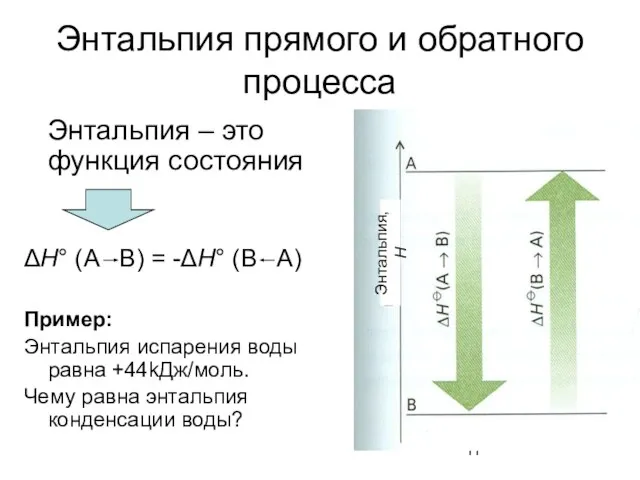
- 11. Энтальпия прямого и обратного процесса Энтальпия – это функция состояния ΔH° (A B) = -ΔH° (B
- 12. Типы энтальпии Фазовый переход Фазовый переход испарение плавление процесс обозначение возгонка смешение растворение гидратация атомизация ионизация
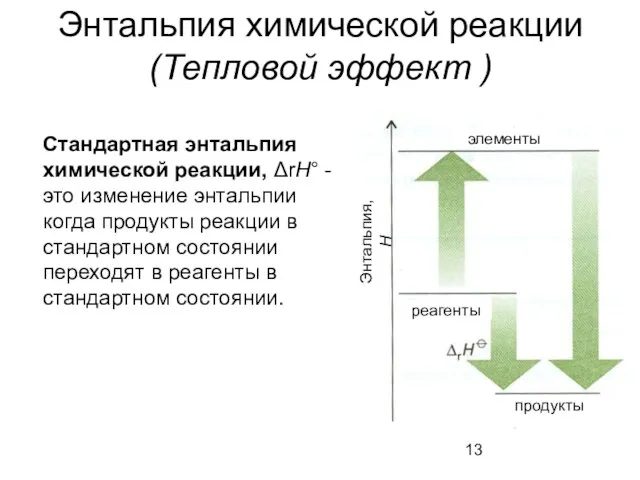
- 13. Энтальпия химической реакции (Тепловой эффект ) Стандартная энтальпия химической реакции, ΔrH° - это изменение энтальпии когда
- 14. Энтальпия химической реакции Расчет энтальпии химической реакции с использованием стандартных энтальпий образования веществ: Пример : CH4(г)
- 15. Энтальпия химической реакции Расчет энтальпии химической реакции с использованием стандартных энтальпий сгорания веществ: Пример : C6H12O6(тв)
- 16. Закон Гесса Теловой эффект химической реакции можно определить если известны энтальпии других реакций, из которых можно
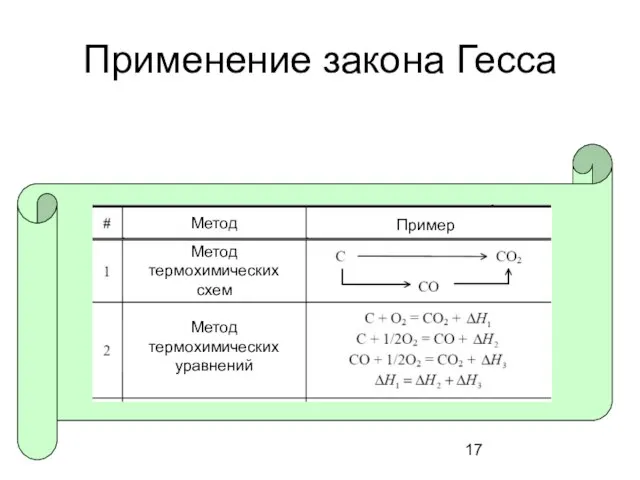
- 17. Применение закона Гесса Метод термохимических уравнений Метод термохимических схем Метод Пример
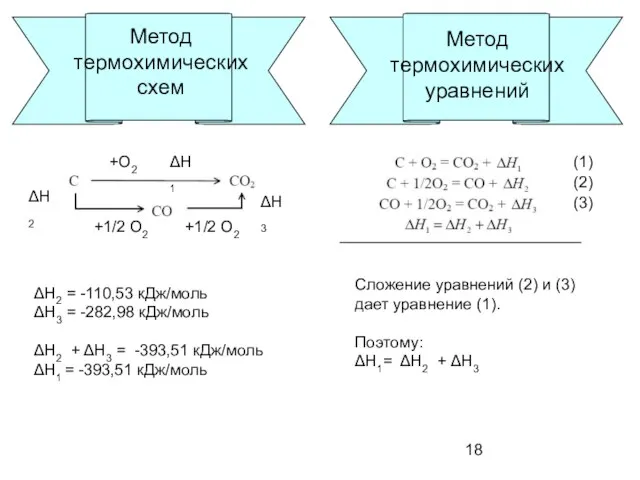
- 18. Метод термохимических схем ΔН1 ΔН2 ΔН3 +О2 +1/2 О2 +1/2 О2 ΔН2 = -110,53 кДж/моль ΔН3
- 19. Применение закона Гесса Метод Пример Метод термохимических схем Метод термохимических уравнений Использование стандартных энтальпий образования продукты
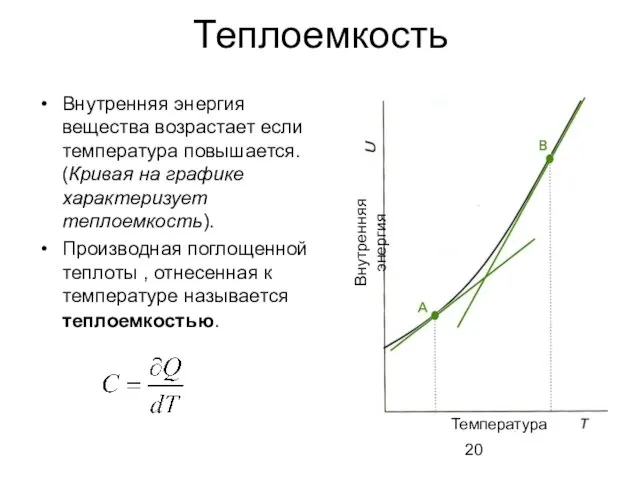
- 20. Теплоемкость Внутренняя энергия вещества возрастает если температура повышается. (Кривая на графике характеризует теплоемкость). Производная поглощенной теплоты
- 21. Молярная и удельная теплоемкость Удельная теплоемкость вещества – это теплоемкость, отнесенная к массе вещества Молярная теплоемкость
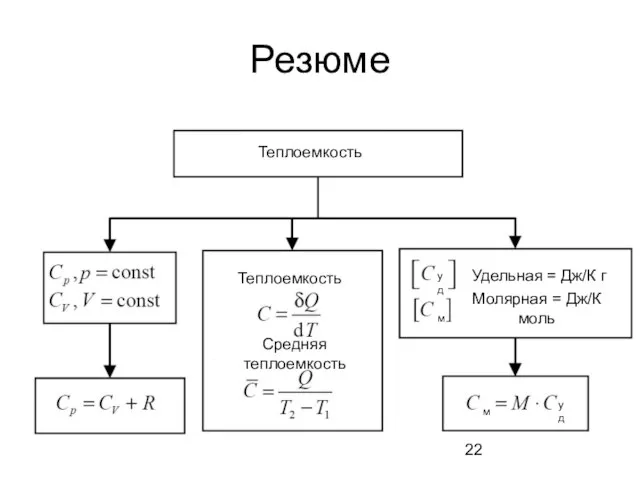
- 22. Резюме Теплоемкость Теплоемкость Средняя теплоемкость Молярная = Дж/К моль Удельная = Дж/К г уд м м
- 23. Зависимость теплоемкости от температуры В общем случае эмпирическая зависимость теплоемкости от температуры выражается полиномом:
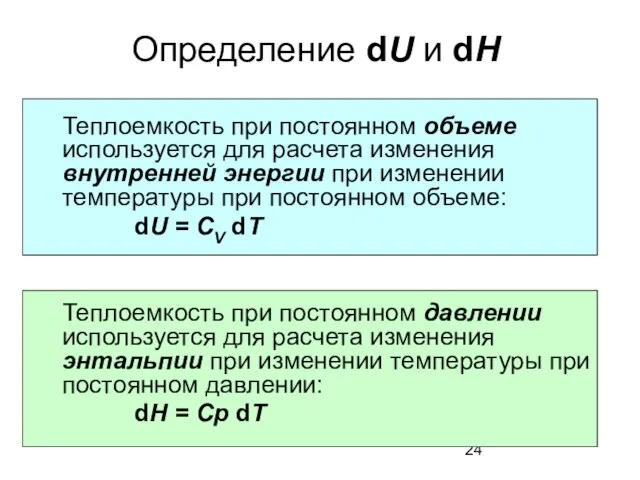
- 24. Определение dU и dH Теплоемкость при постоянном объеме используется для расчета изменения внутренней энергии при изменении
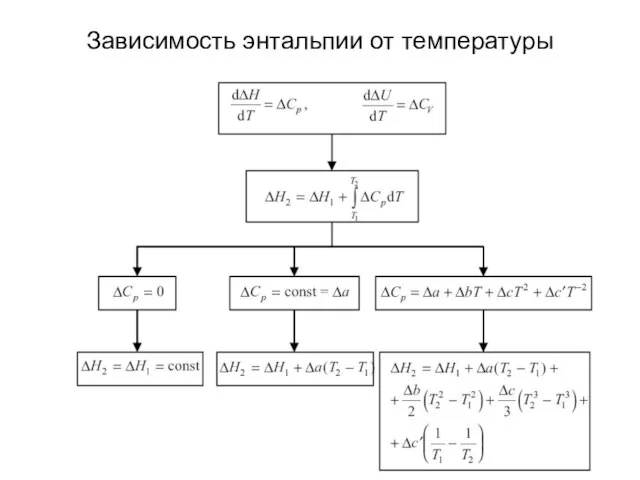
- 25. Зависимость энтальпии от температуры
- 26. Зависимость энтальпии от температуры
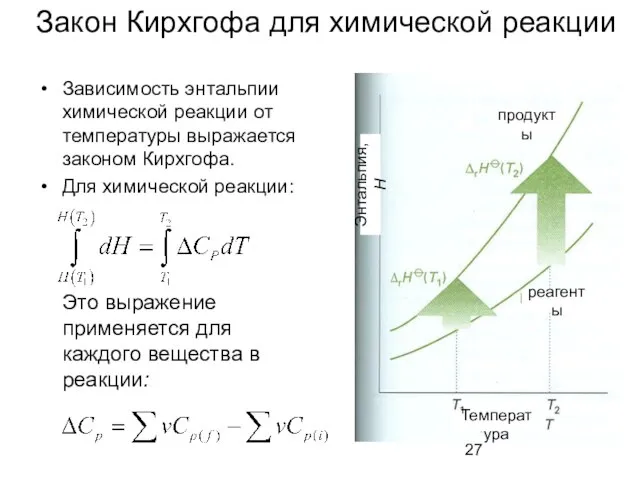
- 27. Закон Кирхгофа для химической реакции Зависимость энтальпии химической реакции от температуры выражается законом Кирхгофа. Для химической
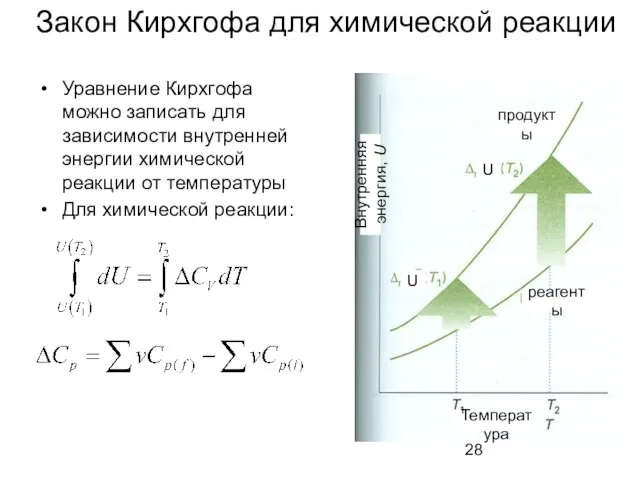
- 28. Закон Кирхгофа для химической реакции Уравнение Кирхгофа можно записать для зависимости внутренней энергии химической реакции от
- 29. Закон Кирхгофа для химической реакции
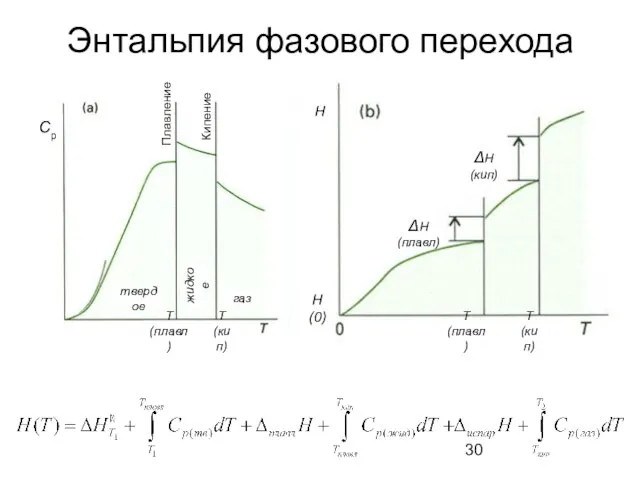
- 30. Энтальпия фазового перехода Cp Плавление Кипение твердое жидкое газ Т(плавл) Т(кип) Т(плавл) Т(кип) ΔН(плавл) ΔН(кип) Н
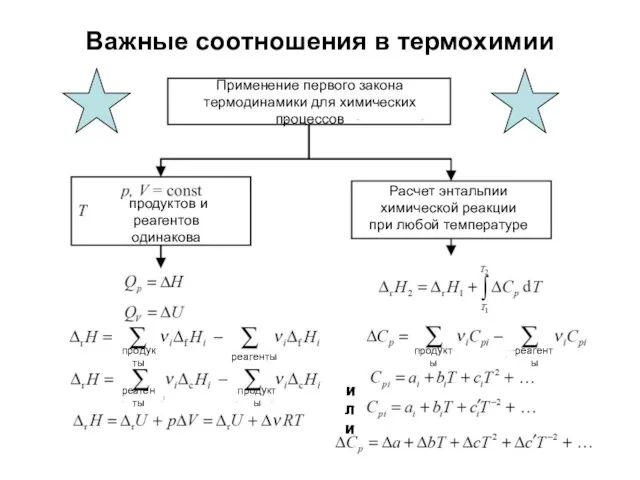
- 31. Важные соотношения в термохимии Применение первого закона термодинамики для химических процессов продуктов и реагентов одинакова Расчет
- 32. Энтальпия образования ионов в растворе Тепловой эффект образования химического соединения в растворе, диссоциирующего на ионы, определяется
- 33. Теплота растворения Теплота растворения зависит от концентрации химического соединения в растворе. Теплота, которая поглощается или выделяется
- 34. Моляльность Моляльность – способ выражения концентрации раствора. Моляльность показывает количество молей растворенного вещества в 1000 г
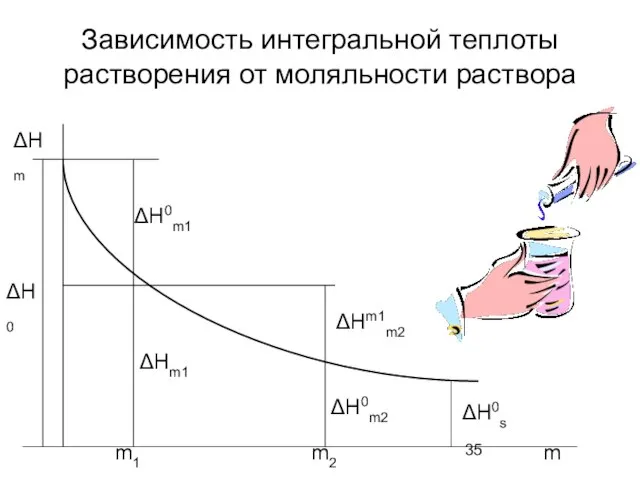
- 35. Зависимость интегральной теплоты растворения от моляльности раствора ΔН0 ΔНm ΔН0m1 ΔНm1 ΔНm1m2 ΔН0m2 ΔН0s m1 m2
- 36. Интегральная теплота растворения ∆Н0 – первая интегральная теплота растворения. Это тепловой эффект при растворении 1 моль
- 37. Тепловой эффект при разведении раствора Прибавление воды к раствору сопровождается теплотой разведения. Интегральная теплота разведения –
- 38. Промежуточная теплота разведения Промежуточная теплота разведения – это тепловой эффект разбавления раствора, содержащего 1 моль вещества
- 40. Скачать презентацию




















 Художник в театре
Художник в театре Кукла Карельская рванка
Кукла Карельская рванка Языки народов мира
Языки народов мира РАСТИТЕЛЬНАЯ КЛЕТКА
РАСТИТЕЛЬНАЯ КЛЕТКА Презентация на тему День Ивана Купалы
Презентация на тему День Ивана Купалы  Действия туристской группы в ЧС по организации поиска туриста, отставшего от группы
Действия туристской группы в ЧС по организации поиска туриста, отставшего от группы Услуги АО Федеральная корпорация по развитию малого и среднего предпринимательства
Услуги АО Федеральная корпорация по развитию малого и среднего предпринимательства Troubleshooting guide (h/s)
Troubleshooting guide (h/s) FCG Academy: Подготовка к экзамену по международному стандарту финансовой отчетности АССА ДипИФР
FCG Academy: Подготовка к экзамену по международному стандарту финансовой отчетности АССА ДипИФР Сравнительный анализ пространственных структур белков
Сравнительный анализ пространственных структур белков Типовые условия работы. Внедрение и сопровождение 1С в Тосно и Тосненском районе
Типовые условия работы. Внедрение и сопровождение 1С в Тосно и Тосненском районе Обеспечение взаимосвязи фундаментальных и специальных дисциплин в учебном процессе Вуза И.Е. Денежкина, А.Б. Шаповал ФИНАНСОВЫЙ У
Обеспечение взаимосвязи фундаментальных и специальных дисциплин в учебном процессе Вуза И.Е. Денежкина, А.Б. Шаповал ФИНАНСОВЫЙ У История Советского и Российского оружия
История Советского и Российского оружия Марафон похудения Гузель Уразовой
Марафон похудения Гузель Уразовой Презентация на тему Анализ рассказа Ю.П. Казакова «Тихое утро»
Презентация на тему Анализ рассказа Ю.П. Казакова «Тихое утро» Подготовка и оснащение аудитории для проведения ОГЭ по химии, комплектование лабораторного оборудования
Подготовка и оснащение аудитории для проведения ОГЭ по химии, комплектование лабораторного оборудования Измерение времени (2 класс)
Измерение времени (2 класс) Типы текстовых редакторов
Типы текстовых редакторов Презентация на тему Испания
Презентация на тему Испания Шары из фольги
Шары из фольги Физика в детских игрушках
Физика в детских игрушках Осуществление и защита частных прав
Осуществление и защита частных прав Виды игровых средств для сенсорного развития
Виды игровых средств для сенсорного развития 14 жовтня
14 жовтня Влияние рекламных роликов на формирование выбора избирателей
Влияние рекламных роликов на формирование выбора избирателей Атомные технологии
Атомные технологии Международные отношения и внешняя политика СССР в 1930 гг
Международные отношения и внешняя политика СССР в 1930 гг ЛИЧНОСТНОЕ РАЗВИТИЕ ОБУЧАЮЩИХСЯ В ПРОЦЕССЕ ФОРМИРОВАНИЯ КОЛЛЕКТИВА КЛАССА
ЛИЧНОСТНОЕ РАЗВИТИЕ ОБУЧАЮЩИХСЯ В ПРОЦЕССЕ ФОРМИРОВАНИЯ КОЛЛЕКТИВА КЛАССА