Содержание
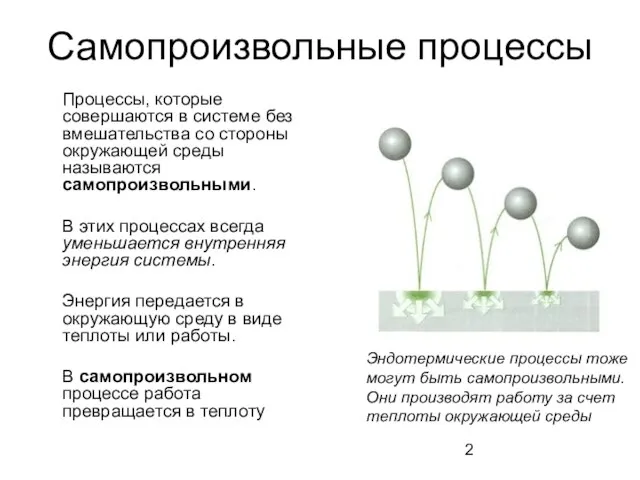
- 2. Самопроизвольные процессы Процессы, которые совершаются в системе без вмешательства со стороны окружающей среды называются самопроизвольными. В
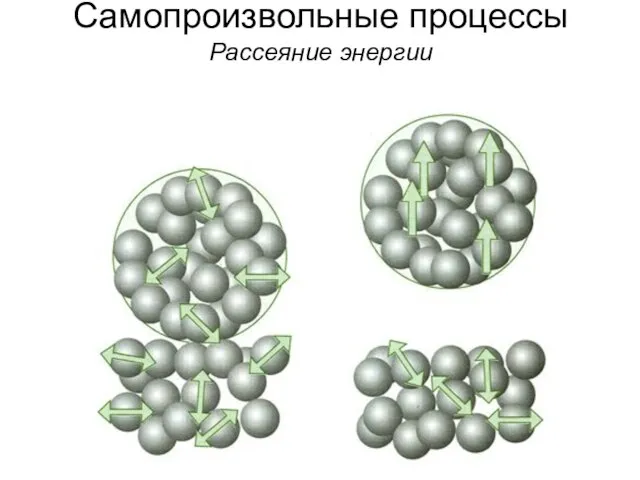
- 3. Самопроизвольные процессы Рассеяние энергии
- 4. Второй закон термодинамики Определение Невозможно протекание самопроизвольного процесса, в котором теплота превращается в работу. Только превращение
- 5. Несамопроизвольные процессы Процессы, которые не могут совершаться в системе без вмешательства со стороны окружающей среды называются
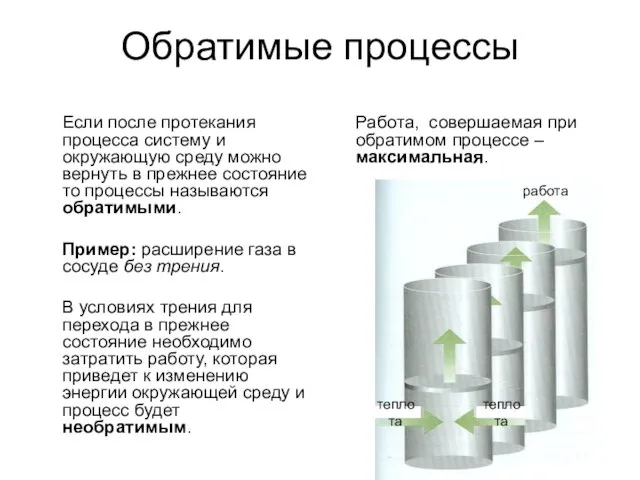
- 6. Обратимые процессы Если после протекания процесса систему и окружающую среду можно вернуть в прежнее состояние то
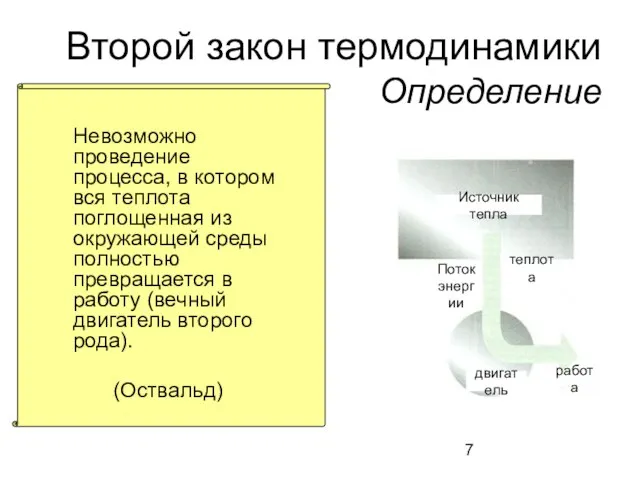
- 7. Второй закон термодинамики Определение Невозможно проведение процесса, в котором вся теплота поглощенная из окружающей среды полностью
- 8. Необратимые процессы Если после протекания процесса системы и окружающую среду нельзя вернуть в прежнее состояние без
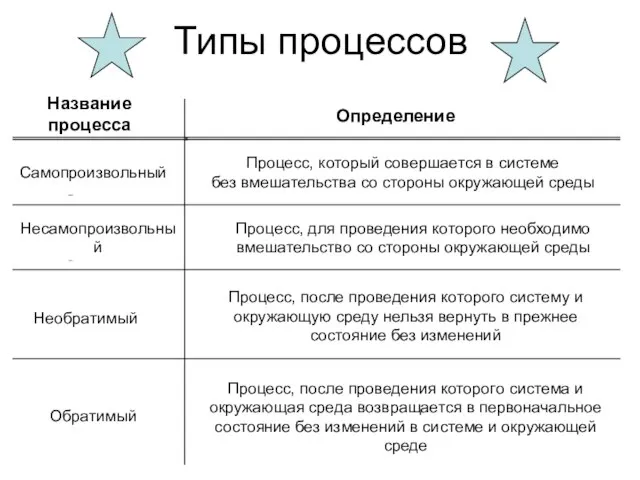
- 9. Типы процессов Название процесса Определение Самопроизвольный Несамопроизвольный Необратимый Процесс, который совершается в системе без вмешательства со
- 10. Принцип Каратеодори Для прямого процесса: Q=ΔU + W1 Для обратного процесса: ΔU = W2 Q =
- 11. Энтропия Энтропия – это функция беспорядка в системе. Во втором законе термодинамики энтропия используется для определения
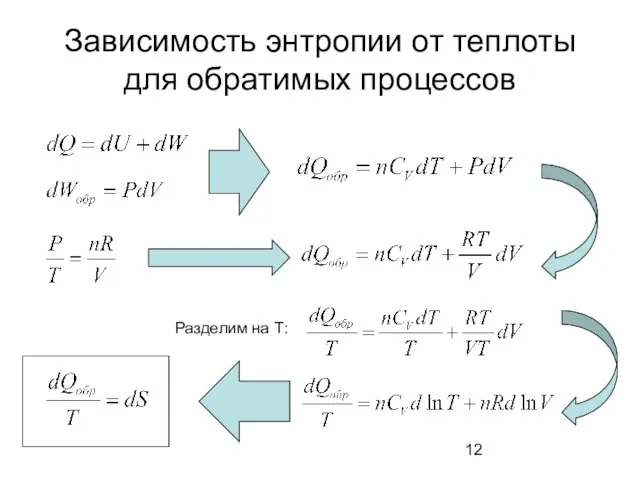
- 12. Зависимость энтропии от теплоты для обратимых процессов Разделим на Т:
- 13. Термодинамическое определение энтропии В результате физического или химического процесса всегда происходит изменение энтропии. Изменение энтропии показывает
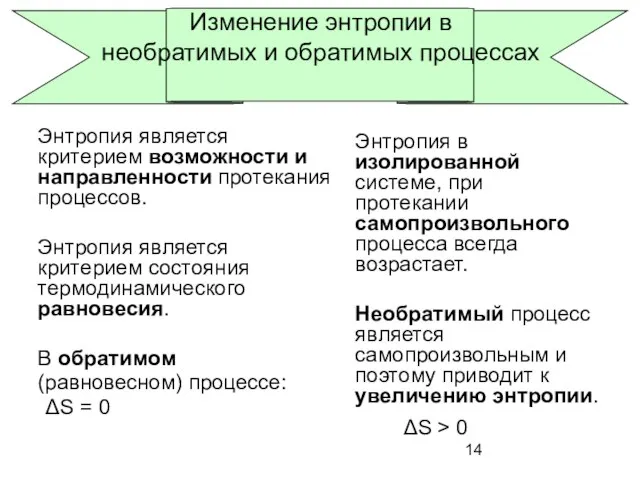
- 14. Изменение энтропии в необратимых и обратимых процессах Энтропия является критерием возможности и направленности протекания процессов. Энтропия
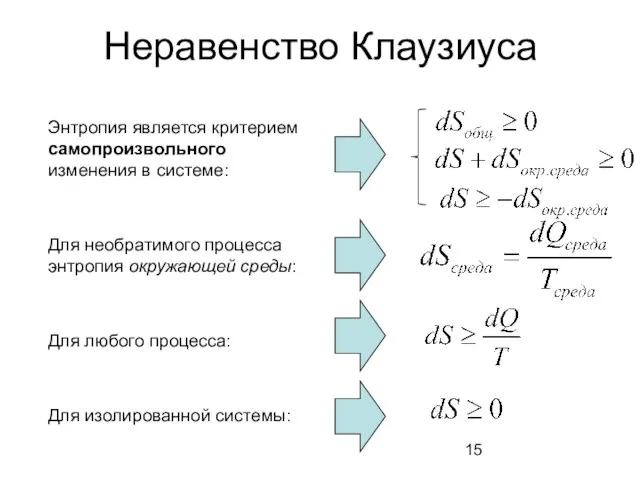
- 15. Неравенство Клаузиуса Энтропия является критерием самопроизвольного изменения в системе: Для необратимого процесса энтропия окружающей среды: Для
- 16. Применение неравенства Клаузиуса Пример 1. Неравновесный адиабатический процесс Для любого типа самопроизвольного процесса энтропия возрастает. Теплота
- 17. Применение неравенства Клаузиуса Пример 2. Необратимый изотермический процесс (Т = const) если газ расширяется самопроизвольно в
- 18. Применение неравенства Клаузиуса Пример 3. Необратимое охлаждение источник энергии: холодильник: Общее изменение энтропии: Вывод: необратимое охлаждение
- 19. Второй закон термодинамики Определение Невозможно проведение процесса, в котором теплота передается от холодного тела к горячему.
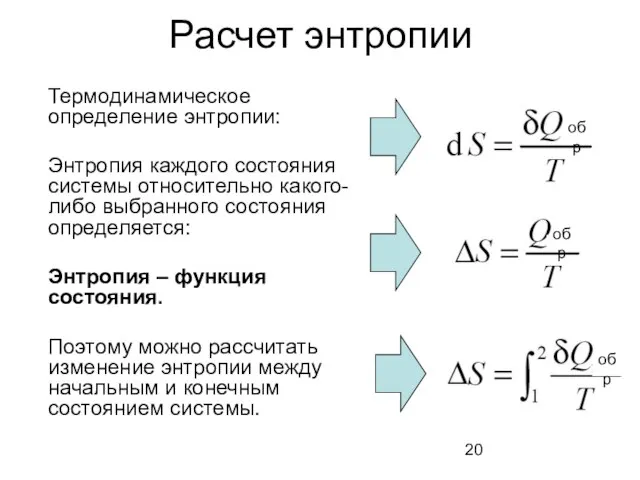
- 20. Расчет энтропии Термодинамическое определение энтропии: Энтропия каждого состояния системы относительно какого-либо выбранного состояния определяется: Энтропия –
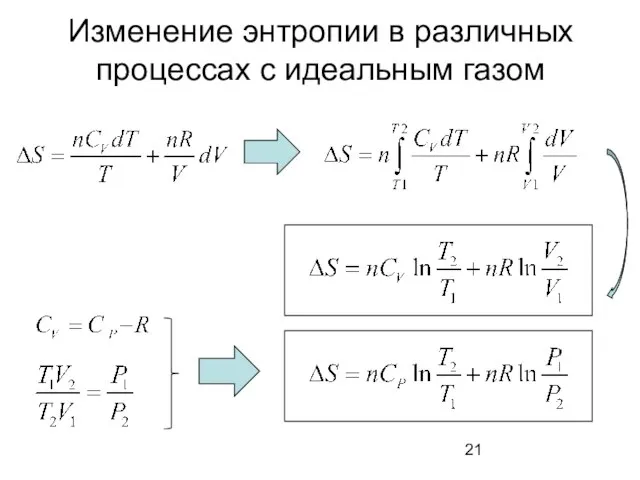
- 21. Изменение энтропии в различных процессах с идеальным газом
- 22. Изменение энтропии в изотермическом процессе Или:
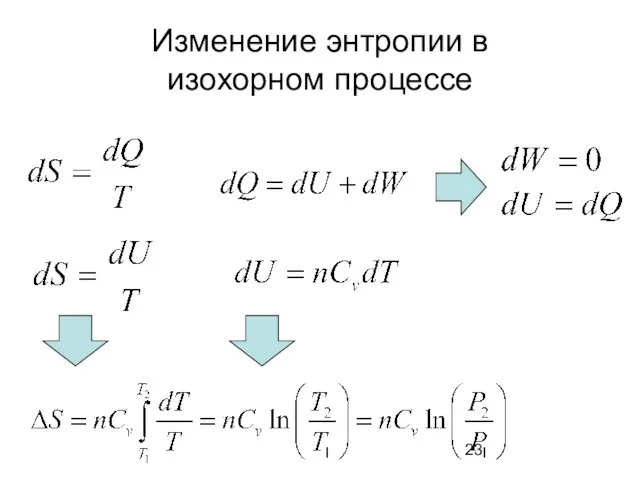
- 23. Изменение энтропии в изохорном процессе
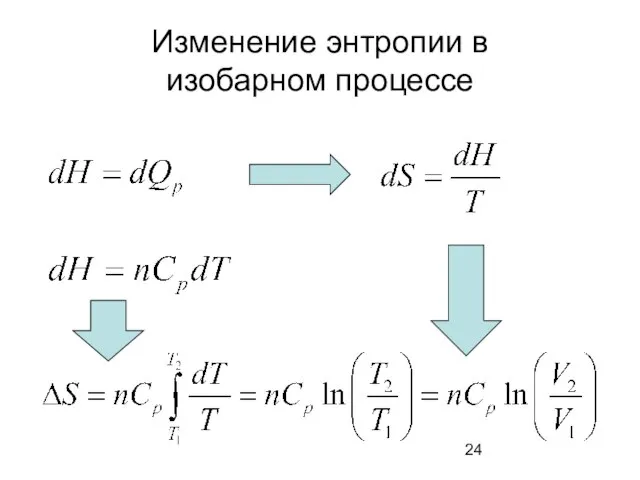
- 24. Изменение энтропии в изобарном процессе
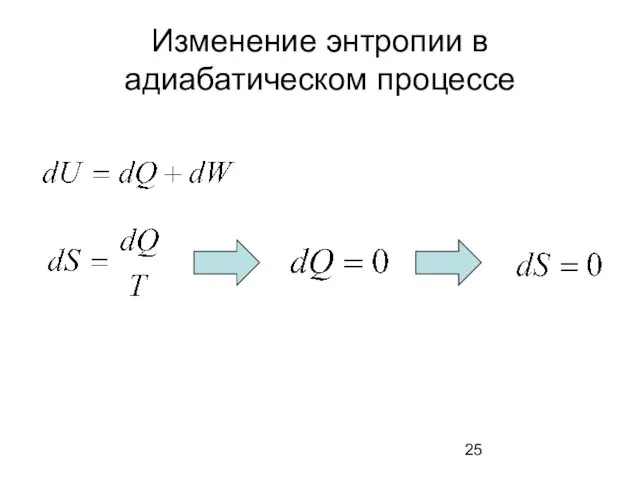
- 25. Изменение энтропии в адиабатическом процессе
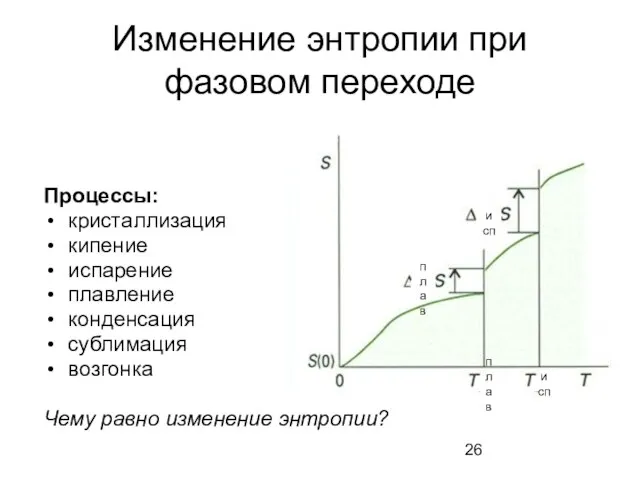
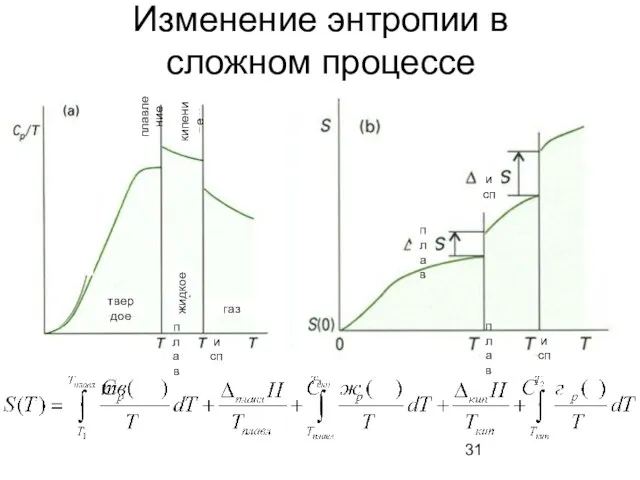
- 26. Изменение энтропии при фазовом переходе Процессы: кристаллизация кипение испарение плавление конденсация сублимация возгонка Чему равно изменение
- 27. Правило Трутона При постоянном давлении: Изменение молярной энтропии: Правило Трутона Экзотермические процессы ( ): - кристаллизация
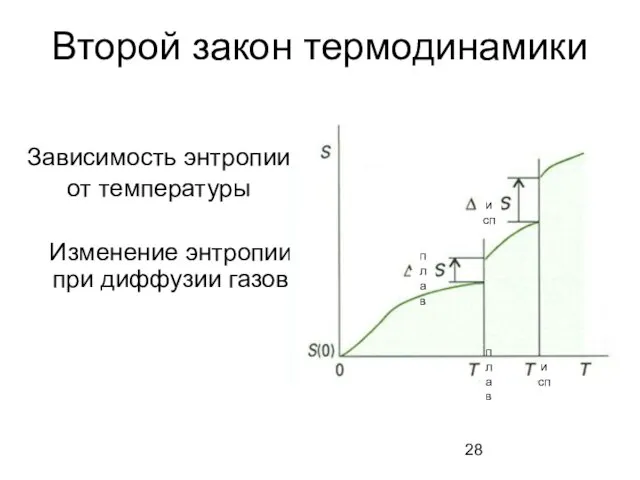
- 28. Второй закон термодинамики Зависимость энтропии от температуры Изменение энтропии при диффузии газов исп плав плав исп
- 29. Зависимость энтропии от температуры P = const: если Cp = const:
- 30. Зависимость энтропии от температуры если Cv = const: V = const:
- 31. Изменение энтропии в сложном процессе исп плав плав исп твердое газ плав исп жидкое кипение плавление
- 32. Изменение энтропии при диффузии газов Диффузия – это самопроизвольный необратимый процесс Xi – мольная доля
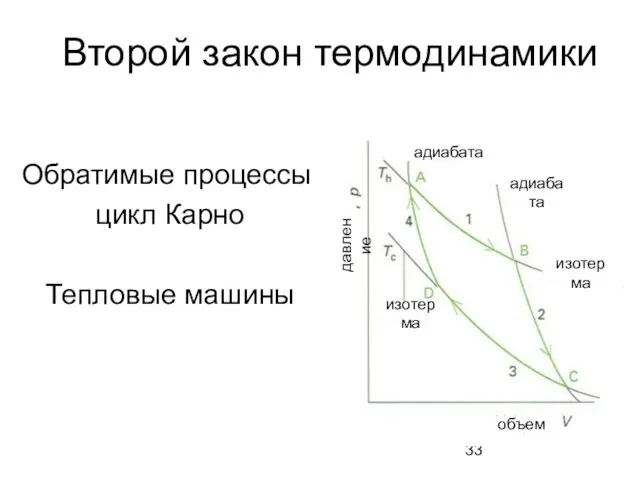
- 33. Второй закон термодинамики Обратимые процессы: цикл Карно Тепловые машины адиабата адиабата объем изотерма изотерма давление
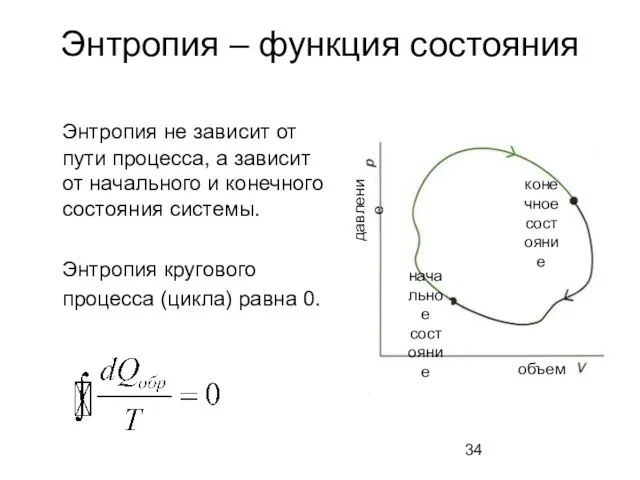
- 34. Энтропия – функция состояния Энтропия не зависит от пути процесса, а зависит от начального и конечного
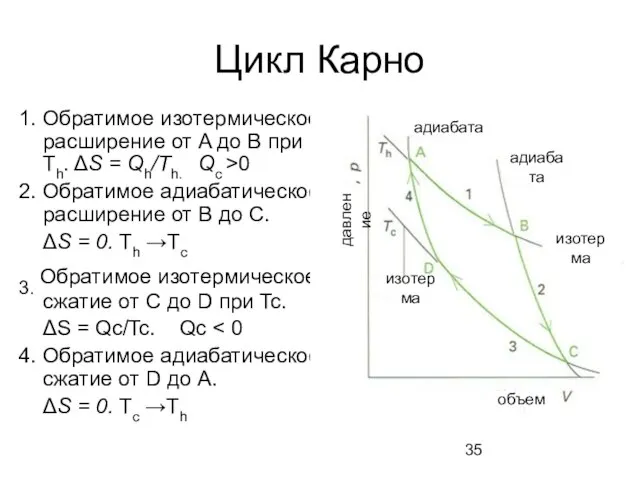
- 35. Цикл Карно 1. Обратимое изотермическое расширение от A до B при Th. ΔS = Qh/Th. Qc
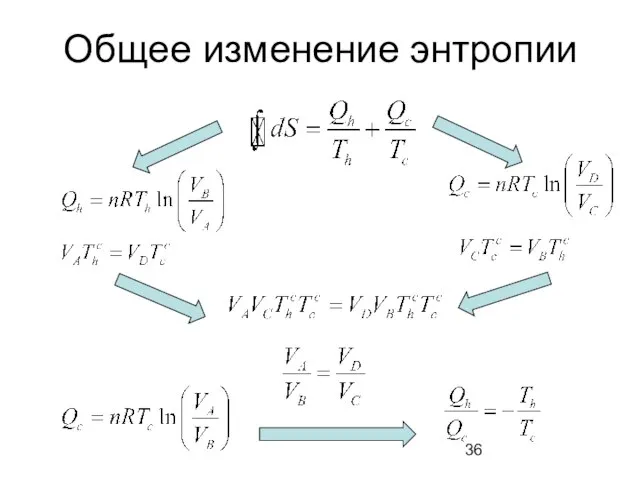
- 36. Общее изменение энтропии
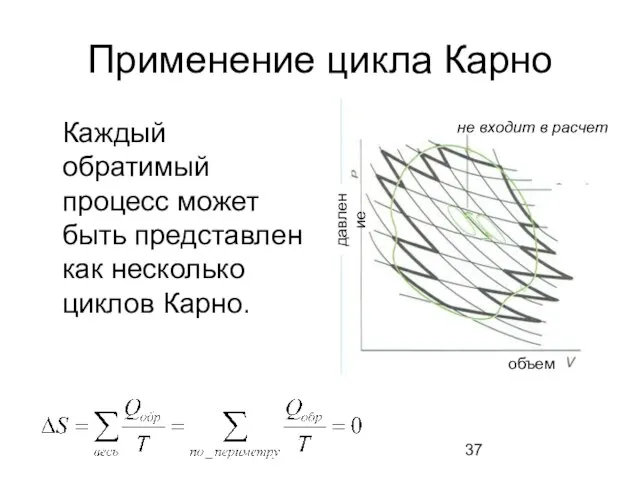
- 37. Применение цикла Карно Каждый обратимый процесс может быть представлен как несколько циклов Карно. давление объем не
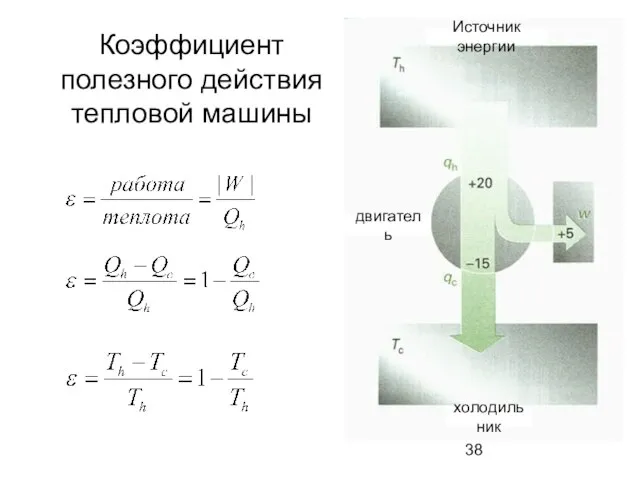
- 38. Коэффициент полезного действия тепловой машины холодильник Источник энергии двигатель
- 39. Теорема Нернста Изменение энтропии при любом физическом или химическом процессе стремится к нулю, если температура стремится
- 40. Третий закон термодинамики Если энтропию каждого элемента в его наиболее стабильном состоянии принять равной нулю при
- 41. Энтропия химической реакции Стандартная энтропия химической реакции ΔS° - это разность между суммой молярных энтропий продуктов
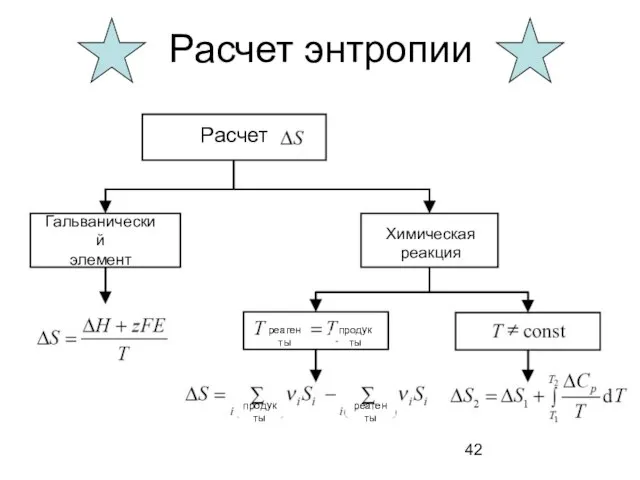
- 42. Расчет энтропии Гальванический элемент продукты Химическая реакция Расчет реагенты продукты реагенты
- 43. Критерий самопроизвольного процесса В изолированной системе при постоянном объеме и постоянной внутренней энергии энтропия увеличивается если
- 45. Скачать презентацию

















 Опасные места
Опасные места 20140317_merzlikinaip_doc
20140317_merzlikinaip_doc ВИЧ и СПИД
ВИЧ и СПИД Анатомия
Анатомия Электронный документооборот как инструмент борьбы с бюрократией
Электронный документооборот как инструмент борьбы с бюрократией Винсент Виллем ван Гог
Винсент Виллем ван Гог Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие
Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие Преобразования фигур в пространстве
Преобразования фигур в пространстве Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое
Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА
Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА  Where is the dog?
Where is the dog? . 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти
. 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти ООО ГарантСтройХаус
ООО ГарантСтройХаус Пончики Пончкофф (фотографии)
Пончики Пончкофф (фотографии) Определение культуры. Типы культур
Определение культуры. Типы культур Искусства бумагокручения
Искусства бумагокручения Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс)
Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс) МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА…
МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА… Эффективные приёмы запоминания учебного материала
Эффективные приёмы запоминания учебного материала Административно-правовой статус
Административно-правовой статус Развитие личности младшего школьника средствами учебного диалога
Развитие личности младшего школьника средствами учебного диалога БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ
БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ Внеурочная работа по математике
Внеурочная работа по математике Слайды
Слайды ГОГОЛЬ: знакомый и незнакомый
ГОГОЛЬ: знакомый и незнакомый The Cable News Network
The Cable News Network Сила. Основы методики ее воспитания
Сила. Основы методики ее воспитания