Содержание
- 2. Аннотация Данная презентация может быть использована при изучении химии на 1 курсе по программе НПО по
- 3. Цели и задачи урока Образовательная обобщить и систематизировать знания обучающихся о классификации химических реакций отработать навыки
- 4. Содержание Аннотация Цели и задачи урока Типы химических реакций По числу вступивших в реакцию веществ По
- 5. Типы химических реакций По числу вступивших в реакцию веществ По тепловому эффекту По обратимости По изменению
- 6. По числу вступивших в реакцию веществ
- 7. Правило Бертолле В растворах электролитов реакции идут до конца в случае, если в результате образуется осадок,
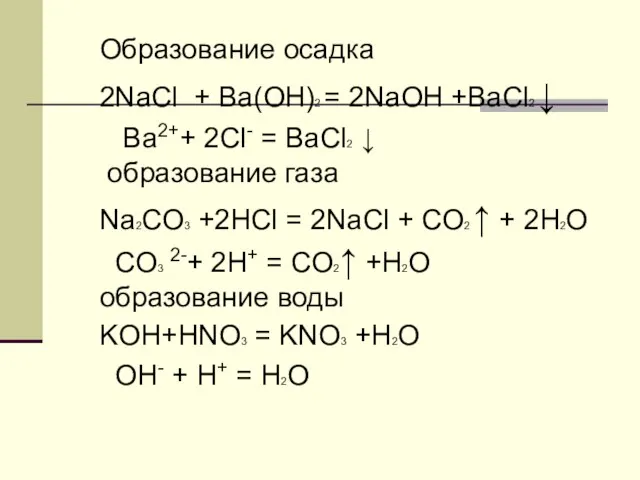
- 8. Образование осадка 2NaCl + Ba(OH)2 = 2NaOH +BaCl2 ↓ Ba2++ 2Cl- = BaCl2 ↓ образование газа
- 9. По тепловому эффекту Экзотермические - идут с выделение теплоты S + O2 = SO2 + Q
- 10. По обратимости Необратимые - идут только в одном направлении Условия: образование осадка или слабого электролита (Н2О),
- 11. По изменению степени окисления Идут без изменения степени окисления элементов CaCO3 = CaO + CO2 Окислительно
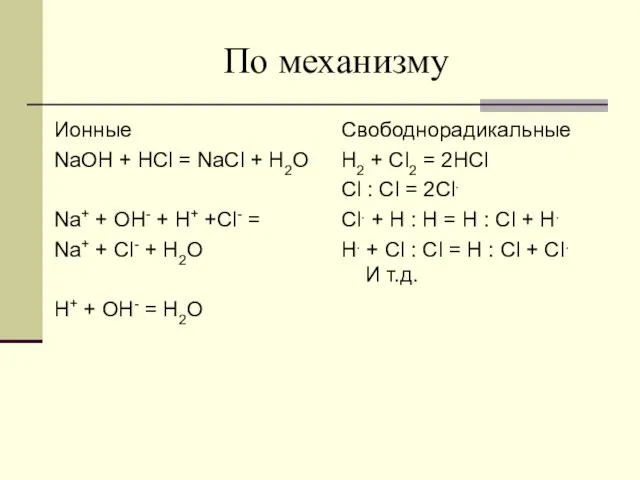
- 12. По механизму Ионные NaOH + HCl = NaCl + H2O Na+ + OH- + H+ +Cl-
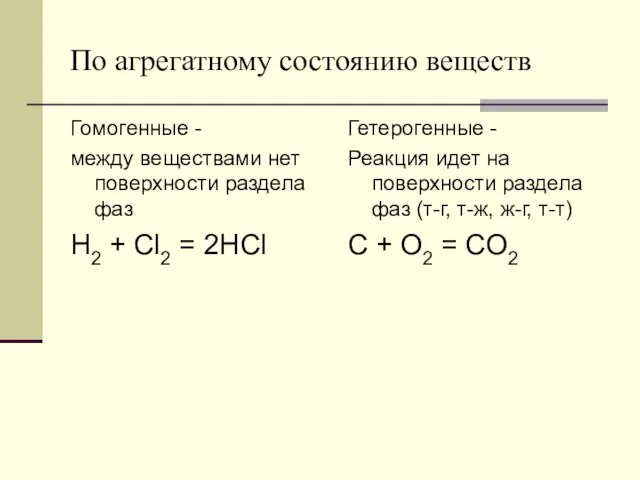
- 13. По агрегатному состоянию веществ Гомогенные - между веществами нет поверхности раздела фаз H2 + Cl2 =
- 14. Проверь себя Перепиши схемы химических реакций в тетрадь, расставьте коэффициенты. Mn(OH)2? MnO + H2O -Q FeSO4
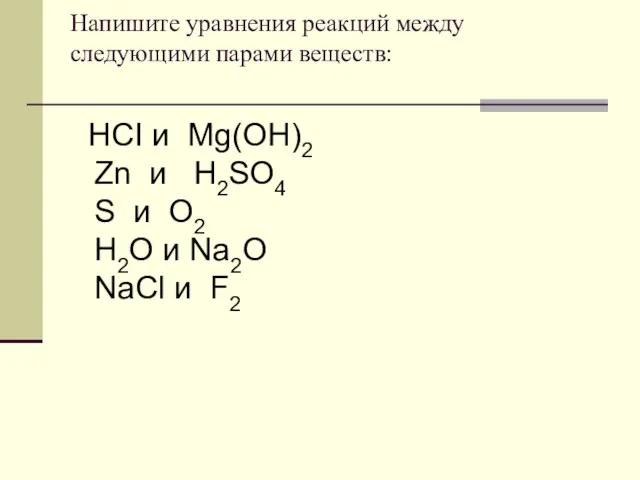
- 15. Напишите уравнения реакций между следующими парами веществ: HCI и Mg(OH)2 Zn и H2SO4 S и O2
- 16. Вывод Поставленные цели урока достигнуты
- 18. Скачать презентацию











 Статистические методы исследования алгоритмов текстового ранжирования поисковых систем
Статистические методы исследования алгоритмов текстового ранжирования поисковых систем Atomausstieg in deutschland. Wie kann das gehen
Atomausstieg in deutschland. Wie kann das gehen Звук
Звук Проекты
Проекты Национальные особенности и культура ирландцев
Национальные особенности и культура ирландцев Королевские ворота
Королевские ворота Медицинское образование в России и Германии
Медицинское образование в России и Германии Кто такие левши и чем они отличаются от правшей?
Кто такие левши и чем они отличаются от правшей? Тема проекта:«Январь - году начало, зиме середина».
Тема проекта:«Январь - году начало, зиме середина». Основы инфокоммуникационных технологийЧасть 2 – Транспортные сети
Основы инфокоммуникационных технологийЧасть 2 – Транспортные сети Летающая модель самолёта
Летающая модель самолёта Презентация уроков русского языка по теме «Причастие» в 7 классе
Презентация уроков русского языка по теме «Причастие» в 7 классе Растительный орнамент
Растительный орнамент 20140209_ekologicheskie_problemy_stavropolskogo_kraya
20140209_ekologicheskie_problemy_stavropolskogo_kraya Особенности организации многоклеточных животных
Особенности организации многоклеточных животных Categories of morality
Categories of morality Lektsia-Praktikum_50-51
Lektsia-Praktikum_50-51 Стоял в поле теремок. Бежала мимо мышка- норушка. Увидела теремок, остановилась и спрашивает:
Стоял в поле теремок. Бежала мимо мышка- норушка. Увидела теремок, остановилась и спрашивает: МИД России
МИД России Анализ стихотворения А.С.Пушкина «Анчар»
Анализ стихотворения А.С.Пушкина «Анчар» Энергия топлива.Удельная теплота сгорания
Энергия топлива.Удельная теплота сгорания МОЛОДЕЖНАЯ СУБКУЛЬТУРА
МОЛОДЕЖНАЯ СУБКУЛЬТУРА Использование информационных технологий на уроках в начальной школе МБУО «Новообинцевская средняя общеобразовательная школа»К
Использование информационных технологий на уроках в начальной школе МБУО «Новообинцевская средняя общеобразовательная школа»К Презентация на тему Достоевский Федор Михайлович
Презентация на тему Достоевский Федор Михайлович Критерии оценки партнеров на межбанковском рынке.
Критерии оценки партнеров на межбанковском рынке. В гостях у Золушки
В гостях у Золушки МЕДИЦИНСКИЕ РЕГИСТРЫ
МЕДИЦИНСКИЕ РЕГИСТРЫ Урок физики в 11 классе. Разработала: Андреева И.Ю. учитель физики МОУ СОШ № 53 г. Томска.
Урок физики в 11 классе. Разработала: Андреева И.Ю. учитель физики МОУ СОШ № 53 г. Томска.