Слайд 2АТОМЫ
Na0 - 1s22s22p63s1
Mg0 - 1s22s22p63s2
F0 - 1s22s22p5
Cl0 - 1s22s22p63s23p5
число протонов и

электронов одинаковое количество, атом нейтрален.
Слайд 3ИОНЫ
Na1+ - 1s22s22p63s0
Mg2+ - 1s22s22p63s0
F1- - 1s22s22p6
Cl1- - 1s22s22p63s23p6
Число

протонов и электронов разное – это ионы.
Слайд 4ИОНЫ – заряженные частицы, которые образуются в результате присоединения или отдачи электронов.
Если

е - отдаются – ион заряжается положительно.
Если е - присоединяются – ион заряжается отрицательно.
Слайд 5ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
ЭО атома, условная величина, характеризующая способность атома в молекуле притягивать электроны.
ЭО

в периоде увеличивается
ЭО в группе возрастает
САМЫЙ электроотрицательный элемент фтор.
Слайд 6Ионная связь
образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому.
ИОННАЯ СВЯЗЬ, образуемая

в результате электростатического притяжения.
Например: Na1+ и Cl1-, Li1+ и F1-
••
Na1+ + Cl1- = Na( :Cl:)
• •
Слайд 7Физические свойства веществ с ионным типом связи: твердые, тугоплавкие, не имеющие запаха,

часто хорошо растворимые в воде.
Вещества с ионном связью, образуют ионную кристаллическую решетку.
Слайд 8Металлическая связь
возникает в результате движения свободных электронов, которые достаточно свободно движутся в

решетке металлов, электростатически взаимодействуя с положительно заряженными ионами.
Слайд 9Физические свойства.
Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по всему

кристаллу.
Образуя единое электронное облако («электронный газ»).
Электроны обладают свойствами волны, они «размазаны» по всему куску металла.
В этом типе связи электроны обусловливают высокую тепло- и электропроводность, металлический блеск
Слайд 10Ковалентная связь
наиболее общий вид химической связи, возникающий за счет образования общей электронной

пары
обменный механизм - когда каждый из взаимодействующих атомов поставляет по одному электрону
донорно-акцепторный механизм - электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
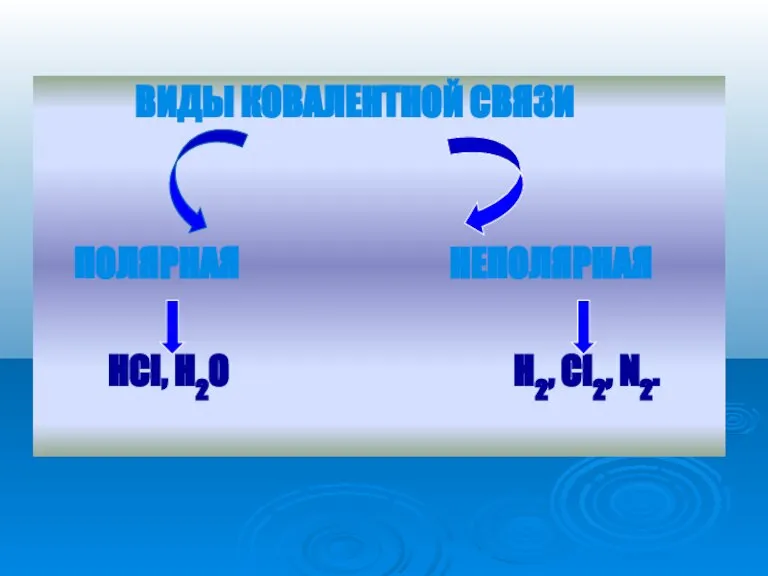
Слайд 11 ВИДЫ КОВАЛЕНТНОЙ СВЯЗИ
ПОЛЯРНАЯ НЕПОЛЯРНАЯ
HCl, H2O H2, Cl2, N2.
Слайд 12Образование полярной и неполярной связи.
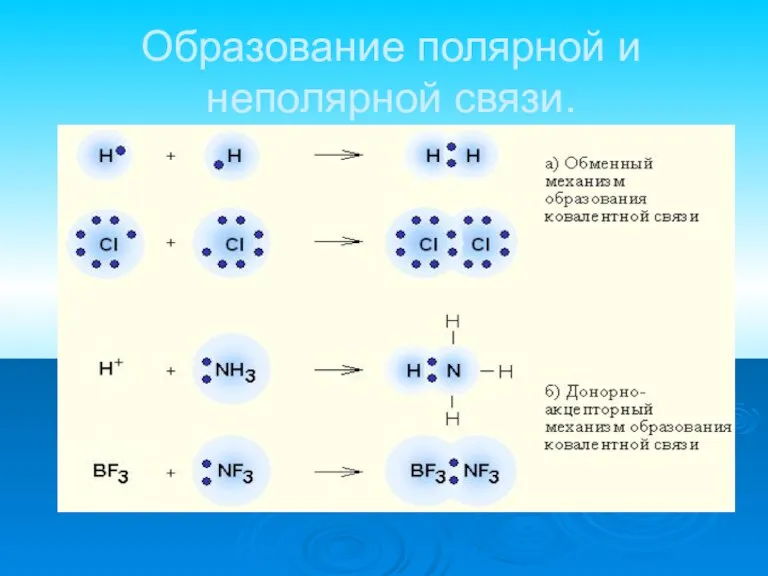
Слайд 13Ковалентная полярная связь образуется между атомами различных неметаллов.
Схема образования ковалентной полярной

связи:
•• •• H* + •Cl:=H : Cl:
•• ••
Слайд 14ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ
АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ (SiO2).
Они состоят из

атомов, связанных друг с другом в бесконечный трехмерный каркас.
Атомный каркас обладает высокой прочностью.
Кристаллы твердые, тугоплавкие, без запаха, в воде нерастворимы.
Слайд 15ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ
В УЗЛАХ – НАХОДЯТСЯ МОЛЕКУЛЫ.
УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ

СИЛАМИ.
ВЕЩЕСТВА ЛЕГКОПЛАВКИ, ЧАСТО ИМЕЮТ ЗАПАХ.
ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРЕДСТАВЛЯЮТ СОБОЙ ЖИДКОСТИ (ВОДА,БРОМ), ГАЗЫ (КИСЛОРОД, АЗОТ) ИЛИ ЛЕГКОПЛАВКИЕ ТВЕРДЫЕ ВЕЩЕСТВА (ИОД, СЕРА)
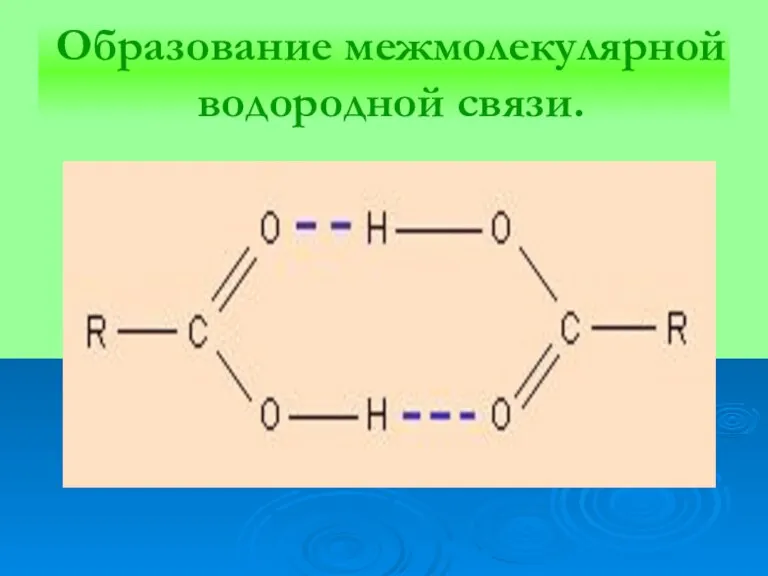
Слайд 16ВОДОРОДНАЯ СВЯЗЬ
вид химической связи типа
А — Н...А — Н ,образуется

в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др.).
Слайд 17
Образование межмолекулярной водородной связи.
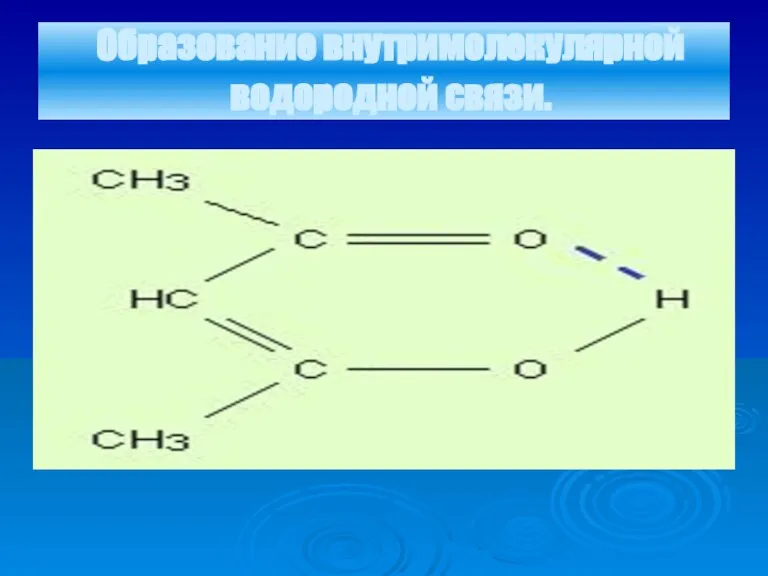
Слайд 18Образование внутримолекулярной водородной связи.

















 ТУЛЬСКИЙ ФИЛИАЛ С 20 ИЮНЯ 2012 ГОДА ОСУЩЕСТВЛЯЕТ НАБОР ПО ПРОГРАММАМ БАКАЛАВРИАТА.
ТУЛЬСКИЙ ФИЛИАЛ С 20 ИЮНЯ 2012 ГОДА ОСУЩЕСТВЛЯЕТ НАБОР ПО ПРОГРАММАМ БАКАЛАВРИАТА. Комп’ютерні телекомунікації в системі загальної середньої освіти
Комп’ютерні телекомунікації в системі загальної середньої освіти Арт-студия фантазия МБУ ДО Калейдоскоп
Арт-студия фантазия МБУ ДО Калейдоскоп Команда N&J. 4 неделя
Команда N&J. 4 неделя Брестская крепость
Брестская крепость За́мок для сказочного героя
За́мок для сказочного героя 90 лет Энергетическому техникуму
90 лет Энергетическому техникуму Факторы, влияющие на скорость химических реакций
Факторы, влияющие на скорость химических реакций Презентация на тему Русская икона
Презентация на тему Русская икона  Стандартный вид числа
Стандартный вид числа Процесс и его компоненты
Процесс и его компоненты  Подземная разработка месторождений полезных ископаемых. Специальности МАГУ
Подземная разработка месторождений полезных ископаемых. Специальности МАГУ ОБУЧЕНИЕ ГРАМОТЕ в 1 классе
ОБУЧЕНИЕ ГРАМОТЕ в 1 классе Vegetables (1-2ой год обучения)
Vegetables (1-2ой год обучения) Коллекция эфирных масел Священного писания
Коллекция эфирных масел Священного писания Идеи для рукоделия. Пуговицы + фантазия. Подборка креативных идей нетрадиционного использования пуговиц
Идеи для рукоделия. Пуговицы + фантазия. Подборка креативных идей нетрадиционного использования пуговиц Декларация на товары
Декларация на товары Программа создания национального домена .РФ на основе кириллицы Андрей Колесников АНО «Координационный центр национального доме
Программа создания национального домена .РФ на основе кириллицы Андрей Колесников АНО «Координационный центр национального доме Нормативные документы по ОАШ и Образовательному округу на базе ОАШ, принятые в 2011 году
Нормативные документы по ОАШ и Образовательному округу на базе ОАШ, принятые в 2011 году АУЕ или новая опасная молодёжная субкультура в России
АУЕ или новая опасная молодёжная субкультура в России What language do dolphins speak?
What language do dolphins speak? Организация СП, СПТ, П
Организация СП, СПТ, П Материал и образ. Скрутим куклу ладную, милую нарядную
Материал и образ. Скрутим куклу ладную, милую нарядную Королева Речь
Королева Речь Презентация на тему Что такое биоинформатика?
Презентация на тему Что такое биоинформатика? 1900-1916 история
1900-1916 история Усуни и канглы
Усуни и канглы Государственное устройство. Международные регионы. Лекция 12
Государственное устройство. Международные регионы. Лекция 12