Содержание
- 2. Урок 4. Предельные нециклические (ациклические) углеводороды. Алканы. Парафины.
- 3. План ответа: 1. Общая характеристика класса. 2. Строение. 3. Общая формула. 4. Гомологический ряд 5. Номенклатура.
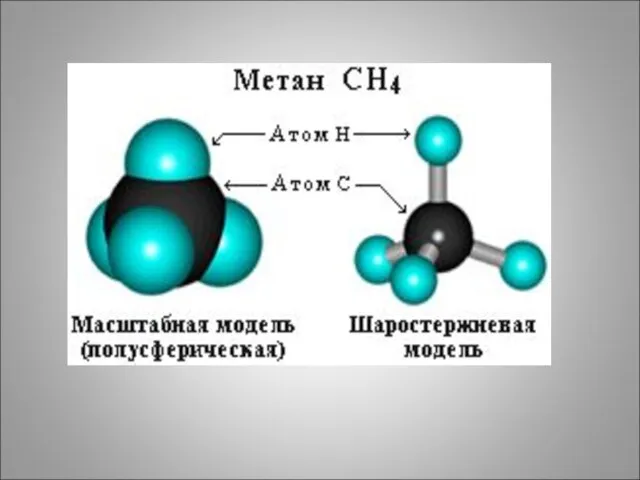
- 4. 1. Определение. Предельными углеводородами называются органические вещества, в молекулах которых атомы углерода связаны простой (одинарной связью),
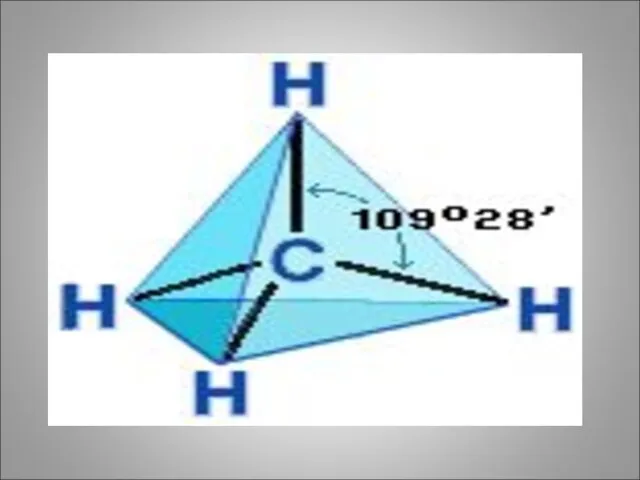
- 5. 2. Строение: а) атом углерода находится в возбуждённом состоянии, т.е. имеет четыре не спаренных электрона на
- 7. ё) атомы в молекуле могут относительно свободно вращаться вокруг химических связей. ж)Зигзагообразная цепь атомов углерода может
- 10. 3. Общая формула алканов: (CH4, C2H6,C3H8, C4H10…..) CnH2n+2
- 11. Задача: Относительная молекулярная масса предельного углеводорода 58 определите его формулу. Дано: М(СnH2n+2)=58 CnH2n+2=? решение: М(СnH2n+2)=58 12n+1(2n+2)=14n+2=58
- 12. 4. Гомологический ряд: Органические вещества сходного строения (имеющие одну общую формулу) и отличающиеся друг от друга
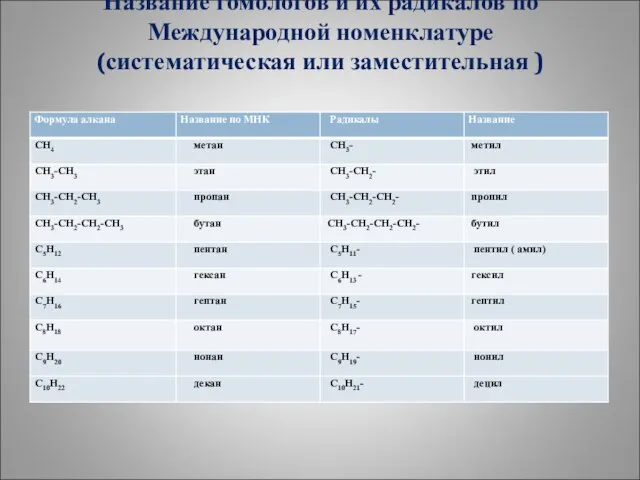
- 13. Название гомологов и их радикалов по Международной номенклатуре (систематическая или заместительная )
- 14. 5. Изомерия вещества, имеющие один и тот же качественный и количественный состав, но отличающиеся по своему
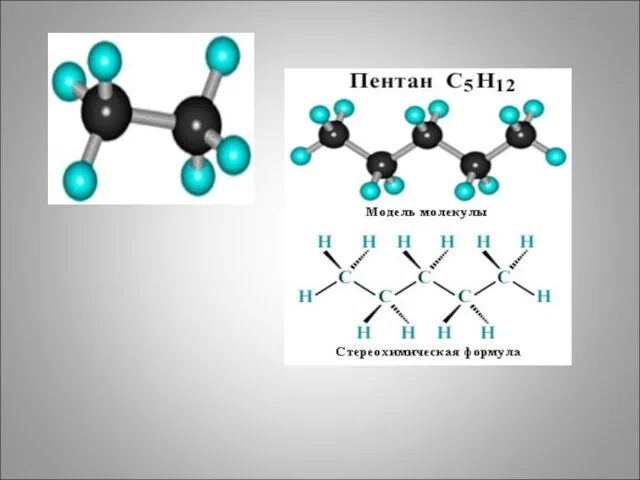
- 15. Для алканов характерна самая простая изомерия - структурная изомерия углеводородного скелета Пример: Алкан нормального строения СН3-СН2-СН2-СН2-СН3
- 16. 6.Номенклатура ( МНК) Чтобы составить название углеводорода с разветвлённой цепью, его рассматривают как продукт замещения атомов
- 17. Порядок действий : а. выделяют в структурной формуле наиболее длинную углеродную цепь и нумеруют атомы углерода,
- 18. б) в названии вещества цифрой указывают, при каком атоме углерода находится замещающая группа(радикал); в) если замещающих
- 19. г) когда разветвление начинается при атомах углерода, равноудалённых от концов главной цепи, нумерацию ведут с того
- 20. д) название записывают, начиная с младшего радикал –заместителя; или по алфавиту е) в конце пишут название
- 21. 7. Получение алканов: а) из природного газа б) из нефти
- 22. 8. Физические свойства: СH4 СН3-СН3 -СН3СН2 –СН3 газы СН3-СН2-СН2-СН3 СН3-СН2-СН2-СН2-СН3 СН3-СН2-СН2-СН2-СH2 - СН3 C7H16 C8H18 C9H20
- 23. 9.Химические свойства: 1. Все органические вещества горят с образованием углекислого газа и воды, этот процесс называется
- 24. 2. Дегидрирование( отнятие водорода) 5000С CH3-CH3 => CH2=CH2 + H2 10000C СH4 => C +2H2 15000C
- 25. 3.Реакция замещения водорода на галоген. Механизм реакции цепной свободно-радикальный ( пояснение на доске) Начинается с разрыва
- 27. Скачать презентацию




















 Тема урока:Прикладная среда графического редактора Paint.
Тема урока:Прикладная среда графического редактора Paint. Презентация на тему Система национальных счетов
Презентация на тему Система национальных счетов Двадцатилетний брак великого князя Московского Василия III с Соломонией Сабуровой был бесплоден. Отправив законную жену в монастыр
Двадцатилетний брак великого князя Московского Василия III с Соломонией Сабуровой был бесплоден. Отправив законную жену в монастыр Cn(H2O)m
Cn(H2O)m 20140111_prezentatsiya_k_igre
20140111_prezentatsiya_k_igre Умей предупреждать болезни
Умей предупреждать болезни Еженедельное совещание. Статус работ блока Геология и разработка
Еженедельное совещание. Статус работ блока Геология и разработка Изделие Святой Николаус-Чудотворец
Изделие Святой Николаус-Чудотворец Среднее арифметическое, мода и размах ряда.
Среднее арифметическое, мода и размах ряда. Амплуа игроков в волейболе и их функции
Амплуа игроков в волейболе и их функции Страховые представители АО Страховая компания СОГАЗ-Мед
Страховые представители АО Страховая компания СОГАЗ-Мед «EVA 2011 Москва» 28 – 30 ноября 2011 Сбор и долговременное сохранение электронной информации в сфере культуры. Л.А. Куйбышев, Н.В. Браккер,
«EVA 2011 Москва» 28 – 30 ноября 2011 Сбор и долговременное сохранение электронной информации в сфере культуры. Л.А. Куйбышев, Н.В. Браккер,  Диего Веласкес. Сдача Бреды 1634–1635
Диего Веласкес. Сдача Бреды 1634–1635 К НЕМУ НЕ ЗАРАСТЕТНАРОДНАЯ ТРОПА А. С. Пушкину посвящается…
К НЕМУ НЕ ЗАРАСТЕТНАРОДНАЯ ТРОПА А. С. Пушкину посвящается… тема: «Воображение как общая способность»
тема: «Воображение как общая способность»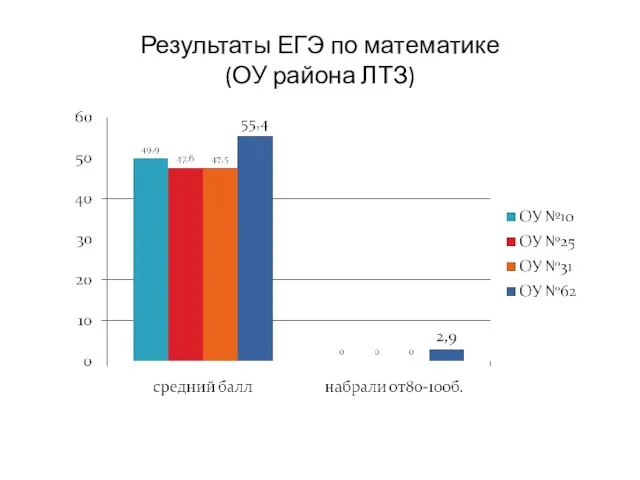 Результаты ЕГЭ по математике (ОУ района ЛТЗ)
Результаты ЕГЭ по математике (ОУ района ЛТЗ) Качество влияния личности на ход истории (на примере А. Гитлера и И. Сталина)
Качество влияния личности на ход истории (на примере А. Гитлера и И. Сталина) Организация обучения учителей по курсу «Основы религиозных культур и светской этики» в Калининградской области
Организация обучения учителей по курсу «Основы религиозных культур и светской этики» в Калининградской области ООО Глобал Контейнер Лоджистикс
ООО Глобал Контейнер Лоджистикс Жак Рене Ширак
Жак Рене Ширак Игра в слова
Игра в слова Бизнес-план Пончиковой
Бизнес-план Пончиковой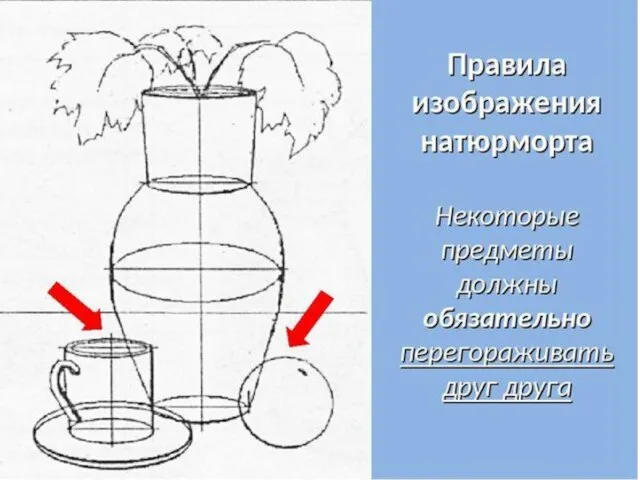 Занятие 3 года обучения на каникулах. Декоративный натюрморт
Занятие 3 года обучения на каникулах. Декоративный натюрморт Лабораторная группаРезультаты серологического этапа ДЭН выводы, задачи2008 год
Лабораторная группаРезультаты серологического этапа ДЭН выводы, задачи2008 год Виды наказаний
Виды наказаний Ультразвуковой датчик
Ультразвуковой датчик Легенды театральной сцены
Легенды театральной сцены ПОДПИСКА
ПОДПИСКА