Содержание
- 2. 1. ОСНОВНЫЕ ЗАКОНЫ ИДЕАЛЬНЫХ ГАЗОВ Идеальный газ Закон Бойля — Мариотта: при постоянной температуре объем, занимаемый
- 3. Закон Гей-Люссака: при постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально
- 4. 2. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ (2.3)
- 5. Молекулярно-кинетическая теория газов устанавливает прямую пропорциональность между средней кинетической энергией молекул и абсолютной температурой: (2.4)
- 6. Объединенный закон Бойля — Мариотта и Гей-Люссака. (2.5) (2.6) R - удельная газовая постоянная (2.7) (2.7)
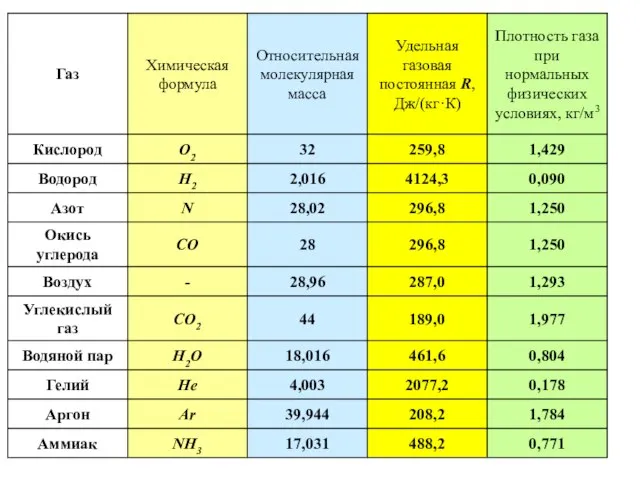
- 7. Удельная газовая постоянная R представляет собой физическую постоянную, которая для каждого газа принимает вполне определенное значение,
- 8. Физический смысл удельной газовой постоянной Удельная газовая постоянная есть работа в джоулях 1 кг газа в
- 9. Единица удельной газовой постоянной:
- 10. 3. УНИВЕРСАЛЬНОЕ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Закон АВОГАДРО: при одинаковых температурах и давлениях в равных объемах
- 11. Молярной массой газа (вещества) называется отношение массы m системы к количеству газа (вещества) υ этой системы:
- 12. Отношение плотностей газов в уравнении (а) заменим обратным отношением удельных объемов При одинаковых физических условиях произведение
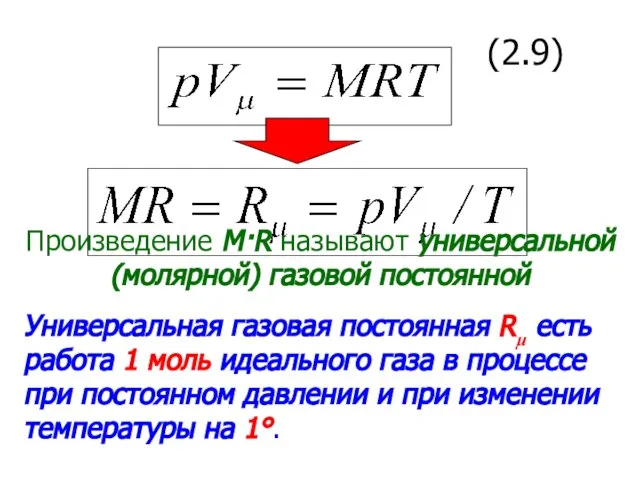
- 13. (2.9) Произведение M·R называют универсальной (молярной) газовой постоянной Универсальная газовая постоянная Rμ есть работа 1 моль
- 14. Нормальные физические условия (давление 101 325 Па и температура 273,15 К) Объем 1 моль газа равен
- 17. Скачать презентацию












 Биоинформатика
Биоинформатика Применение пиринговой системы электронной наличности для покупок в Премиум магазине wargaming.net
Применение пиринговой системы электронной наличности для покупок в Премиум магазине wargaming.net Полимеры
Полимеры Mana izpratne par skaisto
Mana izpratne par skaisto Модульное обучение
Модульное обучение Прикладное искусство первой половины ХХ века
Прикладное искусство первой половины ХХ века Тестирование знаний об имени числительном
Тестирование знаний об имени числительном Способы очистки питьевой воды
Способы очистки питьевой воды Презентация
Презентация Природные зоны Земли
Природные зоны Земли Деструктивные культы и общество: симбиоз или паразитизм
Деструктивные культы и общество: симбиоз или паразитизм Теория радиоактивных методов
Теория радиоактивных методов Презентация на тему Математика и природа
Презентация на тему Математика и природа  Изображение в фотографии и в живописи
Изображение в фотографии и в живописи Воздушное законодательство РФ. Тема 6
Воздушное законодательство РФ. Тема 6 Эволюция международной валютной системы (МВС)
Эволюция международной валютной системы (МВС) Системный реестр Windows XP
Системный реестр Windows XP  Микроконтроллеры серии AVR. (Лекция 3)
Микроконтроллеры серии AVR. (Лекция 3) Продвижение Ютинет.ру в социальных медиа
Продвижение Ютинет.ру в социальных медиа Изображение характера животных. 2 класс
Изображение характера животных. 2 класс Fractals and Chaos Theory
Fractals and Chaos Theory ОТЧЕТ главы Надвоицкого городского поселения о результатах работы администрации Надвоицкого городского поселения за 2011 год
ОТЧЕТ главы Надвоицкого городского поселения о результатах работы администрации Надвоицкого городского поселения за 2011 год Система требований к электронным учебным презентациям
Система требований к электронным учебным презентациям История и перспективы развития информационных технологий
История и перспективы развития информационных технологий Проект: Создание юридического лица в организационно-правовой форме закрытое акционерное общество с участием российского и иностр
Проект: Создание юридического лица в организационно-правовой форме закрытое акционерное общество с участием российского и иностр Презентация на тему Служебные части речи. Частица
Презентация на тему Служебные части речи. Частица Праздник преподобного Сергия
Праздник преподобного Сергия Полевые транзисторы
Полевые транзисторы