Содержание
- 2. 4.1. СВОЙСТВА РЕАЛЬНЫХ ГАЗОВ
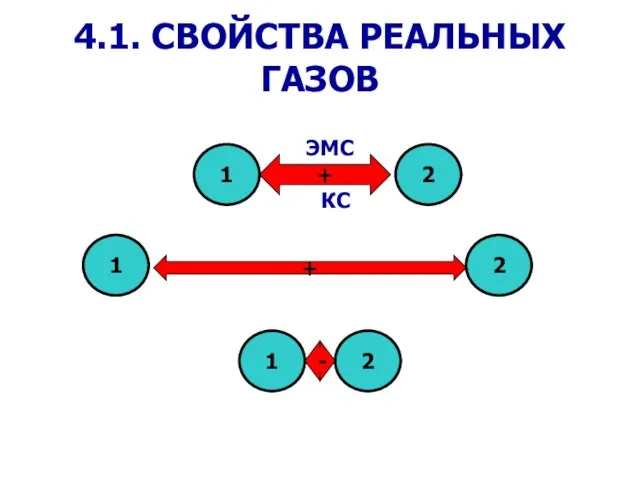
- 3. Из-за наличия сил взаимодействия между молекулами и конечности их объема законы идеальных газов ни при каких
- 5. - число Амага Температура, соответствующая изотерме с точкой минимума на оси ординат (p = 0), называется
- 6. Уравнение Боголюбова - Майера вириальные коэффициенты, выражаются через потенциальную энергию взаимодействия молекул данного газа и температуру
- 7. 4.2. УРАВНЕНИЕ СОСТОЯНИЯ ВАН-ДЕР-ВААЛЬСА Поправки, которые учитывают отклонение реального газа от идеального: первая поправка, зависящая от
- 8. Вторая поправка учитывает влияние сил взаимодействия между молекулами Поправка Δp прямо пропорциональна как числу притягиваемых, так
- 9. Уравнение Ван-дер-Ваальса (1873 г.) внутреннее давление (для воды при температуре 293 К а/v2 ≈ 1080 МПа)
- 10. Основные частные производные параметров для реального газа из уравнения Ван-дер-Ваальса:
- 11. 4.3. АНАЛИЗ УРАВНЕНИЯ ВАН-ДЕР-ВААЛЬСА - уравнение третьей степени относительно удельного объема газа 1) все три корня
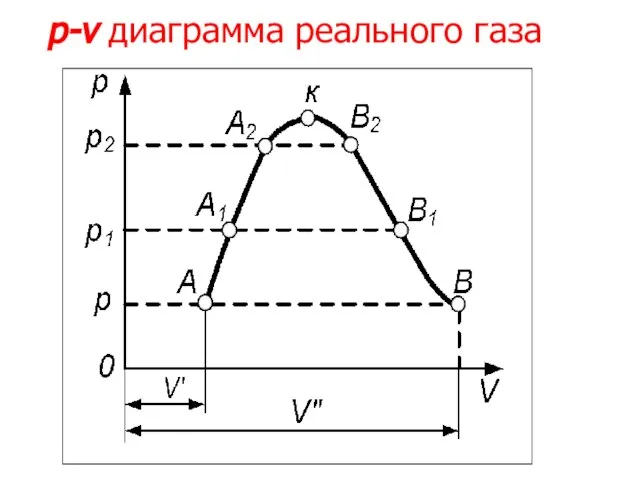
- 13. Прямая АВ, пересекающая такого типа изотерму, дает три действительных значения удельного объема в точках A, R
- 14. Кривую АК, на которой жидкость находится в состоянии кипения, называют пограничной кривой жидкости (нижней пограничной кривой);
- 15. Таким образом, для реального вещества рv-диаграмму можно разбить на три характерные области: 1) область жидкого состояния,
- 16. p-v диаграмма реального газа
- 17. Критическое состояние вещества (Менделеев, 1861 г) Критической температурой называют абсолютную температуру кипения, при которой поверхностное натяжение
- 18. (а) (б) (в) (г) (4.2) (4.4) (4.3) Критические параметры выраженные через константы уравнения а и b
- 19. Константы а и b при известных критических параметрах: (4.5) (4.6)
- 20. Уравнение Ван-дер-Ваальса в приведенных параметрах состояния. приведенное уравнение. Оно не включает никаких величин, характеризующих данное вещество,
- 21. Закон соответственных состояний В критической точке все три приведенных параметра имеют одинаковое значение, равное единице, и
- 22. Критический коэффициент Для всех термодинамических подобных веществ, подчиняющихся уравнению Ван-дер-Ваальса, критический коэффициент должен иметь постоянное значение
- 23. 4.4. УРАВНЕНИЕ СОСТОЯНИЯ ДЛЯ РЕАЛЬНЫХ ГАЗОВ М. П. ВУКАЛОВИЧА И И. И. НОВИКОВА а и b
- 24. Дифференциальное уравнение состояния: (4.9) Соотношение (4.9) дает возможность установить величины, измеряемые достаточно точно на практике, и
- 25. Отношение частной производной к объему V характеризует скорость изменения объема при нагревании, если давление остается постоянным.
- 27. Скачать презентацию





















 ПУТЕШЕСТВИЕ ПО ВОЕННО-ГРУЗИНСКОЙ ДОРОГЕ
ПУТЕШЕСТВИЕ ПО ВОЕННО-ГРУЗИНСКОЙ ДОРОГЕ КУРСОВАЯ РАБОТА по дисциплине «Контракты в международной торговле» на тему «Особенности заключения и исполнения договоров перев
КУРСОВАЯ РАБОТА по дисциплине «Контракты в международной торговле» на тему «Особенности заключения и исполнения договоров перев Влияние гласных букв и, е, ё, ю, я на произношение согласных звуков
Влияние гласных букв и, е, ё, ю, я на произношение согласных звуков Программа кандидата в председатели Студенческого совета МГЛУ
Программа кандидата в председатели Студенческого совета МГЛУ Способы размножения животных. Оплодотворение
Способы размножения животных. Оплодотворение Рисование на мятой бумаге
Рисование на мятой бумаге СЕМЕН ЗАХАРЫЧ МАРМЕЛАДОВ
СЕМЕН ЗАХАРЫЧ МАРМЕЛАДОВ Презентация на тему Спасти книги
Презентация на тему Спасти книги Моделювання кришки E-School. Урок 20
Моделювання кришки E-School. Урок 20 Обзор решений
Обзор решений Презентация на тему Сложение и вычитание векторов
Презентация на тему Сложение и вычитание векторов  Сгорание топлива. Октановое число
Сгорание топлива. Октановое число Хвороби цивілізаціи
Хвороби цивілізаціи Презентация на тему профилактика курения
Презентация на тему профилактика курения  Специальность 5В050600 -Экономика
Специальность 5В050600 -Экономика Karacabey – harmanli yerleşke projesi
Karacabey – harmanli yerleşke projesi Презентация на тему Математика. Алгоритм решения задач
Презентация на тему Математика. Алгоритм решения задач Изменения в культуре и быте в первой четверти XVIII века
Изменения в культуре и быте в первой четверти XVIII века чудеса света
чудеса света Дилемма современной жительницы мегаполиса. Конфликт интересов человека рожденного и живущего в городе, но стремящегося к природе
Дилемма современной жительницы мегаполиса. Конфликт интересов человека рожденного и живущего в городе, но стремящегося к природе Проблема голода и недоедания в современном мире
Проблема голода и недоедания в современном мире Разработка конструкции блока аутентификации водителя транспортного средства по чертам лица
Разработка конструкции блока аутентификации водителя транспортного средства по чертам лица Презентация на тему В городе богини Афины
Презентация на тему В городе богини Афины  Курс: «Социальные коммуникации»
Курс: «Социальные коммуникации» История российского герба
История российского герба CVP-анализ и маржинальный учет. Тема 5
CVP-анализ и маржинальный учет. Тема 5 Ключевые элементы успешной системы пробации
Ключевые элементы успешной системы пробации Строение периодической таблицы Д.И. Менделеева
Строение периодической таблицы Д.И. Менделеева