Слайд 2Цель урока:
Изучить основные характеристики молекул
Научиться решать вычислительные и качественные задачи с использованием

характеристик молекул и основных положений МКТ
Слайд 31.Расскажите об истории развития взглядов на природу вещества
2. Сформулируйте основные положения МКТ

и экспериментально обоснуйте факт существования, движения и взаимодействия молекул
Слайд 4Решите качественные задачи:
Поваренная соль, помещенная в воду, через некоторое время после ее

растворения равномерно распределяется по всему объему. Чем это объясняется?
Почему вблизи твердых кусочков йода серебряная ложка темнеет, покрываясь тонким слоем йодистого серебра?
Можно ли сказать, наблюдая под микроскопом броуновское движение, что мы наблюдаем непосредственно движение молекул?
При ремонте дороги запах разогретого асфальта чувствуется издалека, а запах остывшего почти не ощущается. Почему?
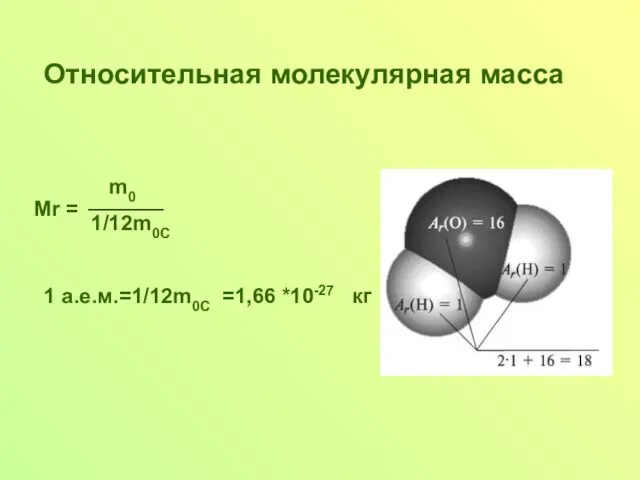
Слайд 5Относительная молекулярная масса
m0
1/12m0C
1 а.е.м.=1/12m0C =1,66 *10-27 кг
Мr =
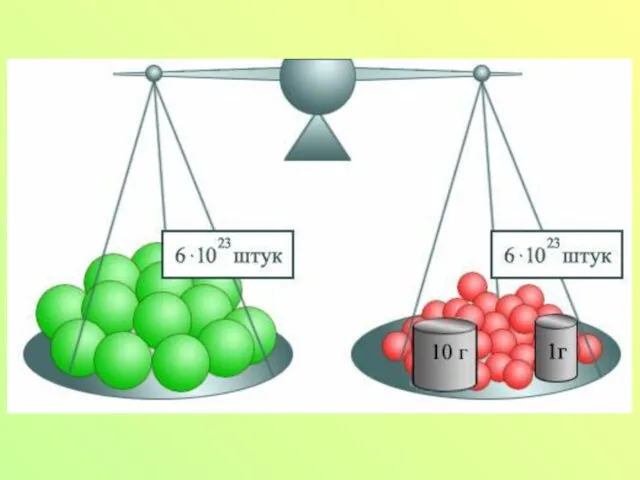
Слайд 7Количество вещества
Моль – количество вещества, содержащее столько молекул или атомов, сколько их

содержится в 0, 012 кг углерода.
Слайд 9Число Авогадро – число атомов или молекул, содержащихся в моле любого вещества

NA=6,02*1023 1/моль
Слайд 10Молярная масса – масса вещества, взятого в количестве 1 моля
М= m0 *

NA , m0 -масса одной молекулы
М= Мr *103 кг/моль
Масса вещества
m = ν *M
m= m0 * NA
m=p*V







 London. Sightseeing of London
London. Sightseeing of London Уполномоченный по защите прав участников образовательного процесса «МОУ СОШ №5»Финашиной Е.А.
Уполномоченный по защите прав участников образовательного процесса «МОУ СОШ №5»Финашиной Е.А. Основоположники физики
Основоположники физики Развитие дизайн-мышления в условиях дистанционного образования. Обобщение дистанционных педагогических практик
Развитие дизайн-мышления в условиях дистанционного образования. Обобщение дистанционных педагогических практик Проектная деятельность: формирование ключевых компетенций 1. Интеллектуальные (развитие критического мышления; умение извлекать
Проектная деятельность: формирование ключевых компетенций 1. Интеллектуальные (развитие критического мышления; умение извлекать  Мой адрес в мире
Мой адрес в мире London
London The faces of Britain
The faces of Britain Александра Ленас
Александра Ленас Образование в Великобритании
Образование в Великобритании Администрированое управлениев пенсионной системе.Опыт Хорватии: можно ли считать REGOS моделью будущего?
Администрированое управлениев пенсионной системе.Опыт Хорватии: можно ли считать REGOS моделью будущего? Нетрадиционная техника изобразительного искусства Акварель по мятой бумаге для создания объемной композиции
Нетрадиционная техника изобразительного искусства Акварель по мятой бумаге для создания объемной композиции Интернет от А до Я…
Интернет от А до Я… СОЗДАНИЕ ЭСКИЗОВ ОДЕЖДЫ НА ОСНОВЕ ПРОМЫСЛА «ГЖЕЛЬ»
СОЗДАНИЕ ЭСКИЗОВ ОДЕЖДЫ НА ОСНОВЕ ПРОМЫСЛА «ГЖЕЛЬ» Услуги и продукты: данные по Гл. Дорожному управлению
Услуги и продукты: данные по Гл. Дорожному управлению Блюда для завтрака, обеда и ужина
Блюда для завтрака, обеда и ужина Методика ТАТ
Методика ТАТ Выездная фотостудия С любовью к детям
Выездная фотостудия С любовью к детям Базы данных
Базы данных Tatiana’s day
Tatiana’s day Земельный сервитут
Земельный сервитут Портретная фотография
Портретная фотография Тесты по истории для 11-го класса
Тесты по истории для 11-го класса «Серебряный век» русской поэзии - сложное культурное явление, проявившееся в русской философской мысли, разных видах искусства, а
«Серебряный век» русской поэзии - сложное культурное явление, проявившееся в русской философской мысли, разных видах искусства, а  Необычные активности
Необычные активности Уважаемые дамы и господа! Мы предлагаем Вам воспользоваться услугами Конференц холла Бизнес Центра «КАВКАЗ», расположенного по ад
Уважаемые дамы и господа! Мы предлагаем Вам воспользоваться услугами Конференц холла Бизнес Центра «КАВКАЗ», расположенного по ад Презентация на тему Корненожки. Амеба обыкновенная
Презентация на тему Корненожки. Амеба обыкновенная Распознавание образов
Распознавание образов