В.Б.Лощенов Лаборатория Лазерной биоспектроскопии Центр естественнонаучных исследований Института общей физики им А.М.Прохорова
Содержание
- 2. Работа проводится при поддержке правительства Москвы, фонда Бортника, РАН. Основной соисполнитель ГНЦ НИОПИК.
- 3. Достоинства молекулярных фотосенсибилизаторов Высокий квантовый выход люминесценции. Низкая темновая токсичность. Они есть (в России 4 производителя:
- 4. Недостатки молекулярных фотосенсибилизаторов и магнитных растворов Необходимо: Высокая концентрация препарата в опухоли в сравнении с нормальными
- 5. В чем преимущества наночастиц и нанотехнологий для клинического применения? Какие физические свойства отвечают за эффективность их
- 6. Размер имеет значение Преимущество 1. Существует принципиальная возможность достигнуть значительного (10-100 раз) накопления нанофотосенсибилизаторов в опухоли
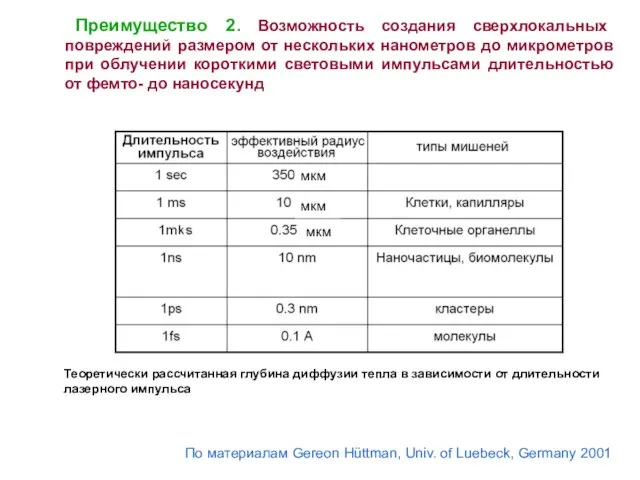
- 7. Преимущество 2. Возможность создания сверхлокальных повреждений размером от нескольких нанометров до микрометров при облучении короткими световыми
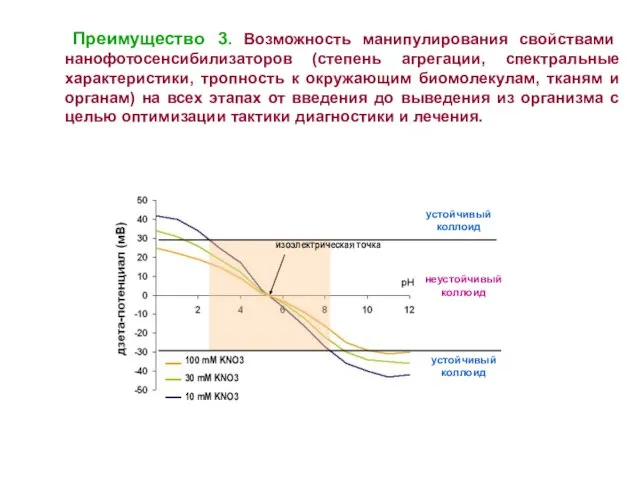
- 8. Преимущество 3. Возможность манипулирования свойствами нанофотосенсибилизаторов (степень агрегации, спектральные характеристики, тропность к окружающим биомолекулам, тканям и
- 9. Преимущество 4. Более широкие возможности использования методов физического воздействия для терапии (световое, включая ближний инфракрасный диапазон,
- 10. Примеры некоторых разрабатываемых нами наночастиц и нанотехнологий в сотрудничестве с другими организациями и отдельными исследователями
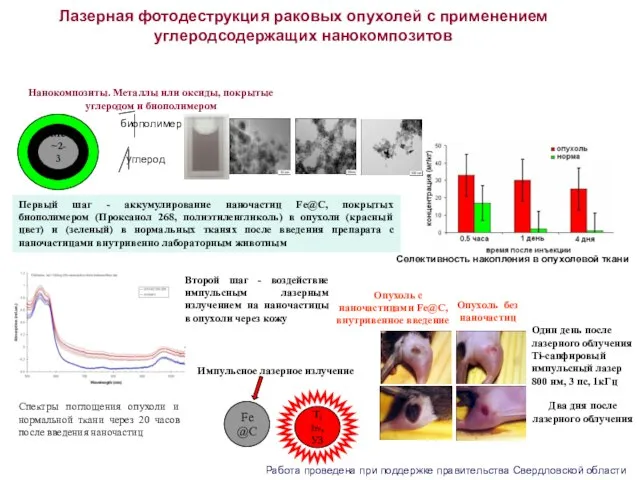
- 11. Лазерная фотодеструкция раковых опухолей с применением углеродсодержащих нанокомпозитов Fe@C T, hν, УЗ Импульсное лазерное излучение Нанокомпозиты.
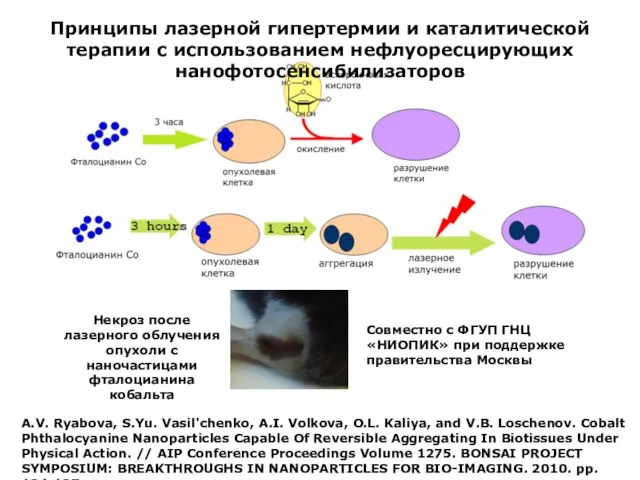
- 12. A.V. Ryabova, S.Yu. Vasil'chenko, A.I. Volkova, O.L. Kaliya, and V.B. Loschenov. Cobalt Phthalocyanine Nanoparticles Capable Of
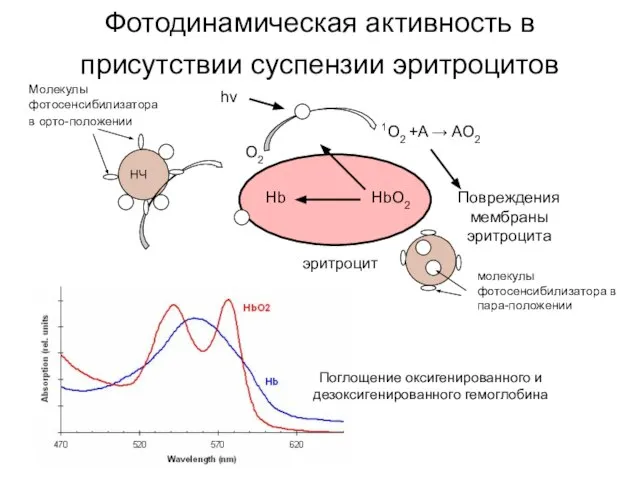
- 13. Фотодинамическая активность в присутствии суспензии эритроцитов НЧ hν 1O2 +A → AO2 HbO2 Hb Повреждения мембраны
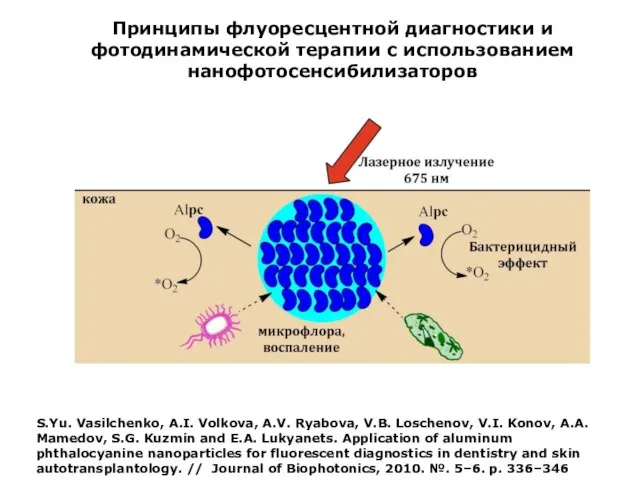
- 14. S.Yu. Vasilchenko, A.I. Volkova, A.V. Ryabova, V.B. Loschenov, V.I. Konov, A.A. Mamedov, S.G. Kuzmin and E.A.
- 15. Использование НЧ фталоцианина алюминия для контроля за динамикой приживления Флуоресцения фталоцианина алюминия после аппликационного применения НЧ
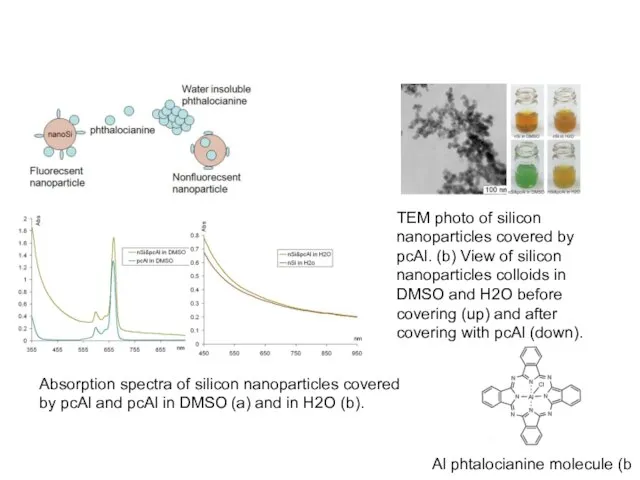
- 16. TEM photo of silicon nanoparticles covered by pcAl. (b) View of silicon nanoparticles colloids in DMSO
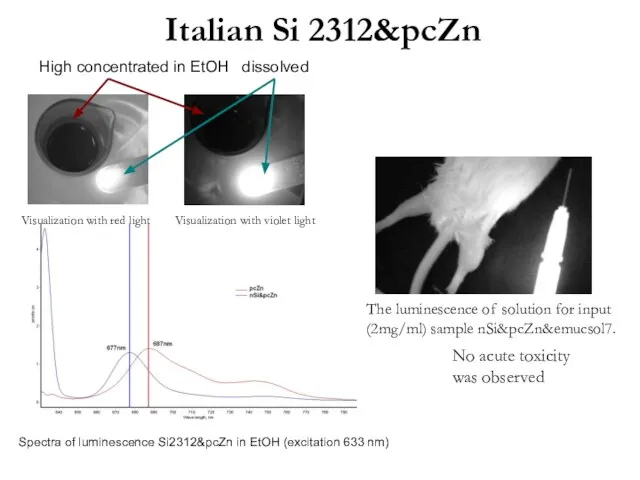
- 17. Italian Si 2312&pcZn No acute toxicity was observed The luminescence of solution for input (2mg/ml) sample
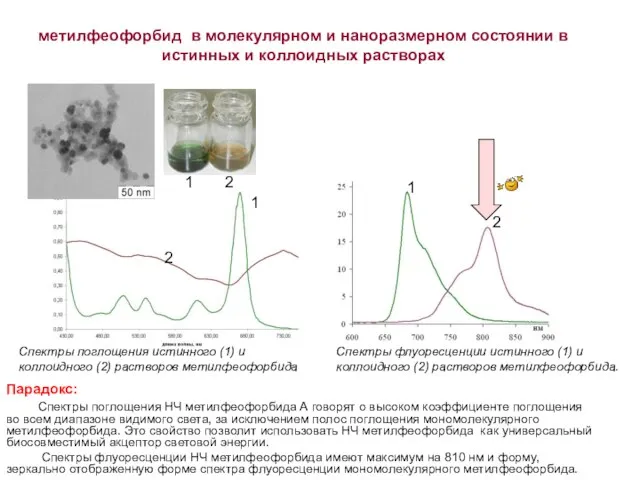
- 18. метилфеофорбид в молекулярном и наноразмерном состоянии в истинных и коллоидных растворах 2 Спектры поглощения истинного (1)
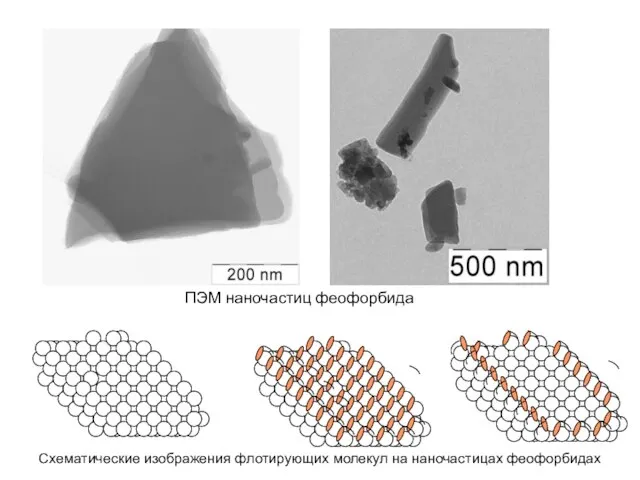
- 19. Схематические изображения флотирующих молекул на наночастицах феофорбидах ПЭМ наночастиц феофорбида
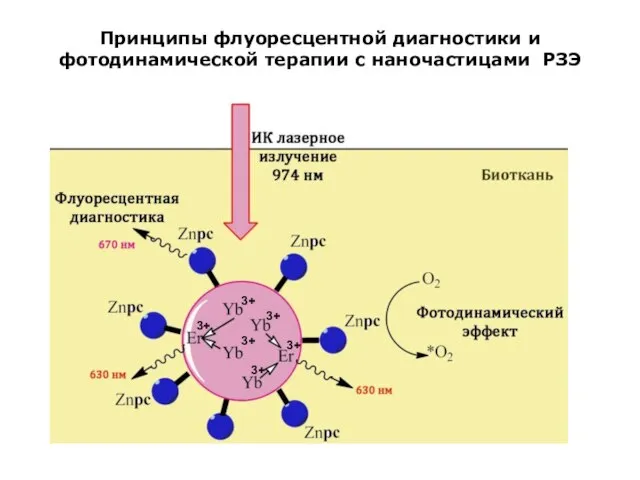
- 20. Принципы флуоресцентной диагностики и фотодинамической терапии с наночастицами РЗЭ 3+ 3+ 3+ 3+ 3+ 3+
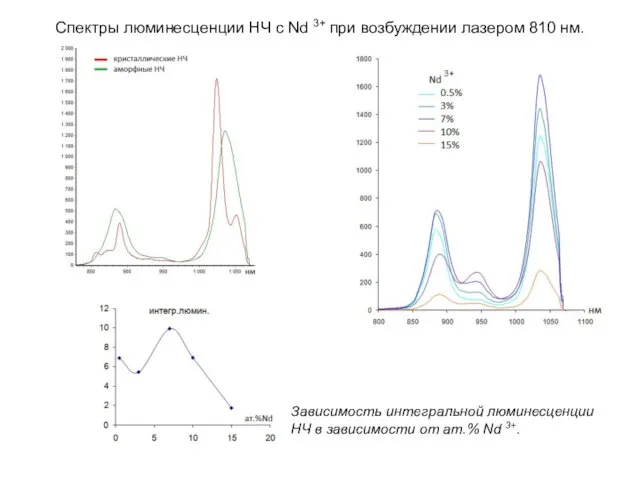
- 21. Поликристаллические боратогерманаты Gd14(BO3)6(GeO4)2O8:Nd3+ (Nd3+: 0.5, 3.0, 7.0, 10, 15 ат.%) получали при 1520K методом твердофазного синтеза
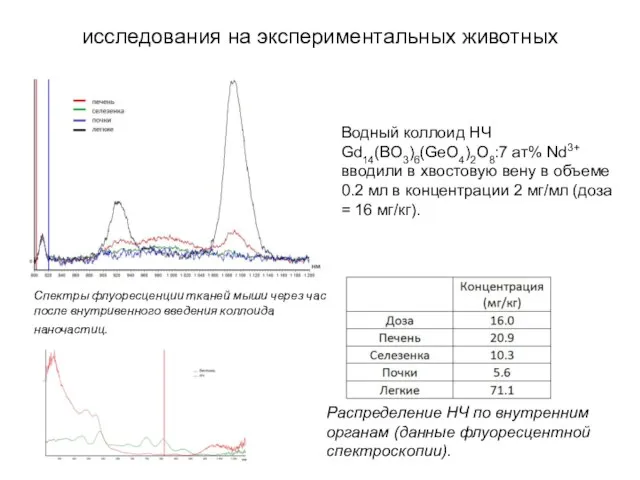
- 22. Спектры люминесценции НЧ с Nd 3+ при возбуждении лазером 810 нм. Зависимость интегральной люминесценции НЧ в
- 23. Водный коллоид НЧ Gd14(BO3)6(GeO4)2O8:7 ат% Nd3+ вводили в хвостовую вену в объеме 0.2 мл в концентрации
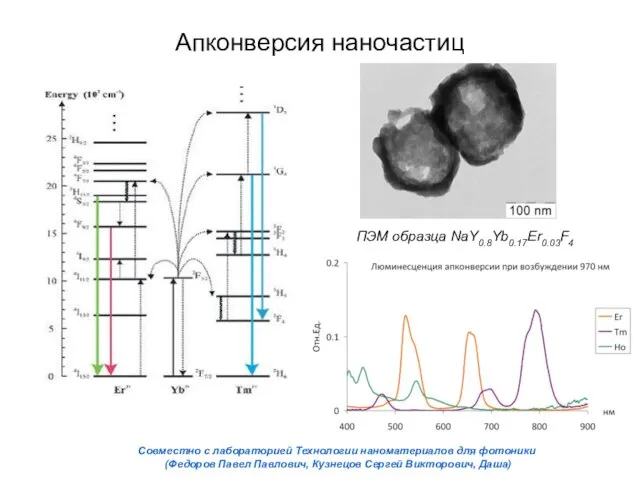
- 24. Апконверсия наночастиц ПЭМ образца NaY0.8Yb0.17Er0.03F4 Совместно с лабораторией Технологии наноматериалов для фотоники (Федоров Павел Павлович, Кузнецов
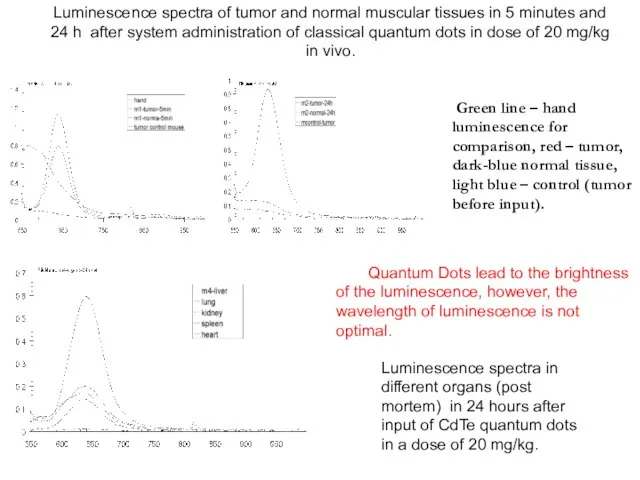
- 25. Green line – hand luminescence for comparison, red – tumor, dark-blue normal tissue, light blue –
- 27. Скачать презентацию









 Презентация на тему 2 класс Математический диктант № 1
Презентация на тему 2 класс Математический диктант № 1  Процедуры и инструкции по автомобилям. Шаблоны папок
Процедуры и инструкции по автомобилям. Шаблоны папок Почвы
Почвы Решение задач на нахождение площади фигур
Решение задач на нахождение площади фигур «Кенгуру» – это массовый международный математический конкурс- игра под девизом «Математика для всех». Главная цель конкурса – п
«Кенгуру» – это массовый международный математический конкурс- игра под девизом «Математика для всех». Главная цель конкурса – п Павильон на Стрелке
Павильон на Стрелке 8 февраляДЕНЬ ЮНОГО ГЕРОЯ-АНТИФАШИСТА
8 февраляДЕНЬ ЮНОГО ГЕРОЯ-АНТИФАШИСТА Основные понятия и классификация строительных материалов
Основные понятия и классификация строительных материалов The Speech Mechanism
The Speech Mechanism  Электрические явления
Электрические явления Мордовские народные загадки
Мордовские народные загадки Очевидное – невероятное(Sphinx tips-n-tricks)
Очевидное – невероятное(Sphinx tips-n-tricks) Экономический анализ права как способ выявления проблем на муниципальных отраслевых рынках Н. Поличка 25-27 июня 2008 г. Камчатский кр
Экономический анализ права как способ выявления проблем на муниципальных отраслевых рынках Н. Поличка 25-27 июня 2008 г. Камчатский кр organizatsionaya_struktura1 (70
organizatsionaya_struktura1 (70 Звездный час (9 класс)
Звездный час (9 класс) Компетентнісна задача №2. Завдання і зразок
Компетентнісна задача №2. Завдання і зразок Презентация к лекции_3.1_10.05.05
Презентация к лекции_3.1_10.05.05 П. А. Столыпин – палач или великий реформатор ?
П. А. Столыпин – палач или великий реформатор ? Обучение грамоте (вводный урок). 1 класс
Обучение грамоте (вводный урок). 1 класс Prezentatsia_po_FB
Prezentatsia_po_FB Изменение в природе зимой
Изменение в природе зимой З-й день марафона
З-й день марафона Экономические циклы
Экономические циклы Формирование гендерной принадлежности детей дошкольного возраста
Формирование гендерной принадлежности детей дошкольного возраста Топ стратегий ретаргетинга
Топ стратегий ретаргетинга Сила достижения
Сила достижения Звук.Отражение звука
Звук.Отражение звука Основы медицинских знаний
Основы медицинских знаний