Слайд 2водород
ВОДОРОД (лат. Hydrogenium, от греч. hydor - вода и gennao - рождаю)

находится в 1 периоде 1-й группе главной подгруппе и в 1 периоде 6 гр. главной подгруппе т.к. может проявить окислительные или восстановительные свойства, легкий хим. элемент ПСХЭ Менделеева, атомная масса 1,0794 . Водород состоит из двух стабильных изотопов: протия 1Н и дейтерия 2Н, или D; известен также радиоактивный изотоп -тритий 3Н, или Т. Ядро атома протия - протон. Атом водорода имеет один электрон, занимающий 1s1-орбиталь; степень окисления + 1 (наиб. распространена), — 1 (в гидридах щелочных металлов).
Слайд 3Открытие водорода
Водород был открыт в 1-й пол. 16 в. Парацельсом. В 1776

Г. Кавендиш впервые исследовал его свойства, в 1783-1787 А. Лавуазье показал, что водород входит в состав воды, включил его в список хим. элементов и предложил название "гидроген".
Слайд 4Водород в природе
Также водород является самым распространенным элементом не только на

Земле, но и во всей Вселенной. Он является основной составляющей звезд. Например, Солнце, как выяснили ученые, наполовину состоит из водорода, который в основном расходуется на производство энергии.
Слайд 5Водород в природе
На Земле водород тоже играет очень большую роль. Массовая доля
составляет

1 % — это девятый по распространенности элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 %.
Слайд 6Водород в природе
При взаимодействии водорода с кислородом происходит горение и образуется пар

который конденсирует в воду.
Слайд 7Применение водорода вместо бензина
Огромное количество тепловой энергии его можно использовать в

промышленности, быту, как топливо для транспорта.
Слайд 8Водород как оружие
Помимо полезных свойств водорода существует и еще одно: из водорода

можно сделать оружие разрушительной силы. Это оружие называется водородная бомба.
Взрыв водородной бомбы сопровождается выбросом большого количества радиоактивных веществ. Благодаря своей уникальной конструкции и механизму действия водородная бомба может быть сделана сколь угодно мощной. При этом она намного дешевле атомных бомб той же мощности.








 Презентация на тему Презентация Венгрия
Презентация на тему Презентация Венгрия Материалы к круглому столу на тему:«О возможных схемах и механизмах финансирования управляющих компаний (организаций), профессио
Материалы к круглому столу на тему:«О возможных схемах и механизмах финансирования управляющих компаний (организаций), профессио Описание пищевой (легкой) промышленности России
Описание пищевой (легкой) промышленности России Законы арифметических действий
Законы арифметических действий Анализ особенностей трансляционных рисков в промышленности
Анализ особенностей трансляционных рисков в промышленности Проблема бытия в философии Нового времени
Проблема бытия в философии Нового времени Презентация Нутрициология
Презентация Нутрициология Барокко как стиль в искусстве
Барокко как стиль в искусстве Приемы видеомонтажа. Восьмерка
Приемы видеомонтажа. Восьмерка Водоросли
Водоросли Сталинград перед войной Сталинградская битва 23 августа 1942 года – 2 февраля 1943 года.
Сталинград перед войной Сталинградская битва 23 августа 1942 года – 2 февраля 1943 года. Обзор продукции Valtec
Обзор продукции Valtec Презентация по географии на тему:«Санкт-Петербург»
Презентация по географии на тему:«Санкт-Петербург»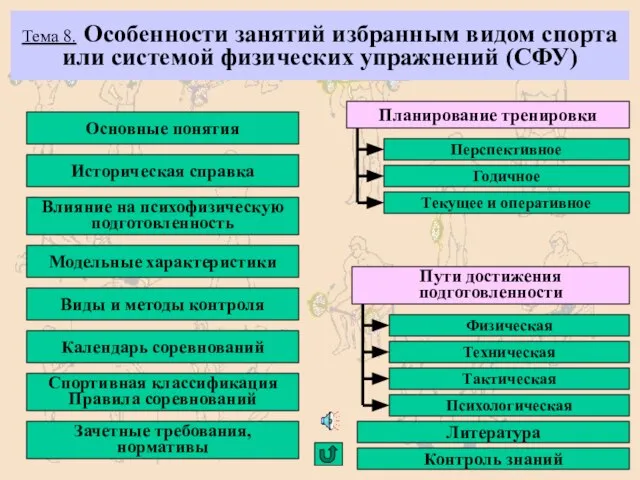 Особенности занятий избранным видом спорта
Особенности занятий избранным видом спорта «Основам информационных технологий»
«Основам информационных технологий» икона Николая Чудотворца
икона Николая Чудотворца История о том как Землю изгнали из центра Вселенной
История о том как Землю изгнали из центра Вселенной Old PostcardsСтарые почтовые открытки Музыка
Old PostcardsСтарые почтовые открытки Музыка Жужжалочка. Дидактическая игра для автоматизации звука Ж в словах
Жужжалочка. Дидактическая игра для автоматизации звука Ж в словах Дипломная работа. Виды диспетчерской документации, этапы обработки, документооборот диспетчера на автотранспортного предприятия
Дипломная работа. Виды диспетчерской документации, этапы обработки, документооборот диспетчера на автотранспортного предприятия «Система мониторинга освоения детьми планируемых результатов освоения Программы».
«Система мониторинга освоения детьми планируемых результатов освоения Программы». Об итогах социально – экономического развития Никифоровского сельского поселения Чусовского муниципального района Пермского кр
Об итогах социально – экономического развития Никифоровского сельского поселения Чусовского муниципального района Пермского кр Презентация на тему Паразиты человека
Презентация на тему Паразиты человека  Маска для искусственного сна
Маска для искусственного сна Работа с концептами как одна из форм реализации лингвокультурологического подхода
Работа с концептами как одна из форм реализации лингвокультурологического подхода Инкотермс 2010 Подготовили Столбова А.А.Т-086 Тихомирова Л.В.Т-083
Инкотермс 2010 Подготовили Столбова А.А.Т-086 Тихомирова Л.В.Т-083 Презентация на тему Динамика Масса и импульс тела Силы
Презентация на тему Динамика Масса и импульс тела Силы
 Урок по повести Н. В. Гоголя «Портрет»
Урок по повести Н. В. Гоголя «Портрет»