Содержание
- 2. Открытие фосфора Гамбургский алхимик Хеннинг Бранд 1669 год «Фосфор» - от греческого «светоносный»
- 3. Фосфор – простое вещество. 1.Химическая формула – Р. 2.Mr(Р) =31 3. М (Р) = 31г/моль 4.
- 4. Фосфин – фосфористый водород, ядовитый газ с чесночным запахом, легко воспламеняется на воздухе. Поэтому огни на
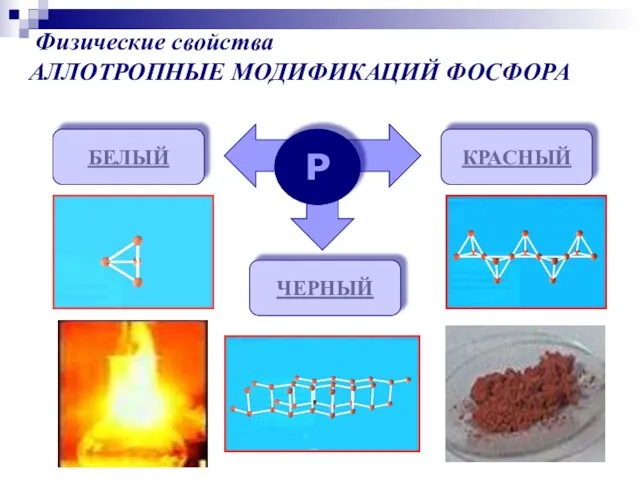
- 5. Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ Физические свойства АЛЛОТРОПНЫЕ МОДИФИКАЦИЙ ФОСФОРА
- 6. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
- 7. Продукты, содержащие фосфор Бобовые (горох, фасоль) Кукуруза; Дрожжи; Сыр; Отруби; Молоко (цельное и сгущенное) Молочные продукты;
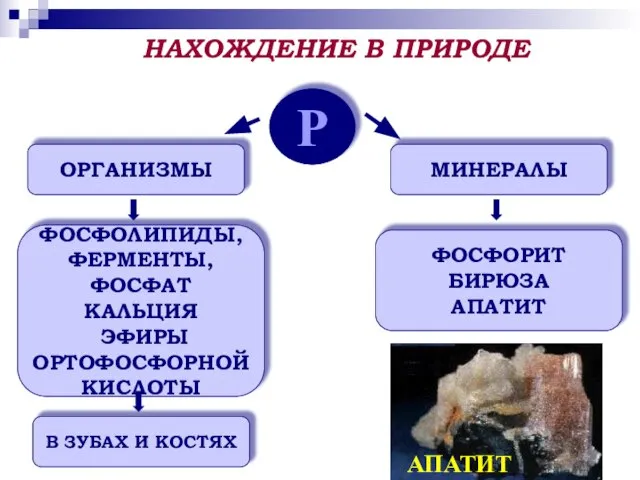
- 8. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 9. Физиологическое действие белого фосфора Результат применения чрезмерного количества фосфора Появление лягушек с уродствами -результат применения фосфорных
- 10. Суточная потребность в фосфоре Суточной нормой фосфора для взрослого человека считают 1600 мг, потребность у беременных
- 11. Соединения фосфора. Оксид фосфора (V) 1.Р2О5 2. Mr(P2O5) = 142 3. M (P2O5) = 142г/моль 4.
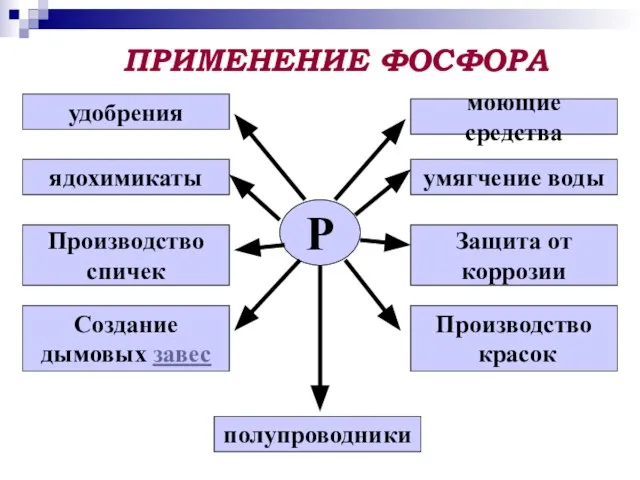
- 12. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 13. Войска США использовали фосфорные Бомбы в Ираке, 2004 г.
- 14. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
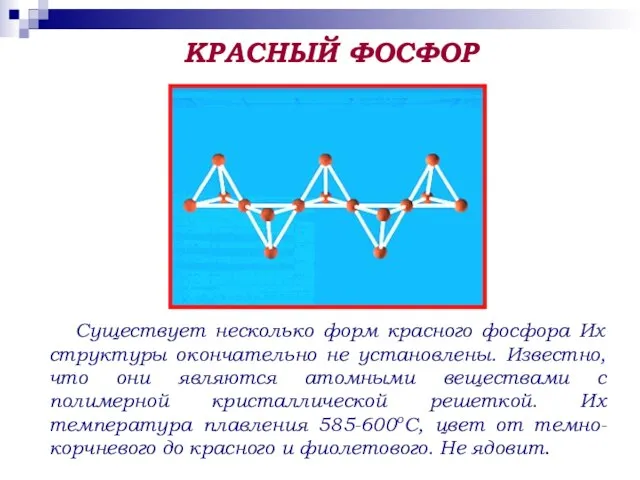
- 15. Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами
- 17. Скачать презентацию










 Роль физической культуры и спорта в нашей жизни
Роль физической культуры и спорта в нашей жизни Джеймс Олдридж
Джеймс Олдридж Соли аммония
Соли аммония Романовская игрушка
Романовская игрушка Построение автоматов
Построение автоматов Перевозка детей на воздушном транспорте
Перевозка детей на воздушном транспорте 1 Художній твір як явище мистецтва, новий ірреальний
1 Художній твір як явище мистецтва, новий ірреальний Сопровождение региональных инновационных площадок в 2022 году
Сопровождение региональных инновационных площадок в 2022 году Структура книги
Структура книги Котёл низкого давления
Котёл низкого давления Оставьте цветы весне
Оставьте цветы весне Презентация на тему Стресс, стрессовое состояние
Презентация на тему Стресс, стрессовое состояние  Актуальность, проблемы и перспективы развития профессионального признания в России Владивосток 2011
Актуальность, проблемы и перспективы развития профессионального признания в России Владивосток 2011 СИЛА ТОКА Кл t А q ЗАРЯД Дж U U q НАПРЯЖЕНИЕ А I I t РАБОТА с А q t ВРЕМЯ В q.
СИЛА ТОКА Кл t А q ЗАРЯД Дж U U q НАПРЯЖЕНИЕ А I I t РАБОТА с А q t ВРЕМЯ В q. Обязательства и ответственность по правам человека
Обязательства и ответственность по правам человека Учебные вопросы: Техника скоростной записи слов и предложений. Применение цветных ручек и карандашей при конспектировании
Учебные вопросы: Техника скоростной записи слов и предложений. Применение цветных ручек и карандашей при конспектировании Упражнения для мышц брюшного пресса (юноши)
Упражнения для мышц брюшного пресса (юноши) Вычисление площади криволинейной трапеции
Вычисление площади криволинейной трапеции Машиностроительное черчение
Машиностроительное черчение Хакасия – моя Родина!
Хакасия – моя Родина! Презентация на тему Как вести себя во время теракта
Презентация на тему Как вести себя во время теракта Мониторинг Active Session History c использованием ASH Viewer
Мониторинг Active Session History c использованием ASH Viewer История моды 20 века
История моды 20 века Союз поисковых отрядов
Союз поисковых отрядов Промоакции и их роль в продвижении товаров
Промоакции и их роль в продвижении товаров Christmas what are they doing fun
Christmas what are they doing fun Олимпийские игры
Олимпийские игры Как правильно передвигаться по загородной дороге?
Как правильно передвигаться по загородной дороге?