Слайд 2Кто хочет съесть ядро ореха, должен расколоть его скорлупу
плавт

Слайд 4
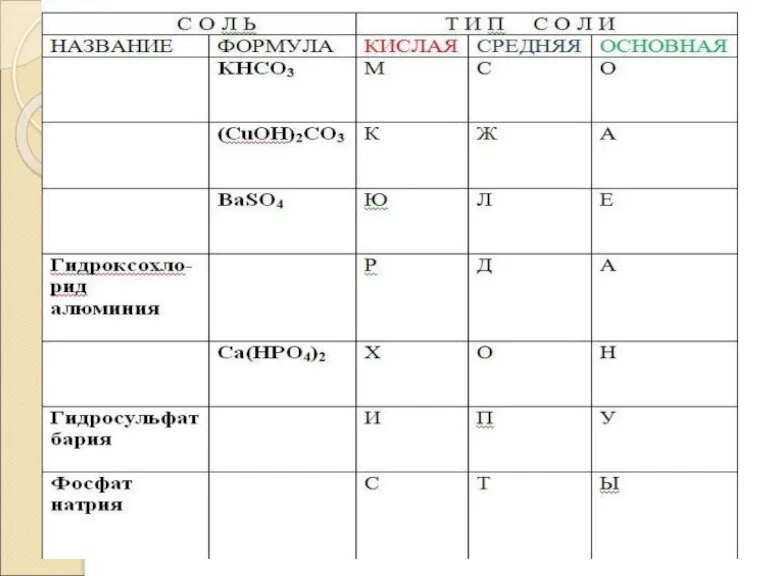
Вычеркните «лишние» формулы и допишите предложения.
А) H2SO4 , HNO3, H3PO4, HCl, H2

S – это кислоты, которые не образуют кислых солей, так как ………………………………………………………………………………................
Слайд 5Б) Ca(OH)2, NaOH, Cu(OH)2 , KOH, Fe(OH)2 – это основания, которые не
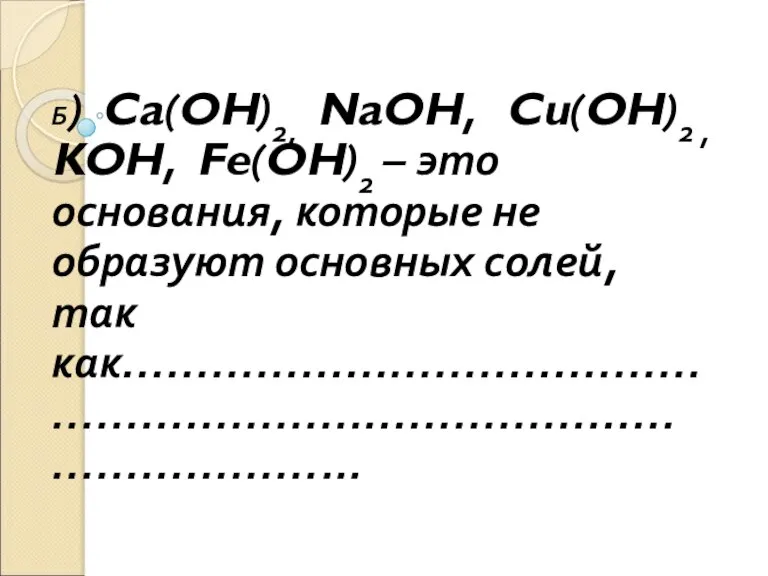
образуют основных солей, так как………………………………………………………………………………………...
Слайд 8ТИПИЧНЫЕ РЕАКЦИИ СОЛЕЙ
СОЛЬ+ КИСЛОТА= ДРУГАЯ СОЛЬ+ ДРУГАЯ КИСЛОТА

Слайд 92.СОЛЬ+ ЩЕЛОЧЬ= ДРУГАЯ СОЛЬ+ДРУГОЕ ОСНОВАНИЕ

Слайд 12 4.СОЛЬ+ МЕТАЛЛ= ДРУГАЯ СОЛЬ+ ДРУГОЙ МЕТАЛЛ

Слайд 13эксперимент
Железо + сульфат меди(II)=
Железо + хлорид бария =

Слайд 14 Н.Н БЕКЕТОВ В 1865г ИЗУЧИЛ СПОСОБНОСТЬ МЕТАЛЛОВ ВЫТЕСНЯТЬ ИЗ РАСТВОРОВ СОЛЕЙ

ДРУГИЕ МЕТАЛЛЫ.
НА ОСНОВЕ ЭТИХ ИССЛЕДОВАНИЙ СОСТАВИЛ ВЫТЕСНИТЕЛЬНЫЙ РЯД МЕТАЛЛОВ
Слайд 15 В 1892 Г В. НЕРНСТ ДОКАЗАЛ, ЧТО ВЫТЕСНИТЕЛЬНЫЙ РЯД ПРАКТИЧЕСКИ СОВПАДАЕТ

С РЯДОМ В КОТОРОМ МЕТАЛЛЫ И ВОДОРОД РАСПОЛОЖЕНЫ В ПОРЯДКЕ УМЕНЬШЕНИЯ ИХ ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ. ЭТОТ РЯД НАЗЫВАЮТ ЭЛЕКТРОХИМИЧЕСКИМ РЯДОМ НАПРЯЖЕНИЯ МЕТАЛЛОВ
Слайд 16ПРАВИЛА РЯДА НАПРЯЖЕНИЙ:
МЕТАЛЛ ДОЛЖЕН НАХОДИТЬСЯВ РЯДУ НАПРЯЖЕНИЙ ДО МЕТАЛЛА СОЛИ;
ОБЕ СОЛИ ДОЛЖНЫ

БЫТЬ РАСТВОРИМЫМИ;
НЕ РЕКОМЕНДУЕТСЯ ИСПОЛЬЗОВАТЬ АКТИВНЫЕ(ЩЕЛОЧНЫЕ) МЕТАЛЛЫ т.к ОНИ ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ.
Слайд 17НАПИШИТЕ УРАВНЕНИЯ ВОЗМОЖНЫХ РЕАКЦИЙ
K+ CuSO4
Cu + Hg(NO3)2
Fe + CuCl2
Al + ZnSO4
Zn +

Al(NO3)3
Слайд 18 ХЛОРИД ЖЕЛЕЗА(III) + НИТРАТ СЕРЕБРА=
НИТРАТ КАЛИЯ+ ХЛОРИД НАТРИЯ=

Слайд 19 ГИДРОКСИД НАТРИЯ+ СУЛЬФИД ЖЕЛЕЗА(II)=
ГИДРОКСИД КАЛИЯ + СУЛЬФАТ ЖЕЛЕЗА(III) =

Слайд 20Химические свойства солей
с + кислоты =
о + щелочи =
л

+ соли =
и + М =







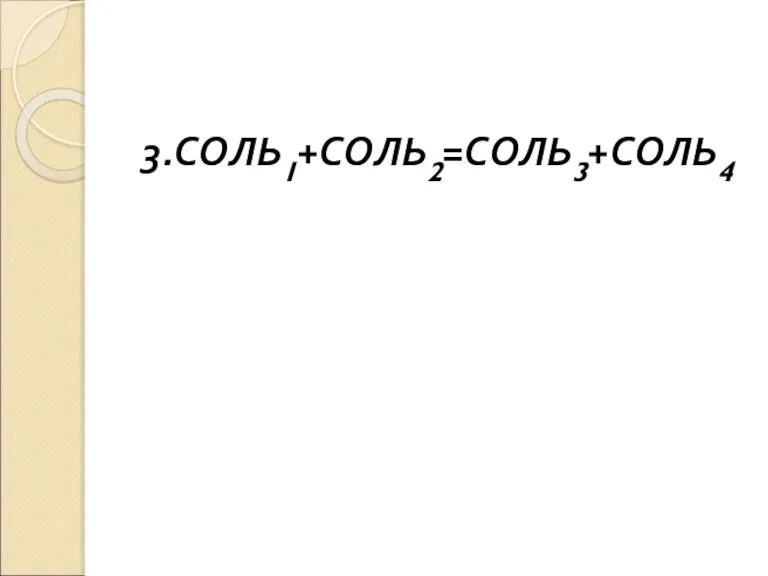










 Неметаллы
Неметаллы Конструирование шкатулки из бросового материала
Конструирование шкатулки из бросового материала Кафедра ТИССУ
Кафедра ТИССУ Проект Зелёное кольцо
Проект Зелёное кольцо Урок литературного чтения в 1 классе
Урок литературного чтения в 1 классе Горные и маркшейдерские работы применительно к условиям разработки Лебединского месторождения
Горные и маркшейдерские работы применительно к условиям разработки Лебединского месторождения Химическая и нефтехимическая промышленность в России: роль государства в преодолении кризиса и дальнейшем развитии отрасли
Химическая и нефтехимическая промышленность в России: роль государства в преодолении кризиса и дальнейшем развитии отрасли Оптимизация процесса настройки рабочего места для работы в Единой информационной системе в сфере закупок
Оптимизация процесса настройки рабочего места для работы в Единой информационной системе в сфере закупок Презентация на тему Применение фотоэффекта
Презентация на тему Применение фотоэффекта ПРОГРАММЫ ПОДГОТОВКИ ЛЮБИТЕЛЬСКИХ КОМАНД
ПРОГРАММЫ ПОДГОТОВКИ ЛЮБИТЕЛЬСКИХ КОМАНД Роль отца в воспитании ребенка
Роль отца в воспитании ребенка Волевые качества
Волевые качества Урок-открытие
Урок-открытие Институциональные репозитории: создание и управление
Институциональные репозитории: создание и управление Паровые машины
Паровые машины Уимблдон
Уимблдон Современные модели образовательного процесса соответствии с ФГТ
Современные модели образовательного процесса соответствии с ФГТ Реклама в торговом комплексе «Фиолент»
Реклама в торговом комплексе «Фиолент» VXlkbvvDUSz19pGVCwhRfQ
VXlkbvvDUSz19pGVCwhRfQ Сайт для студии-ателье IRINA LAVINOVA
Сайт для студии-ателье IRINA LAVINOVA Kuv_2022_MS_13_Recons_авг (1)
Kuv_2022_MS_13_Recons_авг (1) Презентацию составила учитель математики БОУ СОШ26 п.Украинский Динского района Краснодарского края Краснощекова Л.Г.
Презентацию составила учитель математики БОУ СОШ26 п.Украинский Динского района Краснодарского края Краснощекова Л.Г. Живопись. Гармония по общему цветовому тону (тема 18)
Живопись. Гармония по общему цветовому тону (тема 18) www.ratsp.ru
www.ratsp.ru Последовательное соединение проводников
Последовательное соединение проводников Равнины и горы России
Равнины и горы России Фестиваль Бархатный сезон. Ялта
Фестиваль Бархатный сезон. Ялта Курс лекций по дисциплине Экология
Курс лекций по дисциплине Экология