Содержание
- 2. НПЗ вырабатывают: горючие и смазочные материалы, твердые и полужидкие смеси парафинов (парафин, церезин, вазелин), битумы, электродный
- 3. 1. Предварительная стадия обезвоживают, обессоливают, очищают от кокса путем продолжительного отстаивания в подогретом состоянии 180 гр.С
- 4. 2. перегонка Насос Трубчатая печь 320 гр.С Ректификационная колонна Пары охлаждаются (флегмой) сгущение в конденсаторе Бензин
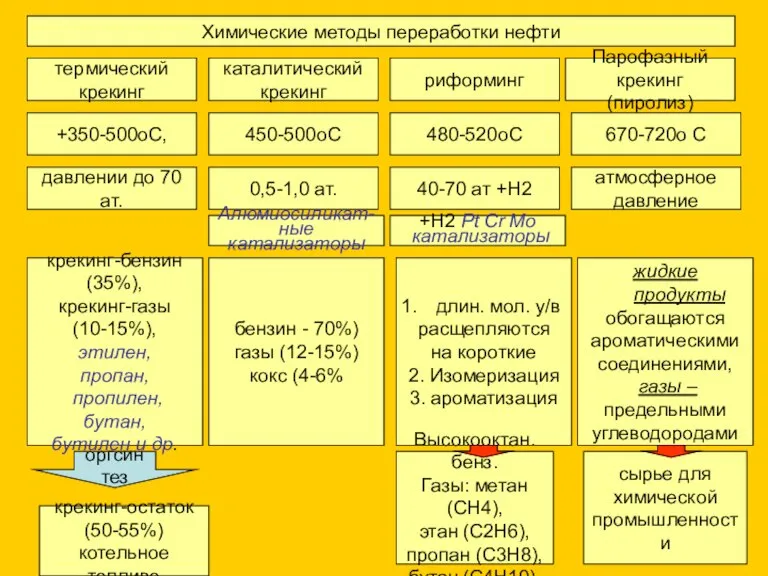
- 5. Химические методы переработки нефти термический крекинг каталитический крекинг риформинг Парофазный крекинг (пиролиз) +350-500оС, 450-500оС 480-520оС 670-720о
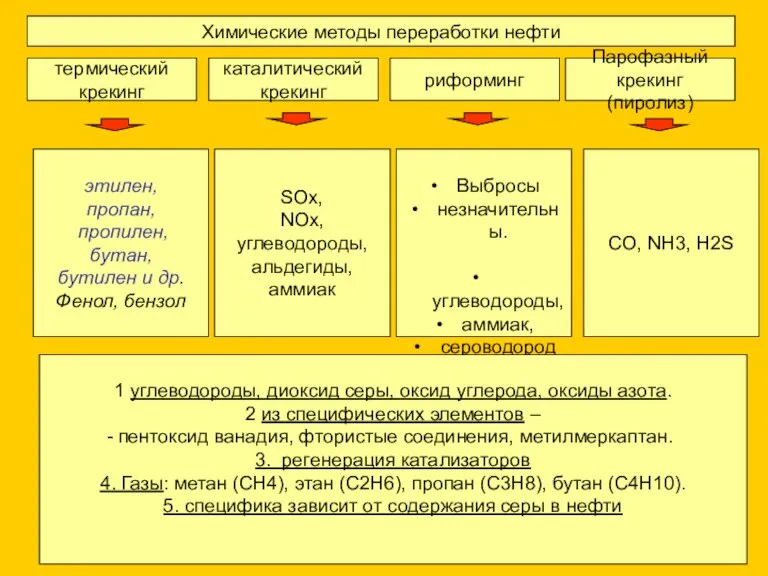
- 6. Химические методы переработки нефти термический крекинг каталитический крекинг риформинг Парофазный крекинг (пиролиз) этилен, пропан, пропилен, бутан,
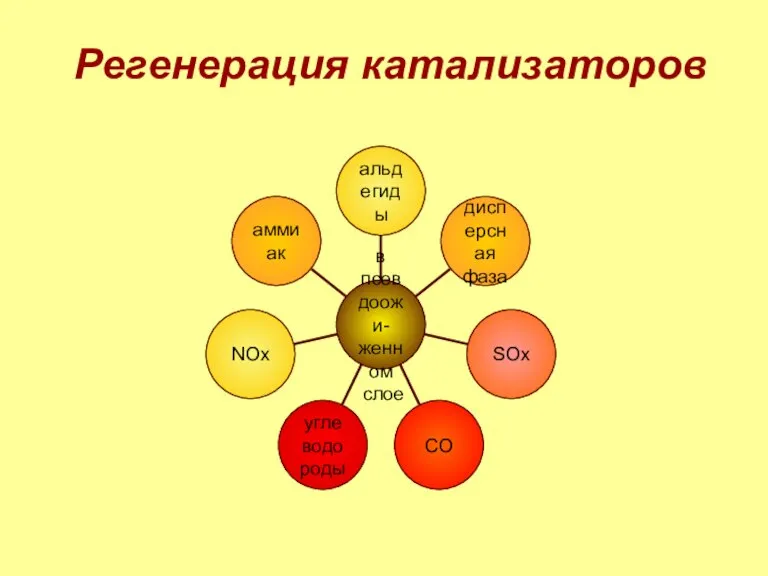
- 7. Регенерация катализаторов
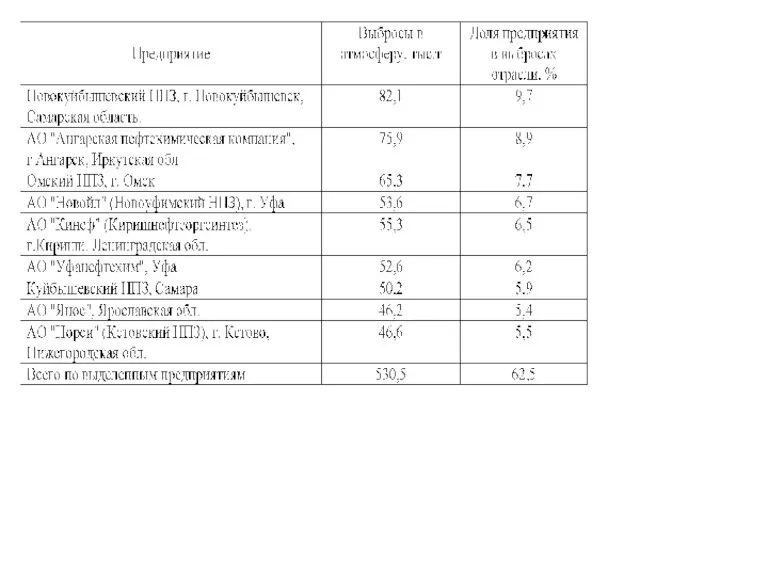
- 8. Со сточными водами НПЗ в поверхностные воды поступает нефтепродукты, сульфаты, хлориды, соединения азота, фенолы, соли тяжелых
- 9. токсичные отходы состоят из: биологически активного газа, который остается после эксплуатации очистных сооружений, осадков из резервуаров,
- 11. Производство серной кислоты Серная кислота – H2SO4 бесцветная тяжелая маслянистая жидкость, кипящая при 304оС и кристаллизующаяся
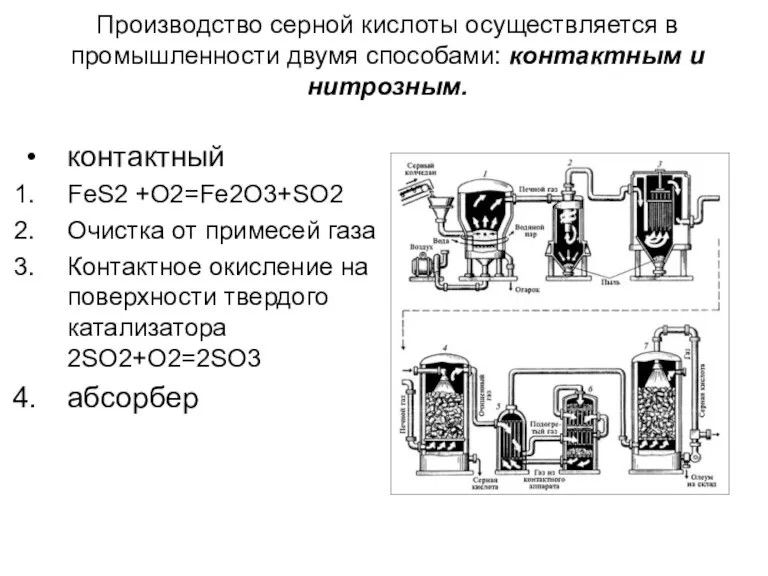
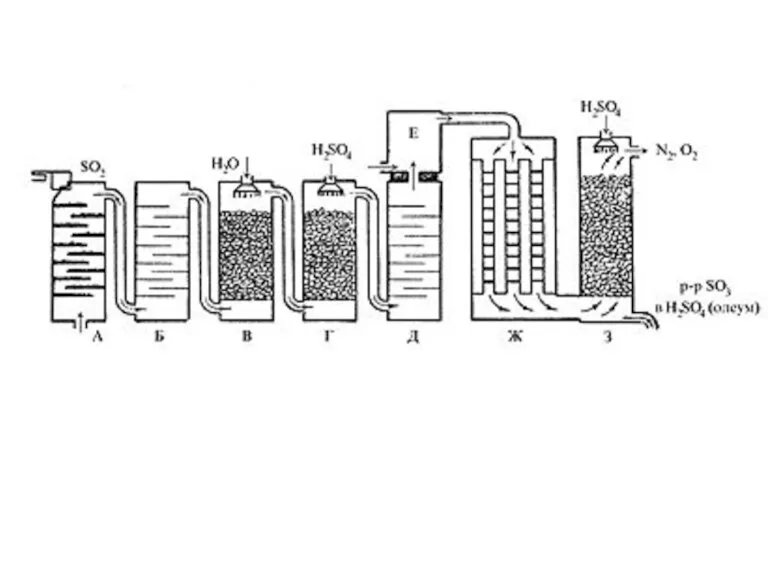
- 12. Производство серной кислоты осуществляется в промышленности двумя способами: контактным и нитрозным. контактный FeS2 +O2=Fe2O3+SO2 Очистка от
- 14. Нитрозный способ – известен с середины 18 в. 1. 2SO2+H2O+NO2=H2SO4+NO ОКИСЛИТЕЛЕМ ЯВЛЯЕТСЯ NO2, ОН ВОССТАНАВЛИВАЕТСЯ 2.
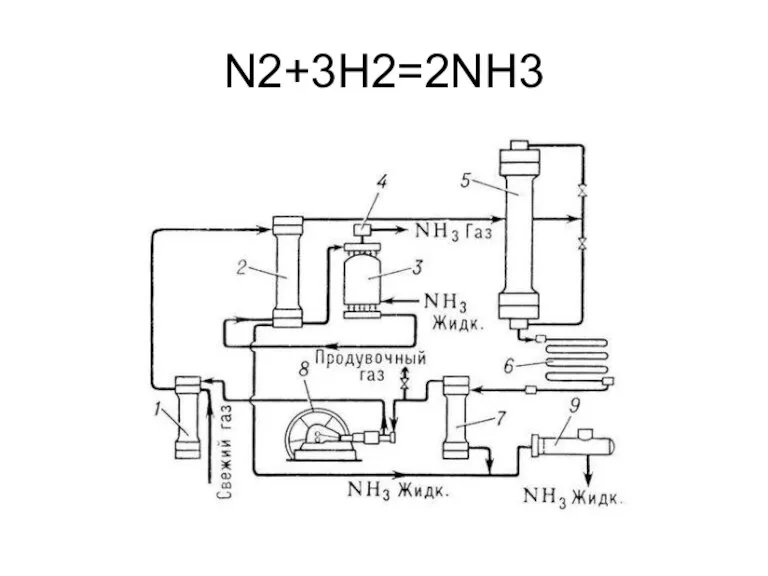
- 15. Производство аммиака
- 16. N2+3H2=2NH3
- 17. Для получения 1 т NH3 – 3000 куб.м азото-водородной смеси, 90 куб. м воды, 1750 кВт*ч
- 18. Производство азотной кислоты
- 19. Азотная кислота занимает второе место по объему в производстве кислот после серной.
- 20. Исходным веществом для получения азотной кислоты является аммиак – NH3.
- 21. Получение слабой азотной кислоты имеет три стадии: 1. окисление аммиака до окиси азота NO; (аммиак и
- 22. Окисление аммиака проводится при температуре 800-900оС в присутствии катализатора, изготовленного из сплава платины и родия.
- 23. Кроме платины, могут применяться менее активные катализаторы на основе окиси кобальта или железа с активирующими добавками.
- 24. Для получения 1 т разбавленной азотной кислоты в установках с нормальным атмосферным давлением расходуется 300 кг
- 25. Выброс HNO3 может составлять до 3 кг на 1 т. в пересчете на 100%-ную кислоту.
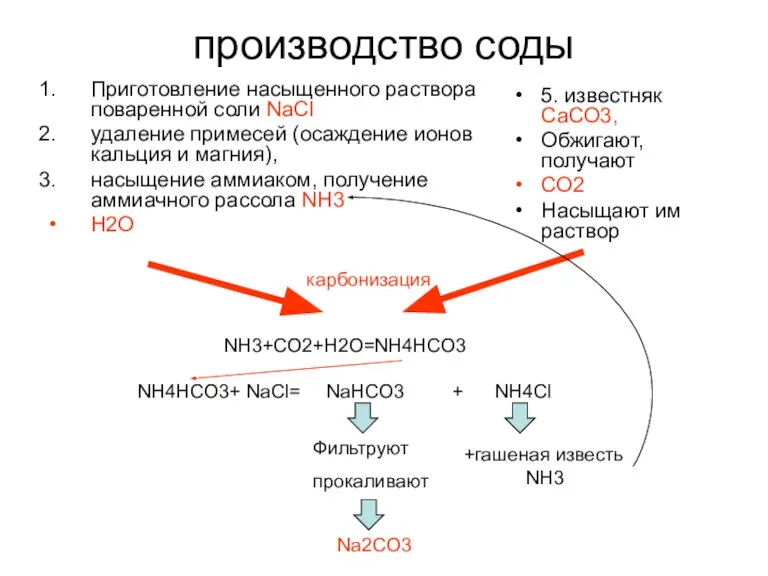
- 26. производство соды Приготовление насыщенного раствора поваренной соли NaCl удаление примесей (oсаждение ионов кальция и магния), насыщение
- 27. При получении 1 т соды - образуется около 1 т NH4Cl, раствор которого обрабатывают известковым молоком
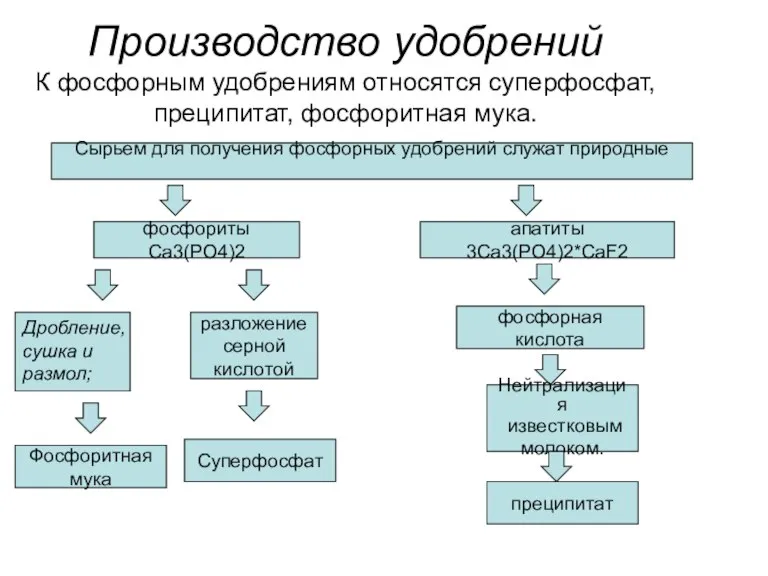
- 28. Производство удобрений К фосфорным удобрениям относятся суперфосфат, преципитат, фосфоритная мука. Сырьем для получения фосфорных удобрений служат
- 29. Главный загрязнитель при производстве фосфорных удобрений – фтористые соединения. Фториды присутствуют как в газообразном состоянии, так
- 30. Калийные удобрения это хлорид калия (KCl), сульфат калия (K2SO4) сульфат калия-магния (K2SO4*2MgSO4). Сырьем для получения хлористого
- 31. Производство калийных удобрений включает: 1 отделение хлористого калия от хлорида натрия и глины. 2. Сильвинит размалывают,
- 32. В технологии изготовления хлорида калия можно выделить 4 этапа, при которых происходят наиболее существенные выбросы в
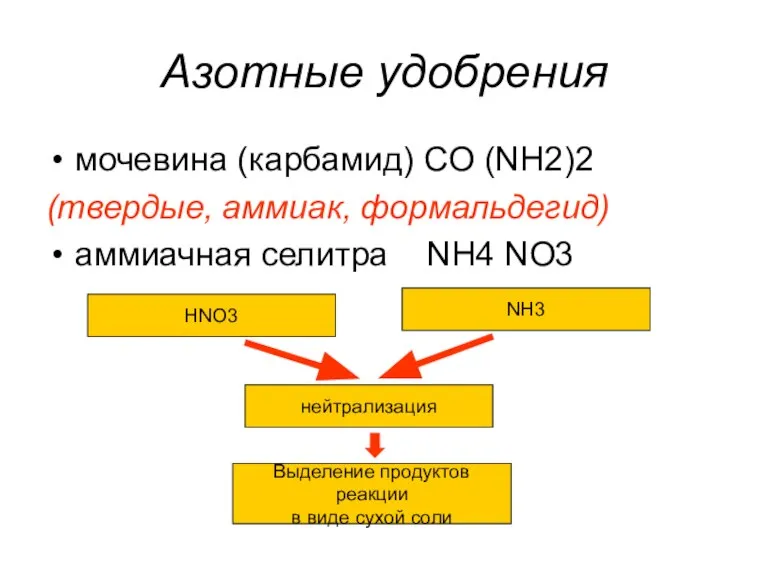
- 33. Азотные удобрения мочевина (карбамид) CO (NH2)2 (твердые, аммиак, формальдегид) аммиачная селитра NH4 NO3 HNO3 NH3 нейтрализация
- 34. ядохимикаты Инсектициды: 1. парижская зелень 3 Сu(AsO2)2*Cu(CH3COO)2 Cырье - As2O3 руды обжигают соли 2. Фтористый и
- 35. II. Фунгициды (грибковые заболевания) Бордосская жидкость (медь содерж.) Получается смешиванием медного купороса с известковым молоком 2.
- 37. Скачать презентацию
























 Дидактическое электронное пособие Получи цветочек от Зайца Цель: обучающиеся должны знать названия и обозначения действий сло
Дидактическое электронное пособие Получи цветочек от Зайца Цель: обучающиеся должны знать названия и обозначения действий сло Права нужны, а обязанности важны
Права нужны, а обязанности важны Подготовила учитель начальных классов МОУ СОШ № 9 Романова Ирина Анатольевна
Подготовила учитель начальных классов МОУ СОШ № 9 Романова Ирина Анатольевна Город сегодня и завтра. Тенденции и перспективы развития современной архитектуры
Город сегодня и завтра. Тенденции и перспективы развития современной архитектуры Телескопы
Телескопы Etude pratique et surprenante de l'Institut Pasteur
Etude pratique et surprenante de l'Institut Pasteur Контроль за продольным перемещением плетей. Особенности содержания бесстыкового железнодорожного пути
Контроль за продольным перемещением плетей. Особенности содержания бесстыкового железнодорожного пути Правовое обеспечение контроля и надзора за деятельностью ОВД. Тема 2
Правовое обеспечение контроля и надзора за деятельностью ОВД. Тема 2 Нарушение международного гуманитарного права во время Первой мировой войны
Нарушение международного гуманитарного права во время Первой мировой войны Психика человека: сущность, структура, функции в жизнедеятельности человека
Психика человека: сущность, структура, функции в жизнедеятельности человека Healthy paradise - Здоровый рай
Healthy paradise - Здоровый рай Административное правотношение, 9 класс
Административное правотношение, 9 класс Основы инженерной графики
Основы инженерной графики Введение в историю
Введение в историю Законнар кайда туа
Законнар кайда туа Презентация на тему Антигитлеровская коалиция 1942-1945
Презентация на тему Антигитлеровская коалиция 1942-1945 Крестьянские избы Дом Сергина 1884 год деревня Мунозеро.
Крестьянские избы Дом Сергина 1884 год деревня Мунозеро. «Нестандартный маркетинг частной школы»
«Нестандартный маркетинг частной школы» Презентация на тему Беседа об этикете поведения детей и взрослых
Презентация на тему Беседа об этикете поведения детей и взрослых Тест по литературе в 6 классе: Иван Сергеевич Тургенев "Муму"
Тест по литературе в 6 классе: Иван Сергеевич Тургенев "Муму" Заседание межведомственного совета по образованию при главе администрации Лужского муниципального района ПОВЕСТКА ДНЯ1. Отчет
Заседание межведомственного совета по образованию при главе администрации Лужского муниципального района ПОВЕСТКА ДНЯ1. Отчет  Knopki3_okonch (1)
Knopki3_okonch (1) Исследование молодежных конфликтов и пути их разрешения
Исследование молодежных конфликтов и пути их разрешения Презентация на тему Опустынивание
Презентация на тему Опустынивание  Большая стирка
Большая стирка Путешествуем с Азбукой
Путешествуем с Азбукой Интегрированная распределенная система информационного обмена результатами тестирования
Интегрированная распределенная система информационного обмена результатами тестирования ПРЕДОСТАВЛЕНИЕ ГОСУДАРСТВЕННОЙ ПОДДЕРЖКИ В СФЕРЕ НАУЧНОЙ, НАУЧНО-ТЕХНИЧЕСКОЙ И ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ
ПРЕДОСТАВЛЕНИЕ ГОСУДАРСТВЕННОЙ ПОДДЕРЖКИ В СФЕРЕ НАУЧНОЙ, НАУЧНО-ТЕХНИЧЕСКОЙ И ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ