Слайд 2Хлороводород HCl
HCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха.
Докажем

это:
М (HCl)= 1+35,5=36,5 г/моль
М (воздуха)= 29 г/моль
Слайд 3Получение HCl
В лаборатории:
t
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl
В промышленности:
H2 +
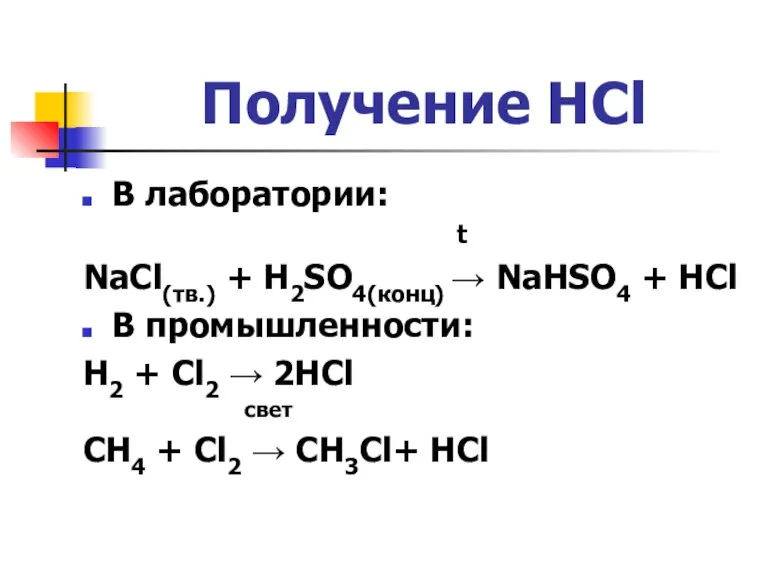
Cl2 → 2HCl
свет
CH4 + Cl2 → CH3Cl+ HCl
Слайд 4Соляная кислота HCl
Соляная кислота сильная, т.е. в водных растворах полностью распадается на

ионы:
HCl → H+ + Cl-
Растворы кислоты не имеют запаха.
Слайд 5Химические свойства
Кислотные свойства
А. Взаимодействие с металлами, стоящими в ряду активности до водорода:
HCl

+ Zn →
2HCl + Zn → ZnCl2 + H2
Допишите:
HCl + Al →
Слайд 6Б. С оксидами металлов:
HCl + CuO →
2HCl + CuO → CuCl2
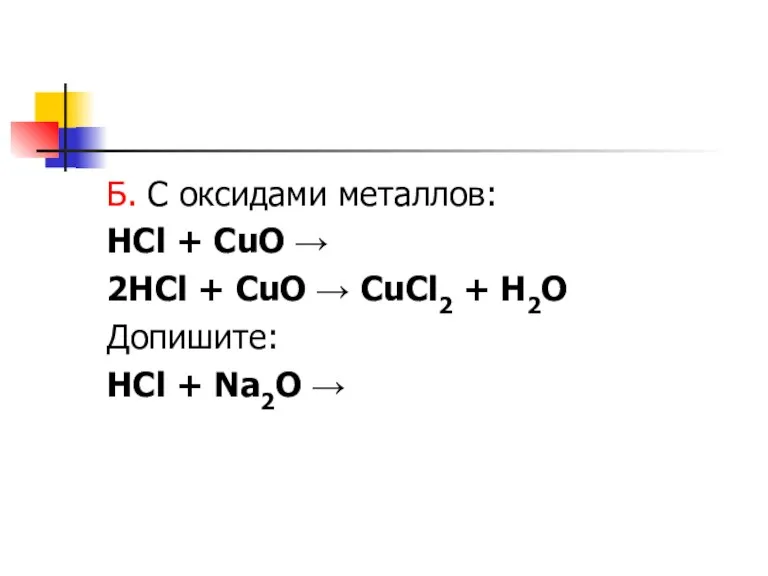
+ H2O
Допишите:
HCl + Na2O →
Слайд 7В. С гидроксидами металлов:
HCl + NaOH →
HCl + NaOH → NaCl
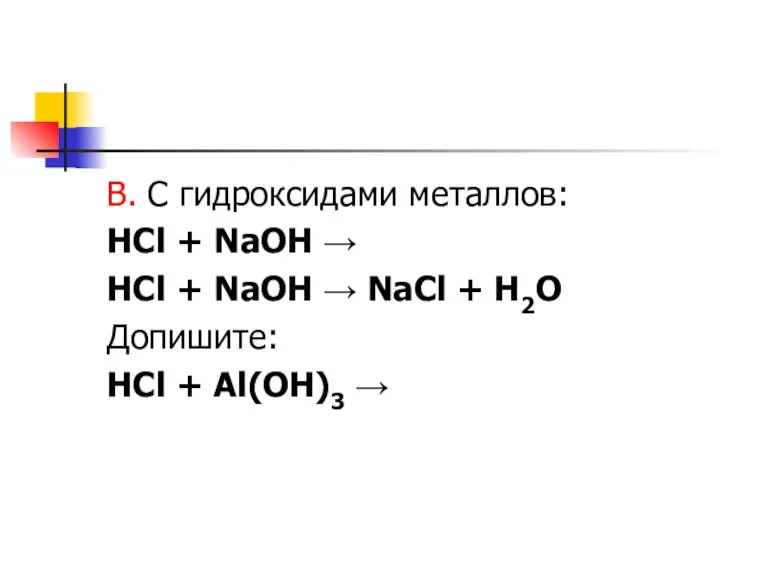
+ H2O
Допишите:
HCl + Al(OH)3 →
Слайд 8Г. С солями (при условии, если образуется осадок или газ).
HCl + AgNO3
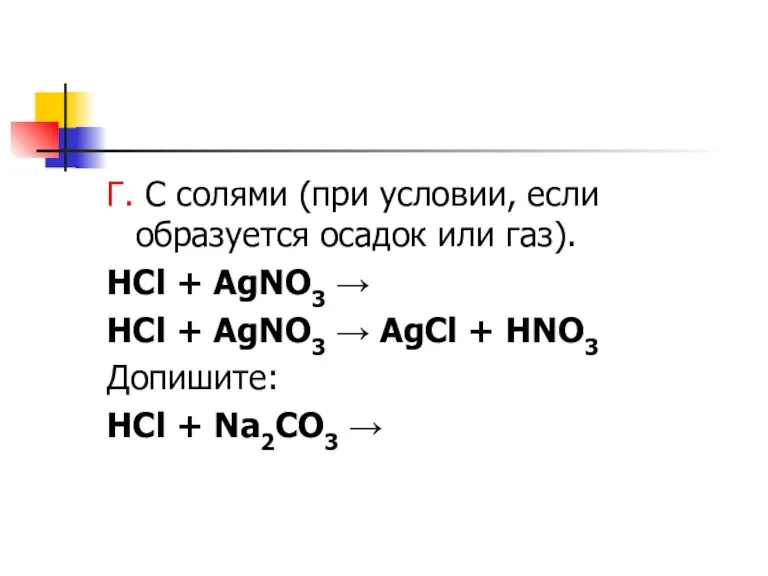
→
HCl + AgNO3 → AgCl + HNO3
Допишите:
HCl + Na2CO3 →
Слайд 92. Восстановительные свойства.
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
16HCl +

2KMnO4 → 2MnCl2 + 5Cl2 +
+ 2KCl + 8H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O








 «Аспекты лидерства»
«Аспекты лидерства» ООО СПК «ЮНИТИ РЕ»
ООО СПК «ЮНИТИ РЕ» Школа 64. Традиции школы
Школа 64. Традиции школы Вводные слова и словосочетания
Вводные слова и словосочетания Презентация на тему Чем питаются животные (1 класс)
Презентация на тему Чем питаются животные (1 класс) Новогодние программы
Новогодние программы Электронный учебник на DVDи мультимедийное методическое пособие на CD для курса «Информатика и ИКТ»
Электронный учебник на DVDи мультимедийное методическое пособие на CD для курса «Информатика и ИКТ» Презентация на тему Корневище Клубень Луковица
Презентация на тему Корневище Клубень Луковица Познай Беларусь Белорусская кухня
Познай Беларусь Белорусская кухня Культура и религия
Культура и религия ИССЛЕДОВАНИЕ РОЛИ ЭКСПЕРТНОГО СООБЩЕСТВА, СМИ, ОТРАСЛЕВЫХ АССОЦИАЦИЙ, ДРУГИХ ОБЩЕСТВЕННЫХ ОБЪЕДИНЕНИЙ В ОПРЕДЕЛЕНИИ ПРОДОВОЛЬСТ
ИССЛЕДОВАНИЕ РОЛИ ЭКСПЕРТНОГО СООБЩЕСТВА, СМИ, ОТРАСЛЕВЫХ АССОЦИАЦИЙ, ДРУГИХ ОБЩЕСТВЕННЫХ ОБЪЕДИНЕНИЙ В ОПРЕДЕЛЕНИИ ПРОДОВОЛЬСТ Подготовка к региональному этапу всероссийской олимпиады школьников по обществознанию
Подготовка к региональному этапу всероссийской олимпиады школьников по обществознанию Социальные ценности и нормы
Социальные ценности и нормы Язык — душа народа!
Язык — душа народа! Сложное горячее блюдо
Сложное горячее блюдо Выбери цвет
Выбери цвет Презентация «Экология жилища» подготовлена по материалам журнала «Maxim» ученицей 9«А» класса ЦО 1685 Бариновой Дарьей Москва, 201
Презентация «Экология жилища» подготовлена по материалам журнала «Maxim» ученицей 9«А» класса ЦО 1685 Бариновой Дарьей Москва, 201 Hausratversicherung
Hausratversicherung Оценка ценных бумаг. Тема № 8
Оценка ценных бумаг. Тема № 8 Словообразование имен прилагательных (6 класс)
Словообразование имен прилагательных (6 класс) Русские народные песни
Русские народные песни Земельные ресурсы
Земельные ресурсы История, запечатленная в памятниках
История, запечатленная в памятниках Рівненський науково - виробничий центр стандартизації, метрології та сертифікації
Рівненський науково - виробничий центр стандартизації, метрології та сертифікації Кукла-мотанка. Забытая игрушка
Кукла-мотанка. Забытая игрушка Наша армия. Пограничные войска
Наша армия. Пограничные войска Урок – практикум. Подготовка и проведение.
Урок – практикум. Подготовка и проведение. Интегрированное занятиес дошкольниками «Правила безопасного перехода через дорогу»
Интегрированное занятиес дошкольниками «Правила безопасного перехода через дорогу»