Содержание
- 3. I период: H He 2 элемента Схема периодов периодической таблицы II период: Li Ne 8 элементов
- 4. Группы периодической таблицы Главная подгруппа H 1 водород Li 3 литий Na 11 натрий K 19
- 5. Лантаноиды 58 Сe Церий 59 Pr Празеодим 60 Nd Неодим 61 Pm Прометий 62 Sm Самарий
- 6. Современная формулировка периодического закона Д.И.Менделеева Свойства химических элементов и образованных ими веществ находятся в периодической зависимости
- 7. Г р у п п ы П е р и о д ы I II III
- 8. I II III IV V VI VII VIII II III Периоды Группы Li2O BeO B2O3 CO2
- 9. Изменение свойств оксидов и гидроксидов I II III IV V VI VII VIII II III Li2O
- 10. Задания В главных подгруппах периодической системы химических элементов Д.И.Менделеева с увеличением заряда ядра радиус атомов, как
- 11. Памятник Д.И.Менделееву в Санкт- Петербурге Периодическому закону не грозит разрушение, а обещаются только надстройка и развитие.
- 13. Скачать презентацию
Слайд 3I период: H He
2 элемента
Схема периодов периодической таблицы
II период: Li
I период: H He
2 элемента
Схема периодов периодической таблицы
II период: Li
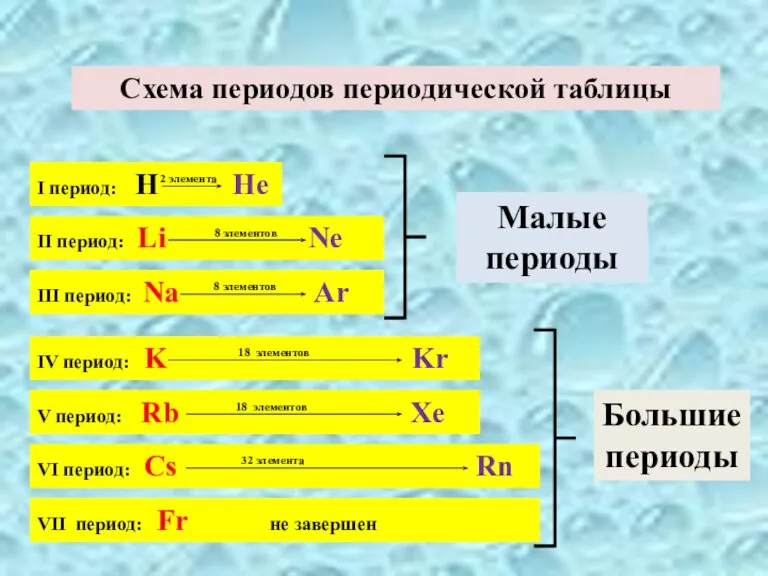
8 элементов
III период: Na Ar
Малые периоды
8 элементов
IV период: K Kr
18 элементов
V период: Rb Xe
18 элементов
VI период: Сs Rn
32 элемента
VII период: Fr не завершен
Большие периоды
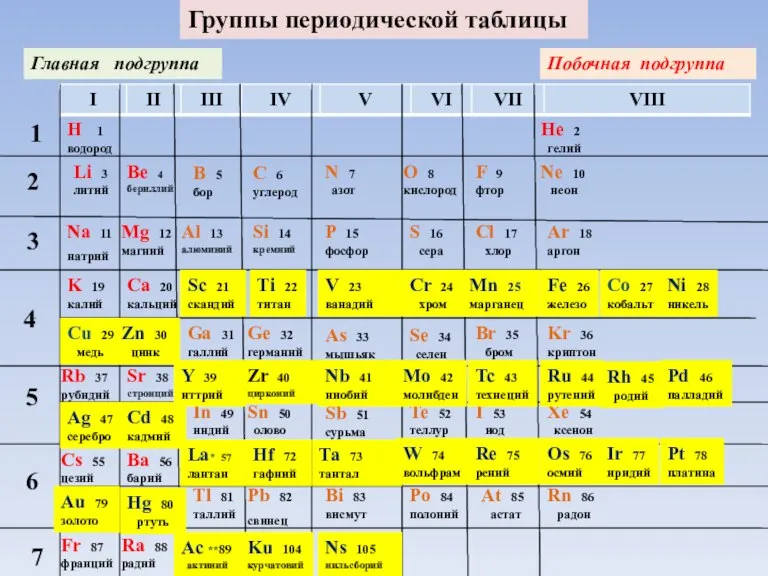
Слайд 4Группы периодической таблицы
Главная подгруппа
H 1
водород
Li 3
литий
Na 11
натрий
K 19
калий
Rb 37
рубидий
Cs 55
цезий
1
2
3
4
5
6
7
Fr 87
франций
Be
Группы периодической таблицы
Главная подгруппа
H 1
водород
Li 3
литий
Na 11
натрий
K 19
калий
Rb 37
рубидий
Cs 55
цезий
1
2
3
4
5
6
7
Fr 87
франций
Be
бериллий
Mg 12
магний
Ca 20
кальций
Sr 38
стронций
Ba 56
барий
Ra 88
радий
B 5
бор
Al 13
алюминий
Ga 31
галлий
In 49
индий
Tl 81
таллий
C 6
углерод
Si 14
кремний
Ge 32
германий
Sn 50
олово
Pb 82
свинец
N 7
азот
P 15
фосфор
As 33
мышьяк
Sb 51
сурьма
Bi 83
висмут
O 8
кислород
S 16
сера
Se 34
селен
Te 52
теллур
Po 84
полоний
F 9
фтор
Cl 17
хлор
Br 35
бром
I 53
иод
At 85
астат
He 2
гелий
Ne 10
неон
Ar 18
аргон
Kr 36
криптон
Xe 54
ксенон
Rn 86
радон
Побочная подгруппа
Cu 29
медь
Ag 47
серебро
Au 79
золото
Zn 30
цинк
Cd 48
кадмий
Hg 80
ртуть
Sc 21
скандий
Y 39
иттрий
La* 57
лантан
Ac **89
актиний
Ti 22
титан
Zr 40
цирконий
Hf 72
гафний
Ku 104
курчатовий
V 23
ванадий
Nb 41
ниобий
Ta 73
тантал
Ns 105
нильсборий
Cr 24
хром
Mo 42
молибден
W 74
вольфрам
Mn 25
марганец
Tc 43
технеций
Re 75
рений
Fe 26
железо
Co 27
кобальт
Ni 28
никель
Ru 44
рутений
Rh 45
родий
Pd 46
палладий
Os 76
осмий
Ir 77
иридий
Pt 78
платина
Слайд 5Лантаноиды
58
Сe
Церий
59
Pr
Празеодим
60
Nd
Неодим
61
Pm
Прометий
62
Sm
Самарий
63
Eu
Европий
64
Gd
Гадолиний
65
Tb
Тербий
66
Dy
Диспрозий
67
Ho
Гольмий
68
Лантаноиды
58
Сe
Церий
59
Pr
Празеодим
60
Nd
Неодим
61
Pm
Прометий
62
Sm
Самарий
63
Eu
Европий
64
Gd
Гадолиний
65
Tb
Тербий
66
Dy
Диспрозий
67
Ho
Гольмий
68

Эрбий
69
Tm
Тулий
70
Yb
Иттербий
71
Lu
Лютеций
Актиноиды
90
Th
Торий
91
Pa
Протактиний
92
U Уран
93
Np
Нептуний
94
Pu
Плутоний
95
Am
Америций
96
Cm
Кюрий
97
Bk
Берклий
98
Cf
Калифорний
99
Es
Эйнштейний
100
Fm
Фермий
101
Md
Менделевий
102
No
Нобелий
103
Lr
Лоуренсий
Термины «лантаноиды» и «актиноиды»
были предложены в 1948 году профессором ЛГУ
С.А.Щукаревым
Слайд 6Современная формулировка периодического закона Д.И.Менделеева
Свойства химических элементов и
образованных ими веществ находятся
Современная формулировка периодического закона Д.И.Менделеева
Свойства химических элементов и
образованных ими веществ находятся
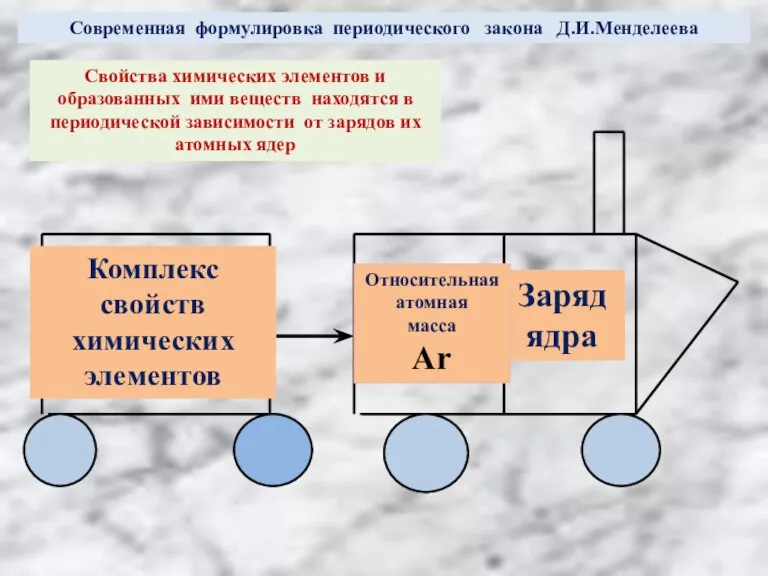
периодической зависимости от зарядов их
атомных ядер
Заряд
ядра
Относительная
атомная
масса
Ar
Комплекс свойств
химических
элементов
Слайд 7Г р у п п ы
П
е
р
и
о
д
ы
I
II
III
IV
V
VI
VII
VIII
I
II
III
IV
V
VI
VII
Fr
Щелочные металлы
Галогены
Инертные (благородные газы)
F
В пределах одного и
Г р у п п ы
П
е
р
и
о
д
ы
I
II
III
IV
V
VI
VII
VIII
I
II
III
IV
V
VI
VII
Fr
Щелочные металлы
Галогены
Инертные (благородные газы)
F
В пределах одного и
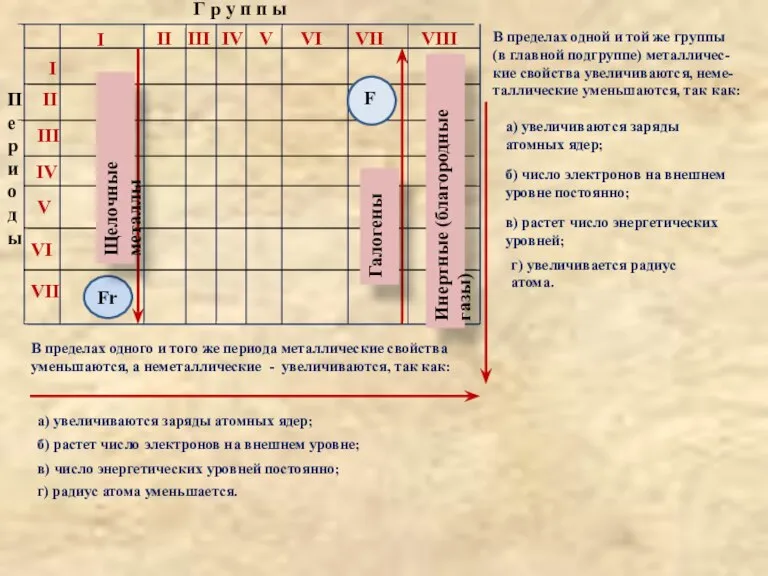
уменьшаются, а неметаллические - увеличиваются, так как:
а) увеличиваются заряды атомных ядер;
б) растет число электронов на внешнем уровне;
в) число энергетических уровней постоянно;
г) радиус атома уменьшается.
В пределах одной и той же группы
(в главной подгруппе) металличес-
кие свойства увеличиваются, неме-
таллические уменьшаются, так как:
а) увеличиваются заряды
атомных ядер;
б) число электронов на внешнем
уровне постоянно;
в) растет число энергетических
уровней;
г) увеличивается радиус
атома.
Слайд 8I
II
III
IV
V
VI
VII
VIII
II
III
Периоды
Группы
Li2O
BeO
B2O3
CO2
N2O5
Na2O
Al203
SiO2
P2O5
SO3
Cl2O7
+1
+1
+2
MgO
+2
+3
+3
+4
+4
+5
+5
+6
+7
I
II
III
IV
V
VI
VII
VIII
II
III
Периоды
Группы
CH4
NH3
H2O
HF
SiH4
РН3
H2S
HCl
-4
-4
-3
-3
-2
-2
-1
-1
Степень окисления высших оксидов возрастает от + 1
I
II
III
IV
V
VI
VII
VIII
II
III
Периоды
Группы
Li2O
BeO
B2O3
CO2
N2O5
Na2O
Al203
SiO2
P2O5
SO3
Cl2O7
+1
+1
+2
MgO
+2
+3
+3
+4
+4
+5
+5
+6
+7
I
II
III
IV
V
VI
VII
VIII
II
III
Периоды
Группы
CH4
NH3
H2O
HF
SiH4
РН3
H2S
HCl
-4
-4
-3
-3
-2
-2
-1
-1
Степень окисления высших оксидов возрастает от + 1

Степень окисления в летучих водородных соединениях возрастает от -4 до -1
Слайд 9Изменение свойств оксидов и гидроксидов
I
II
III
IV
V
VI
VII
VIII
II
III
Li2O Be B2O3 CO2 N2O5
LiOH Be(OH)2 H3BO3
Изменение свойств оксидов и гидроксидов
I
II
III
IV
V
VI
VII
VIII
II
III
Li2O Be B2O3 CO2 N2O5
LiOH Be(OH)2 H3BO3
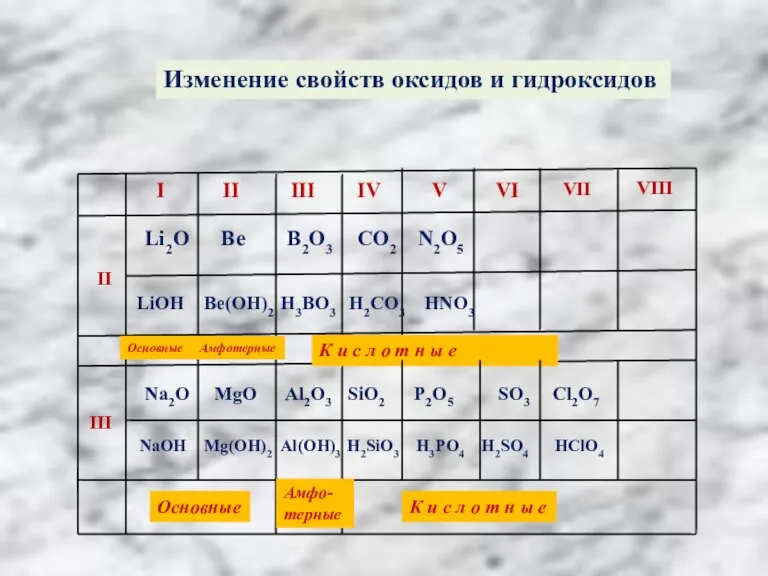
Основные
Амфотерные
К и с л о т н ы е
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
NaOH Mg(OH)2 Аl(ОН)3 H2SiO3 H3PO4 H2SO4 HClO4
Основные
Амфо-
терные
К и с л о т н ы е
Слайд 10Задания
В главных подгруппах периодической системы химических элементов
Д.И.Менделеева с увеличением заряда ядра
Задания
В главных подгруппах периодической системы химических элементов
Д.И.Менделеева с увеличением заряда ядра

1) увеличивается
2) уменьшается
3) не изменяется
4) изменяется периодически
ОТВЕТ:
1
Наиболее ярко выраженные неметаллические свойства среди элементов
2-го периода периодической системы химических элементов Д.И.Менделеева
проявляет:
1) бор
2) углерод
3) азот
4) кислород
ОТВЕТ:
4
В периодах периодической системы химических элементов
Д.И.Менделеева с увеличением заряда ядер атомов не изменяется:
1) масса атомов
2) число энергетических уровней
3) общее число электронов
4) число электронов на внешнем энергетическом уровне
ОТВЕТ:
2
В ряду элементов Na → Mg → Al → Si → Cl:
1) неметаллические свойства ослабевают
2) металлические свойства усиливаются
3) металлические свойства не изменяются
4) металлические свойства ослабевают
ОТВЕТ:
4
Слайд 11Памятник Д.И.Менделееву в Санкт-
Петербурге
Периодическому закону не грозит разрушение,
а обещаются только надстройка и
Памятник Д.И.Менделееву в Санкт-
Петербурге
Периодическому закону не грозит разрушение,
а обещаются только надстройка и

Д.И.Менделеев

 Презентация на тему Презентация на тему Вилка
Презентация на тему Презентация на тему Вилка Натуральное хозяйство
Натуральное хозяйство Акробатическая комбинация. Методика обучения стойки
Акробатическая комбинация. Методика обучения стойки Как появилось земледелие и скотоводство?
Как появилось земледелие и скотоводство? Метод максимальной парсимонии
Метод максимальной парсимонии  Компания «Старое такси» входит в состав транспортной корпорации «МосТрансГрупп». Вас обслуживают: профессиональные водители с от
Компания «Старое такси» входит в состав транспортной корпорации «МосТрансГрупп». Вас обслуживают: профессиональные водители с от Proekt_Mitsenko (1)
Proekt_Mitsenko (1) Управление инженерными данными, реализация передового инструментария в решении на платформе 1С:Предприятие 8
Управление инженерными данными, реализация передового инструментария в решении на платформе 1С:Предприятие 8 Основные методические приемы развития критического мышления
Основные методические приемы развития критического мышления Как мы сделали это
Как мы сделали это Нормативно-правовое обеспечение деятельности учреждений дополнительного образования детей
Нормативно-правовое обеспечение деятельности учреждений дополнительного образования детей Поле и вещество. Фундаментальные взаимодействия
Поле и вещество. Фундаментальные взаимодействия Презентация ко Дню знаний (1 сентября)
Презентация ко Дню знаний (1 сентября) Jingle Bells
Jingle Bells Юридический центр БизнесГарант представляет
Юридический центр БизнесГарант представляет Sobranie_1
Sobranie_1 Свадебный танец
Свадебный танец В системе комплексной физкультурно-оздоровительной работы
В системе комплексной физкультурно-оздоровительной работы Сущность, движущие силы, противоречия и логика образовательного процесса. Закономерности и принципы обучения
Сущность, движущие силы, противоречия и логика образовательного процесса. Закономерности и принципы обучения СИСТЕМЫ УПРАВЛЕНИЯ И КОНТРОЛЯ ДЛЯ КРУПНЫХ ПЕЛЛЕТНЫХ ПРОИЗВОДСТВ. МИНИМИЗАЦИЯ ЧЕЛОВЕЧЕСКОГО ФАКТОРА.
СИСТЕМЫ УПРАВЛЕНИЯ И КОНТРОЛЯ ДЛЯ КРУПНЫХ ПЕЛЛЕТНЫХ ПРОИЗВОДСТВ. МИНИМИЗАЦИЯ ЧЕЛОВЕЧЕСКОГО ФАКТОРА. Презентация на тему Драгоценные камни
Презентация на тему Драгоценные камни  Стиральные порошки и их экологическое воздействие на окружающую среду
Стиральные порошки и их экологическое воздействие на окружающую среду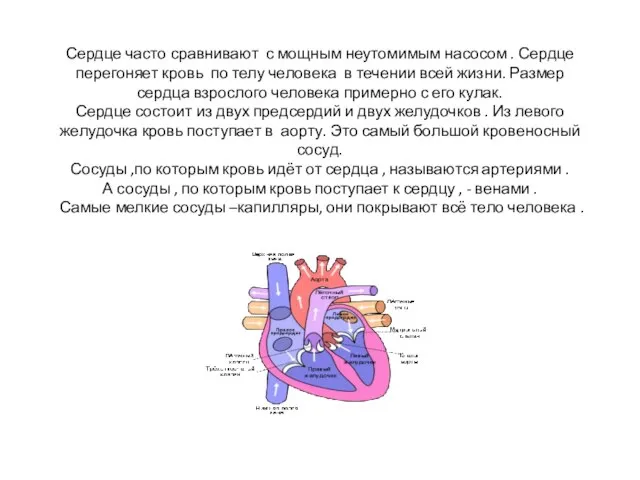 Сердце часто сравнивают с мощным неутомимым насосом . Сердце перегоняет кровь по телу человека в течении всей жизни. Размер сердц
Сердце часто сравнивают с мощным неутомимым насосом . Сердце перегоняет кровь по телу человека в течении всей жизни. Размер сердц Задание на самоподготовку по ОБЖ
Задание на самоподготовку по ОБЖ Презентация на тему Крещение Руси легенда и факты
Презентация на тему Крещение Руси легенда и факты  9-3-nozimigikas-idejas
9-3-nozimigikas-idejas Деловая беседа как основная форма делового общения
Деловая беседа как основная форма делового общения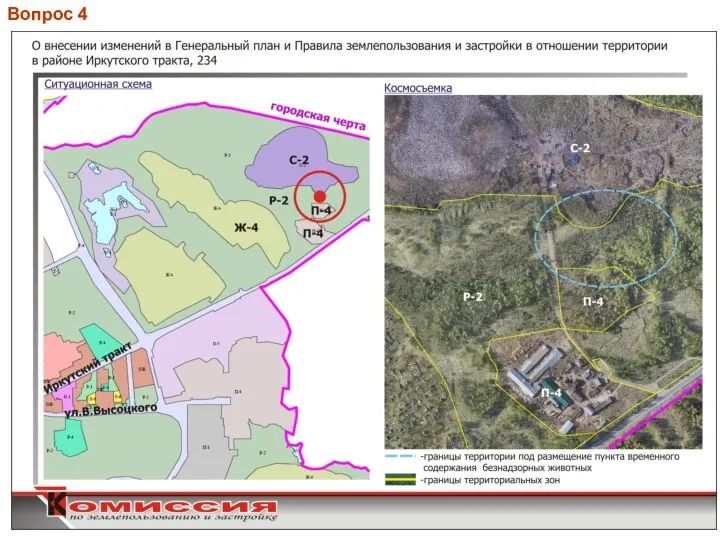 О внесении изменений в ген план и правила землепользования и застройки в отношении территории в районе Иркутского тракта
О внесении изменений в ген план и правила землепользования и застройки в отношении территории в районе Иркутского тракта