Содержание
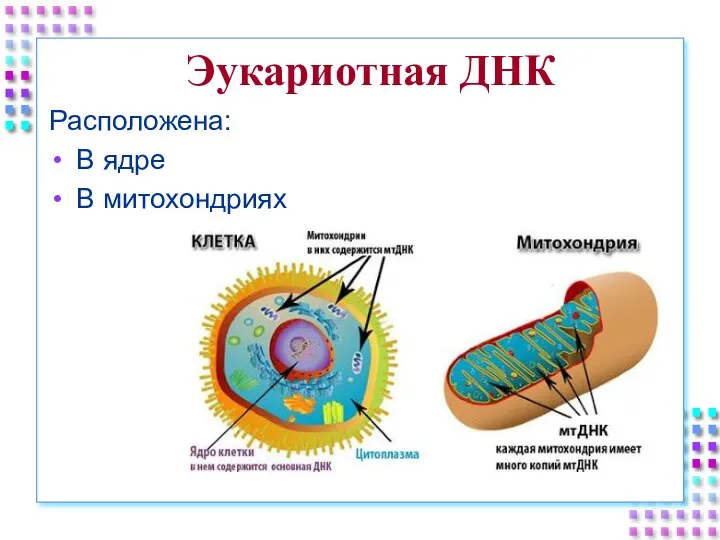
- 2. Эукариотная ДНК Расположена: В ядре В митохондриях
- 3. Ядерная ДНК Длинные линейные молекулы; В виде хроматина ↔ хромосом; Около 10% ДНК – кодирующая, остальная
- 4. Митохондриальная ДНК Небольшие кольцевые молекулы Количество – от 2-х до 10 в одной митохондрии Количество мт-ДНК
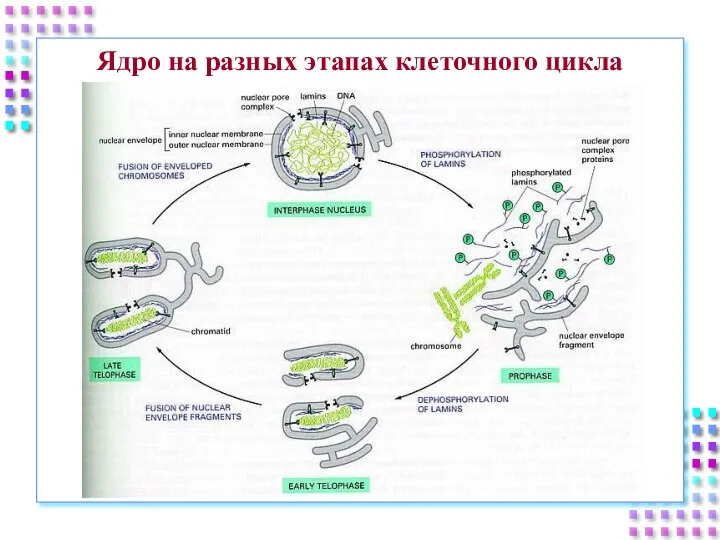
- 5. Ядро на разных этапах клеточного цикла
- 6. Функции ядра Хранение и функциональная упаковка ДНК: Эухроматин – активная ГИ; Гетерохроматин – неактивная ДНК. Контроль
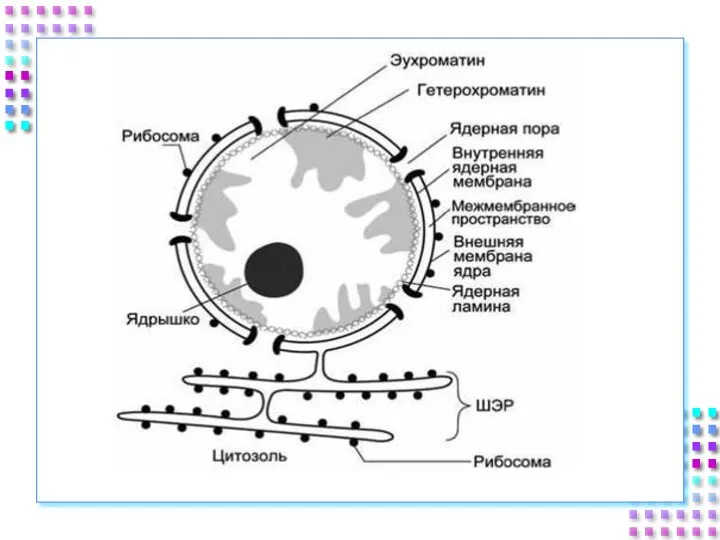
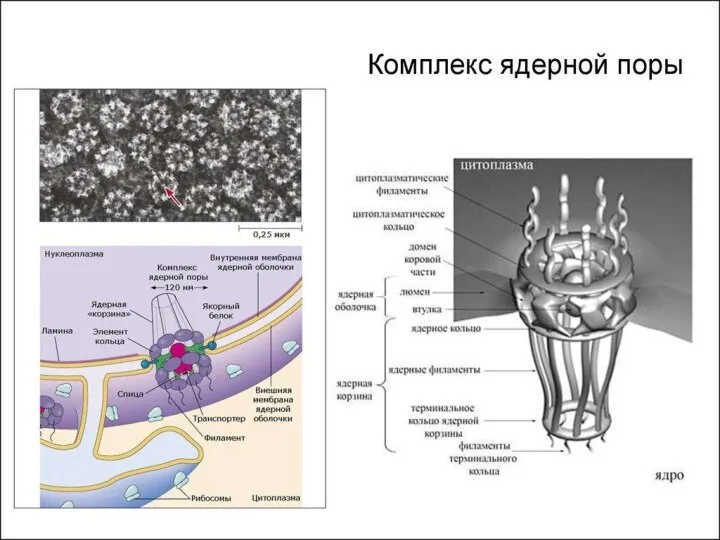
- 7. Строение ядра 1) Ядерная оболочка: Внешняя ядерная мембрана Внутренняя ядерная мембрана Перинуклеарное пространство Поровый комплекс Ядерная
- 9. 1. Ядерная оболочка Состоит из двух мембран липопротеиновой природы Внешняя мембрана продолжается в мембраны шЭПС, на
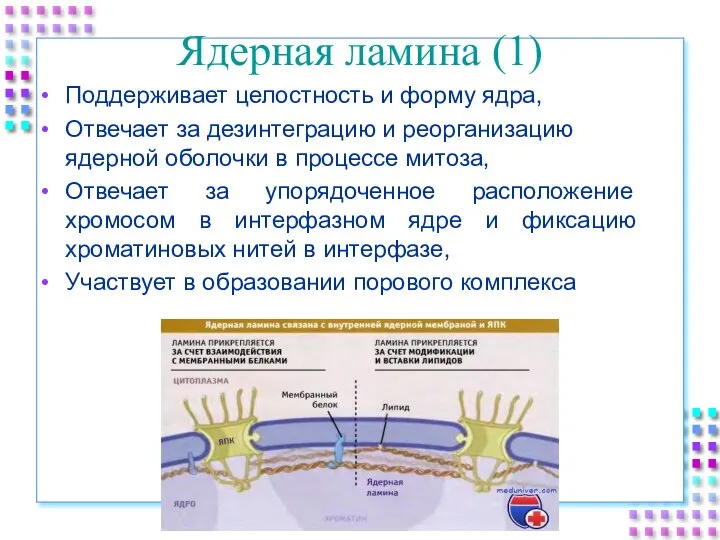
- 11. Ядерная ламина (1) Поддерживает целостность и форму ядра, Отвечает за дезинтеграцию и реорганизацию ядерной оболочки в
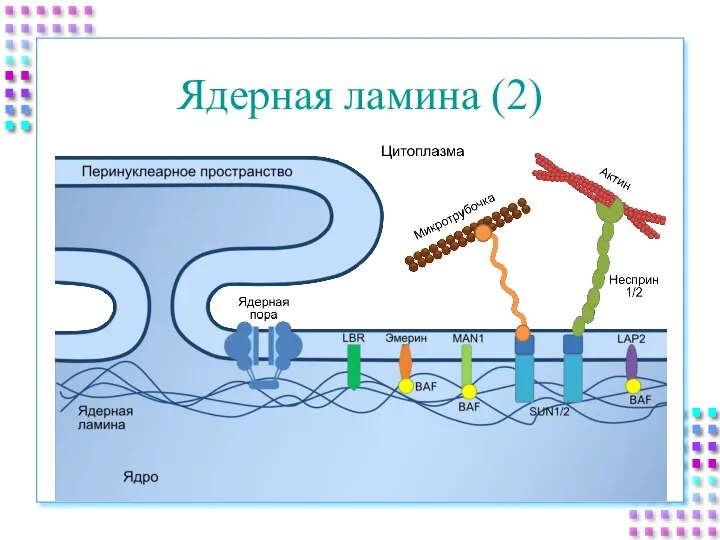
- 12. Ядерная ламина (2)
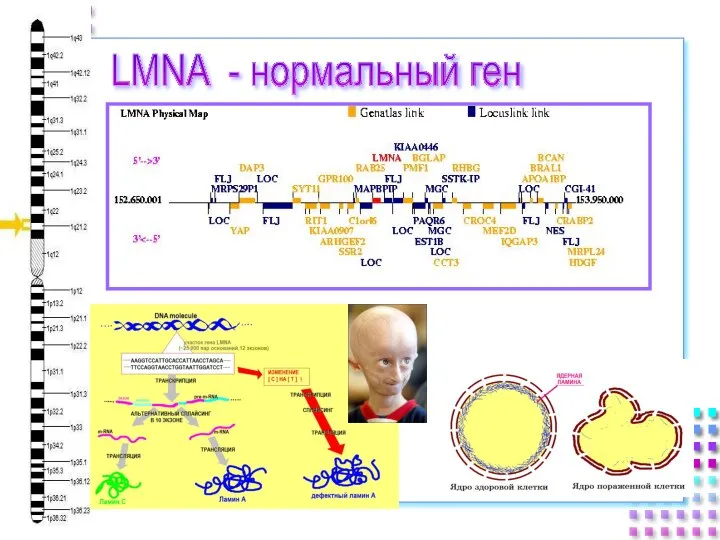
- 13. LMNA - нормальный ген
- 14. Ядерная ламина, болезни и старение человека Мутации гена ламина A/C (LMNA) у пациентов с дилатационной кардиомиопатией
- 15. 2. Кариоплазма и ядерный матрикс внутреннее содержимое ядра, содержит жидкую фракцию и матрикс жидкая фракция ядра
- 16. Ядерный матрикс Собственно матрикс (нерастворимые белки – негистоны, ферменты, нуклеоплазмины, матрины и др.) Внутриядерная сеть фибриллярных
- 17. Функции ядерного матрикса Обеспечивает форму и внутреннюю организацию ядра Пространственное распределение хроматина и его конденсация(упаковка) Передвижение
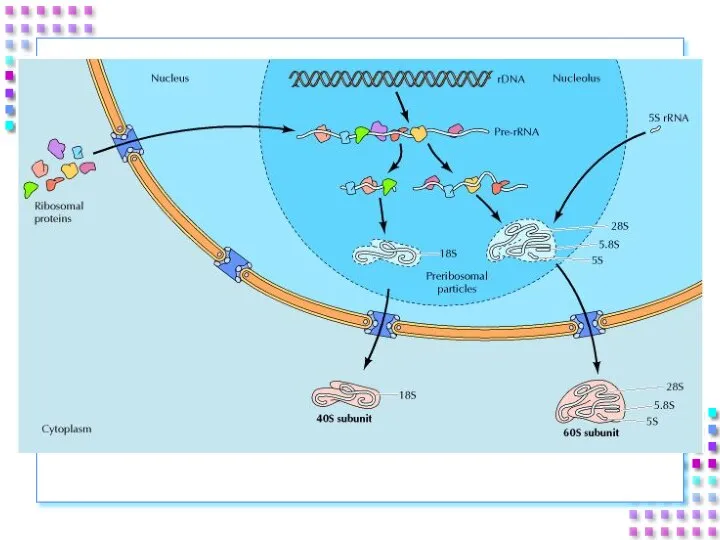
- 18. 3. Ядрышко Ядрышковый организатор – фрагменты ДНК содержащие информацию о рРНК; рРНК: первичные транскрипты 45S; рРНК
- 19. Ядрышко – область биогенеза рибосом: Транскрипция рибосомных генов и синтез про-рРНК (45S); Процессинг про-рРНК 45S с
- 21. Нобелевская премия в области химии 2009 года «за изучение структуры и функций рибосом“ Venkatraman Ramakrishnan, MRC
- 22. 4. ХРОМАТИН ХРОМОСОМЫ Хроматин – это частично упакованный генетический материал в интерфазе; Хромосома – максимально упакованный
- 23. Хромосомная ДНК – содержит, передает и реализует ГИ; Длинные, линейные молекулы; Гетерогенные молекулы: Кодирующие последовательности (гены):
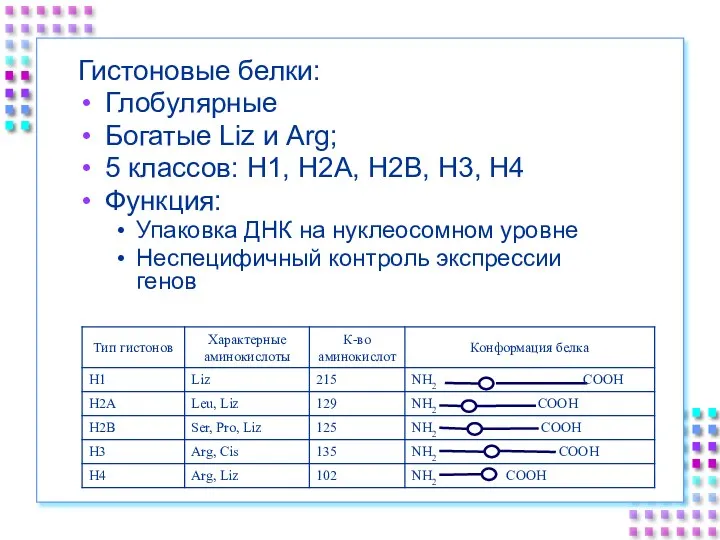
- 24. Гистоновые белки: Глобулярные Богатые Liz и Arg; 5 классов: H1, H2A, H2B, H3, H4 Функция: Упаковка
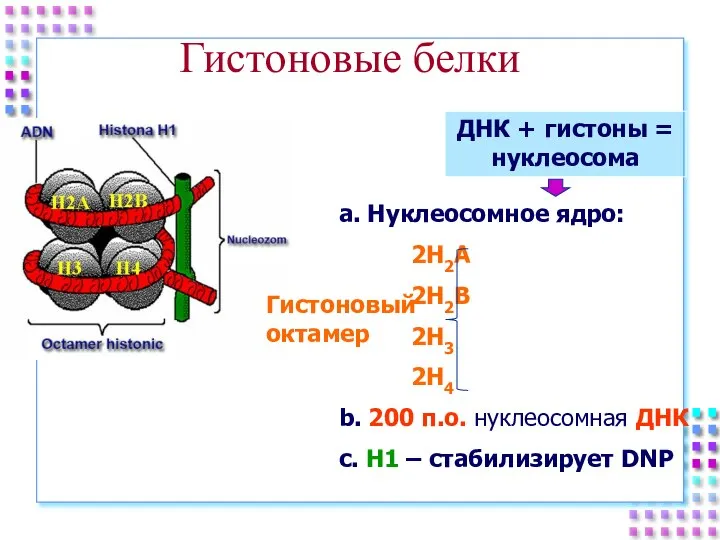
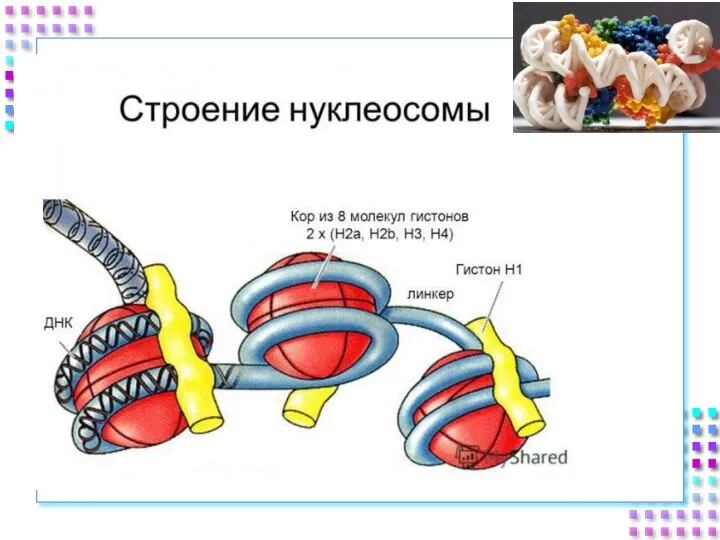
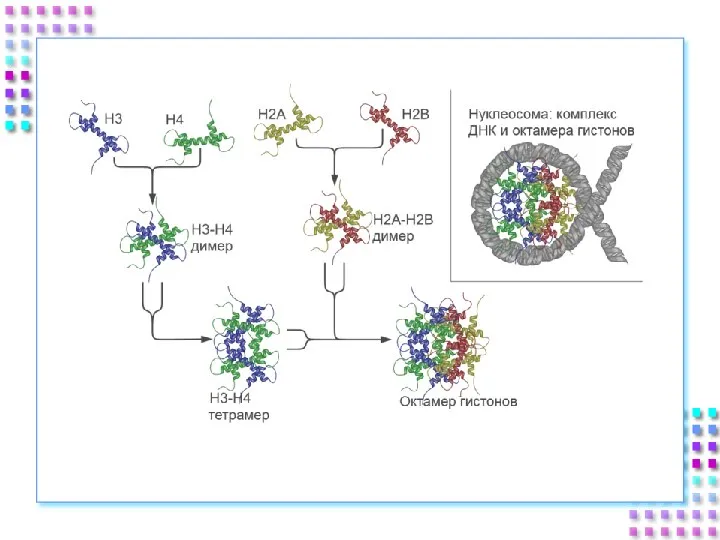
- 25. Гистоновые белки ДНК + гистоны = нуклеосома a. Нуклеосомное ядро: 2H2A 2H2B 2H3 2H4 b. 200
- 27. Негистоновые белки Крайне гетерогенные белки; Ядерные ферменты для: репликации (праймаза, ДНК-пол., ДНК-лиг.); репарации (эндонуклеазы, ДНК-пол); транскрипции
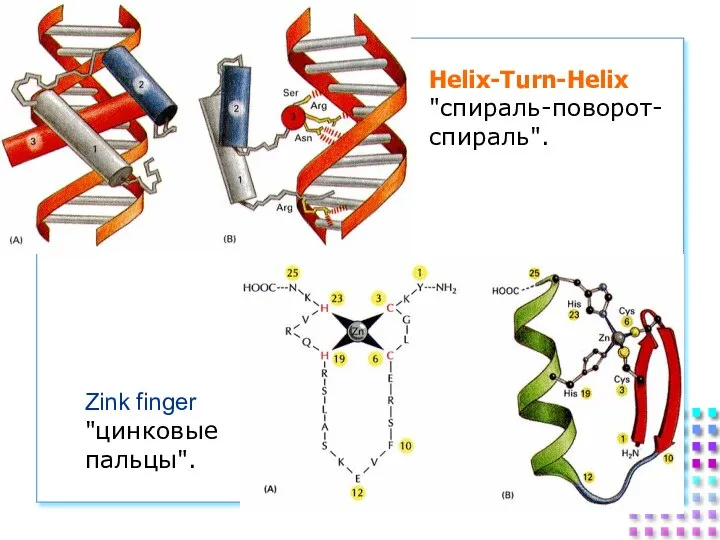
- 28. Helix-Turn-Helix "спираль-поворот- спираль". Zink finger "цинковые пальцы".
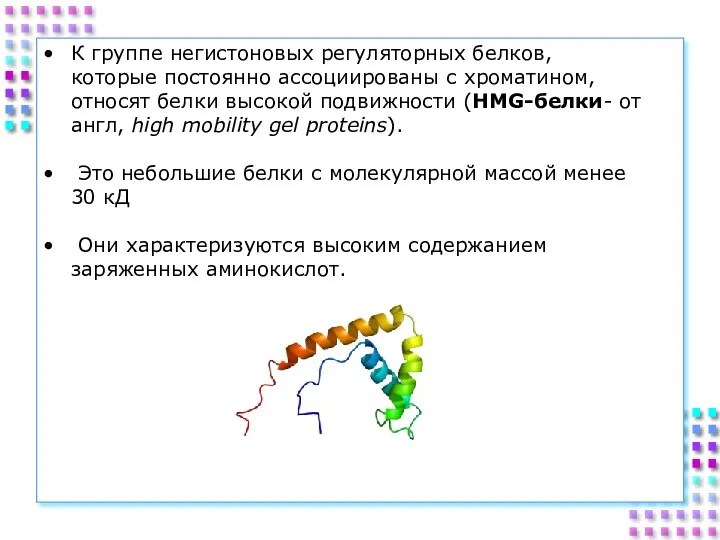
- 29. К группе негистоновых регуляторных белков, которые постоянно ассоциированы с хроматином, относят белки высокой подвижности (HMG-белки- от
- 30. Хромосомная РНК Первичные транскрипты микроРНК в составе ядерных ферментов
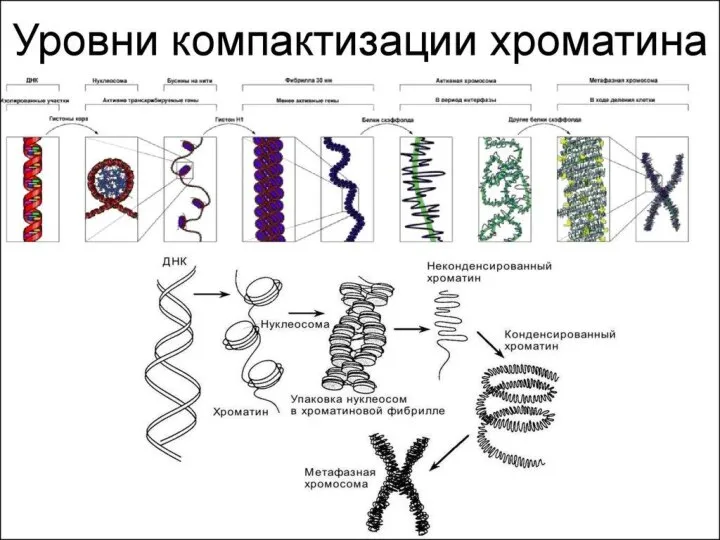
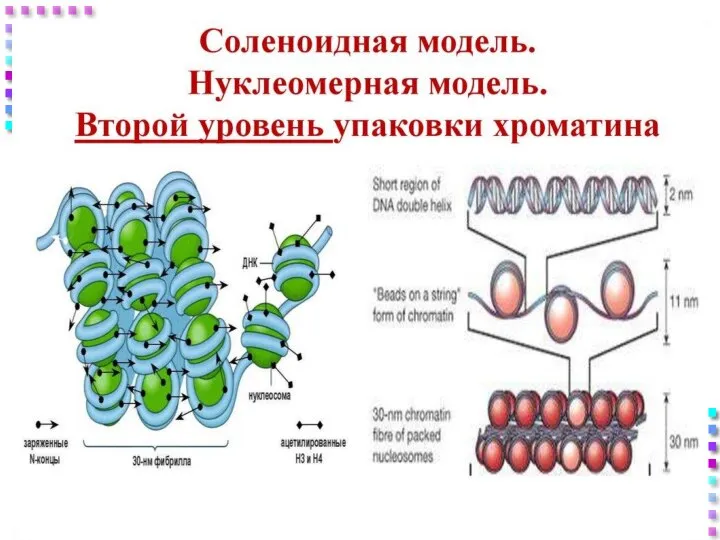
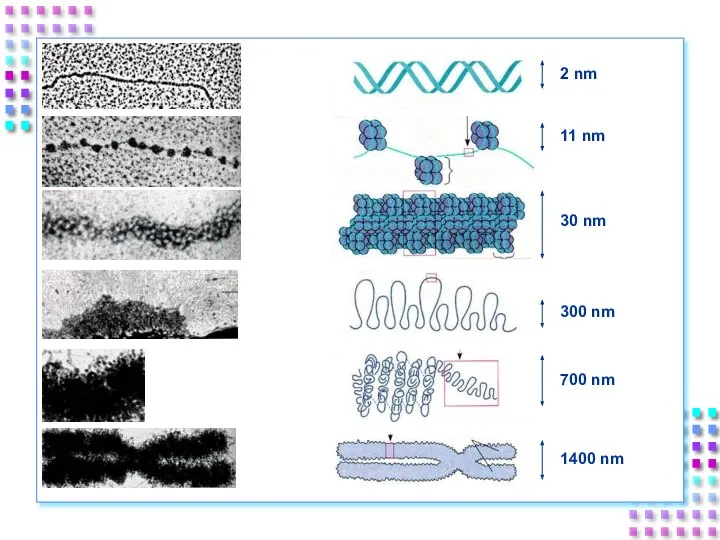
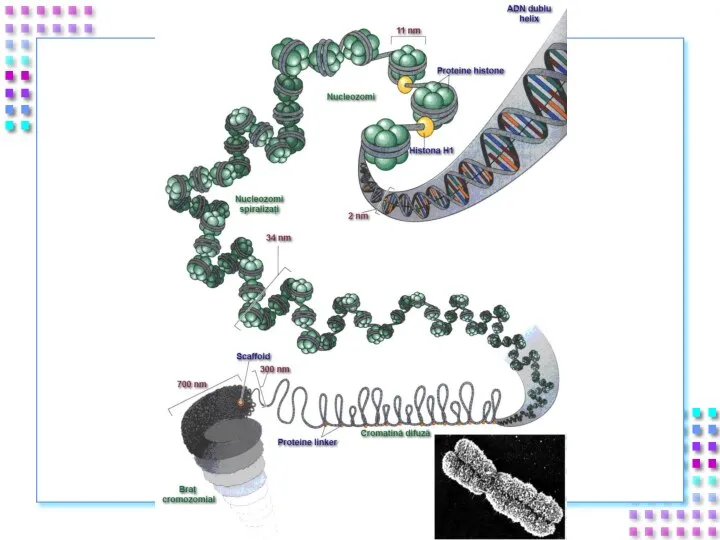
- 31. Уровни упаковки ДНК I уровень – нуклеосомный = нити хроматина; II уровень – соленоид = нити
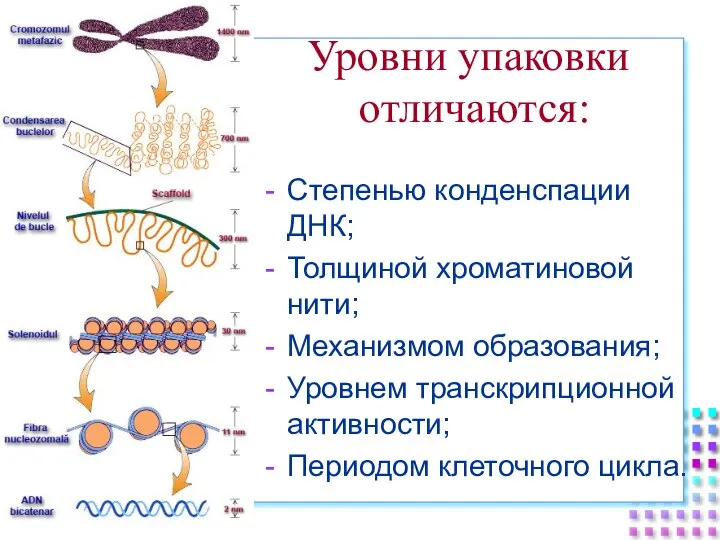
- 33. Степенью конденспации ДНК; Толщиной хроматиновой нити; Механизмом образования; Уровнем транскрипционной активности; Периодом клеточного цикла. Уровни упаковки
- 34. I уровень- нити хроматина: Полинуклеосомная нить 11nm; Степень конденсации – x 6 раз; Механизм образования: Взаимодействие
- 36. Гистоны в октамере имеют подвижный N-концевой фрагмент («хвост») из 20 аминокислот, который выступает из нуклеосом и
- 37. I уровень- нити хроматина 10 nm Сокращение гистона при старении
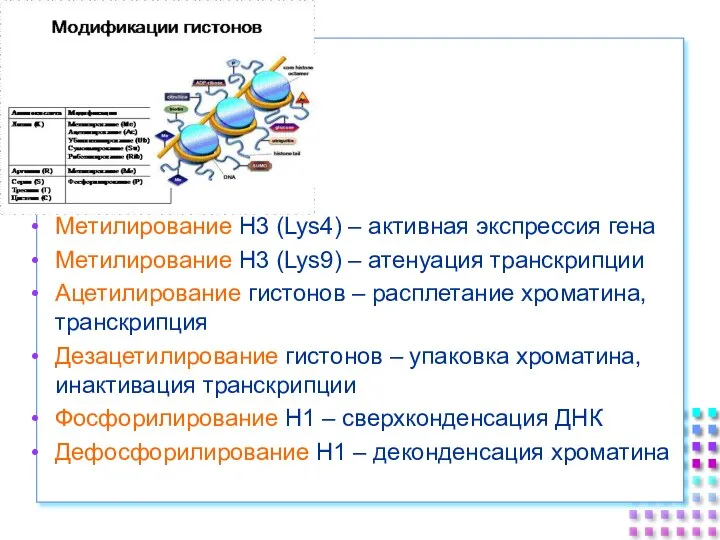
- 38. Некоторые модификации гистонов (фосфорилированиеНекоторые модификации гистонов (фосфорилирование и ацетилированиеНекоторые модификации гистонов (фосфорилирование и ацетилирование)локализованы преимущественно на
- 39. Биологи нашли слабое место в ДНК человека и других животных Ученые Института биомедицинских исследований обнаружили, что
- 40. Метилирование H3 (Lys4) – активная экспрессия гена Метилирование H3 (Lys9) – атенуация транскрипции Ацетилирование гистонов –
- 41. Пора переходить от слов к делу… Как повлиять на ацетилирование гистонов для защиты от стресса и
- 42. II уровень – соленоид Нить хроматина 30 nm; Степень конденсации – x40 раз; Механизм образования: Фосфорилирование
- 44. Нить хроматина Соленоид– 30 nm Нуклеосомная нить – 10 nm
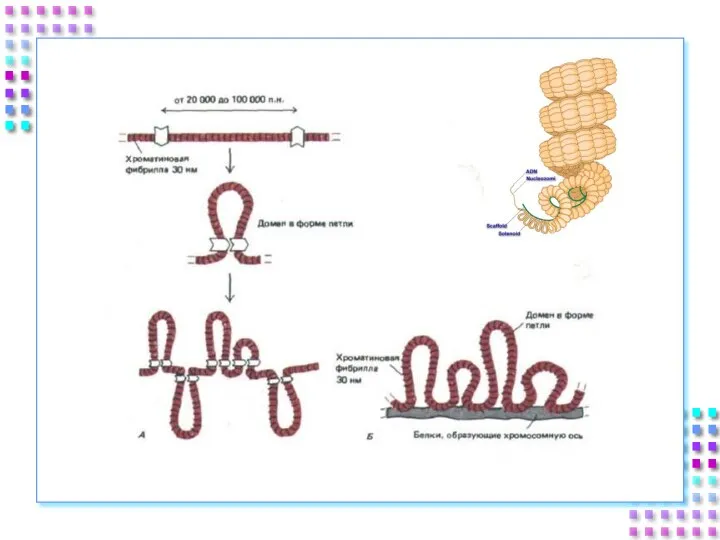
- 45. III уровень- петли Петли большие и малые, диффузные или компактные, толщина – 300 nm; Степень конденсации
- 47. !!! SAR (MAR) - (Scaffold /Matrix Associated Region) – специфические сайты ДНК ответственные за присоединение к
- 48. IV уровень – метафазная хромосома Наивысший уровень упаковки ДНК – x10000 раз; Толщина хроматиды ~700nm; Механизм
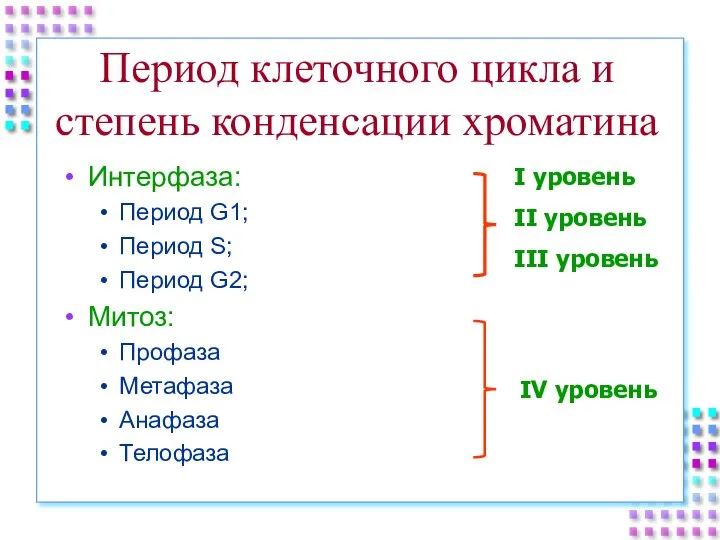
- 51. Период клеточного цикла и степень конденсации хроматина Интерфаза: Период G1; Период S; Период G2; Митоз: Профаза
- 52. Функциональная классификация хроматина: Эухроматин: Активные фрагменты ДНК; Содержит кодогенную ДНК. Гетерохроматин: Неактивные фрагменты ДНК; Содержит некодогенную
- 53. Гетерохроматин Конститутивный: Некодирующая, репетитивная ДНК; Ценромеры, теломеры, сателлиты, спейсеры. Факультативный: Кодирующая, неактивная ДНК; Может переходить в
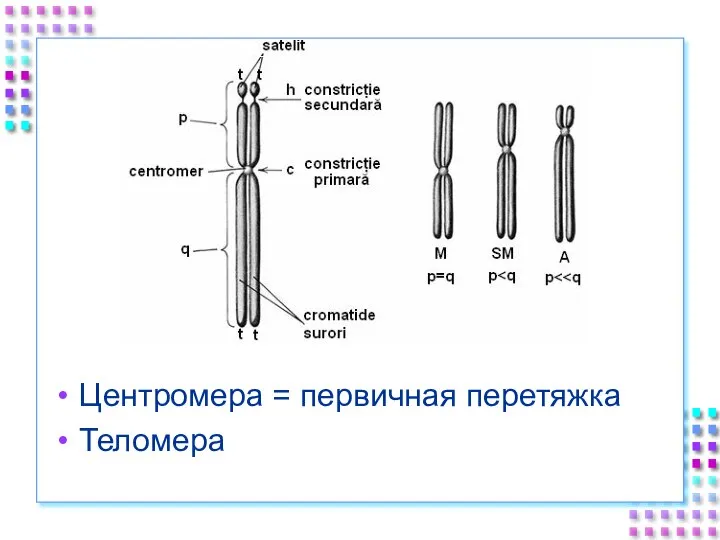
- 54. Центромера = первичная перетяжка Теломера
- 55. Центромера Повторяющиеся последовательности, богатые A/T Конститутивный гетерохроматин H3 замещен CENP-A Связывает хроматиды до анафазы митоза (коэзин)
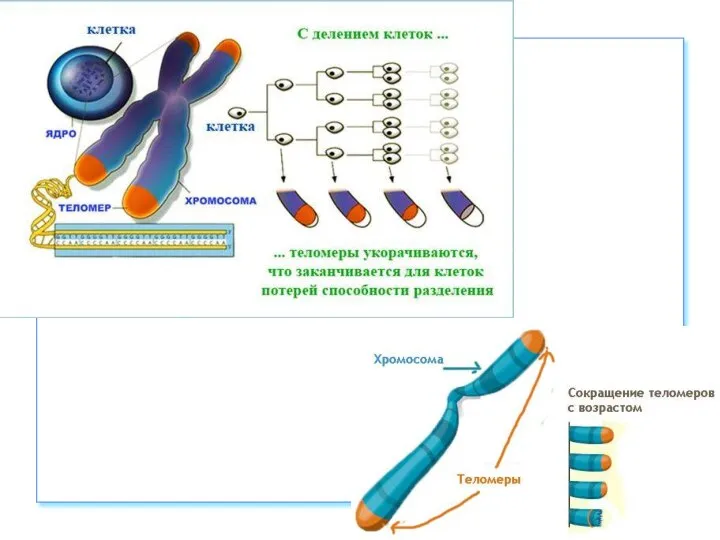
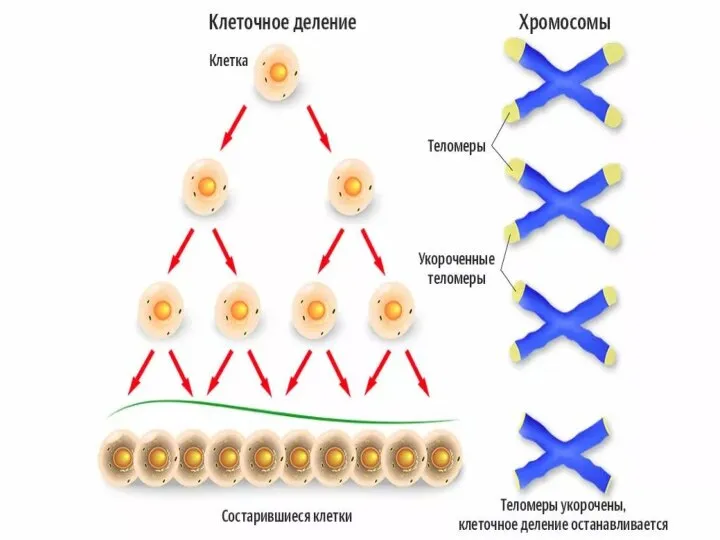
- 56. Теломеры Участки на концах хромосом, которые не несут генетической информации Каждая клетка человека имеет 92 теломеры
- 57. https://nauchforum.ru/archive/MNF_nature/5(23).pdf (дата обращения: 03.10.2018) В 1930 году Герман Меллер и Барбара Мак-Клинток пришли к заключению, что
- 60. https://nauchforum.ru/archive/MNF_nature/5(23).pdf (дата обращения: 03.10.2018) В 1971г. Алексей Оловников предложил теорию, которая объясняла механизм работы такого «счетчика»
- 61. Теломераза – удивительный фермент Способна достраивать короткие теломерные участки Состоит из РНК-матрицы и белкового компонента
- 62. Молекулярная организация теломеров Последовательности богатая G/C Образует петли на концах хромосом У человека теломеры содержат единственный
- 63. The Nobel Prize in Medicine 2009 "for the discovery of how chromosomes are protected by telomeres
- 64. Функции теломер Обеспечивают целостность хромосом и препятствуют слипанию их концов Защищают концы хромосом от действия экзонуклеаз
- 66. Скачать презентацию






































 Карачаевский медведь
Карачаевский медведь Дыхательная система у рыб
Дыхательная система у рыб CRISPR - замена антибиотиков
CRISPR - замена антибиотиков Воробей. Окружающий мир
Воробей. Окружающий мир Выделительная система позвоночных
Выделительная система позвоночных Кровеносная система человека
Кровеносная система человека Общая характеристика типа Плоские черви. Многообразие плоских червей
Общая характеристика типа Плоские черви. Многообразие плоских червей Соединительные и нервные ткани. Тема 2.1
Соединительные и нервные ткани. Тема 2.1 Тип хордовые
Тип хордовые ГОУ ВПО «Арзамасский педагогический институт имени А.П.Гайдара» «ФИТОГОРМОНЫ» Работу выполнила: студентка 3 курса 31 группы е
ГОУ ВПО «Арзамасский педагогический институт имени А.П.Гайдара» «ФИТОГОРМОНЫ» Работу выполнила: студентка 3 курса 31 группы е Органоиды клетки и их функции
Органоиды клетки и их функции Режим жизнедеятельности
Режим жизнедеятельности Дыхательная система
Дыхательная система Зелёные водоросли, их многообразие, строение, среда обитания
Зелёные водоросли, их многообразие, строение, среда обитания Сцепленное наследование генов
Сцепленное наследование генов Культура флоксов
Культура флоксов Общая характеристика хвощей
Общая характеристика хвощей Биосфера — оболочка Земли
Биосфера — оболочка Земли Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Физиология центральной нервной системы
Физиология центральной нервной системы Лядвенец рогатый (lotus corniculatus)
Лядвенец рогатый (lotus corniculatus) Правильное питание - залог здоровья. Голод - геоэкологическая проблема
Правильное питание - залог здоровья. Голод - геоэкологическая проблема Живые клетки
Живые клетки Комнатные растения
Комнатные растения Анатомия органов растений
Анатомия органов растений Биосинтез и катаболизм коллагена, гликозаминогликанов и протеогликанов
Биосинтез и катаболизм коллагена, гликозаминогликанов и протеогликанов Изучение строения растительной и животной клеток под микроскопом Лабораторная работа
Изучение строения растительной и животной клеток под микроскопом Лабораторная работа Вегетативная нервная система
Вегетативная нервная система