Содержание
- 2. Общи закони на термодинамиката I. Първи общ закон за запазване на енергията: При всяка физична или
- 3. За затворени системи: ΔG = ΔH - T ΔS или в условията на биохимичните реакции: ΔG
- 4. Изчисляване на ΔG промяна в свободната енергия на Гибс, т.е тази част от общата енергетична промяна
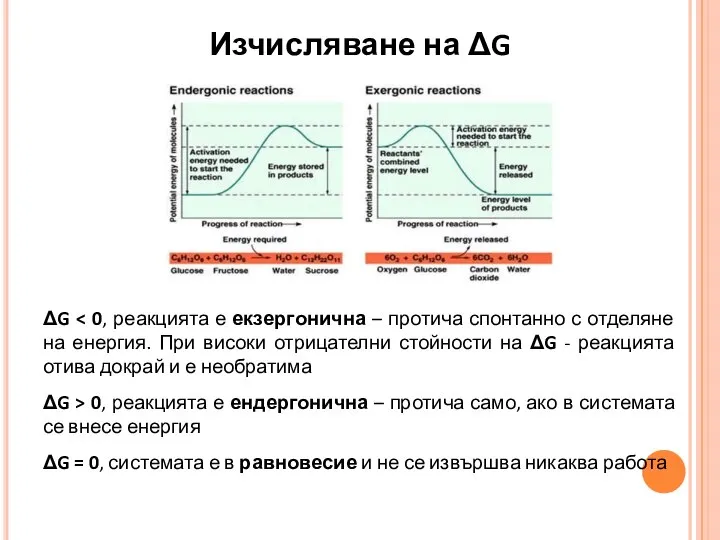
- 5. Изчисляване на ΔG ΔG ΔG > 0, реакцията е ендергонична – протича само, ако в системата
- 6. ИЗПОЛЗВАЕМА ЕНЕРГИЯ Източник на енергия за човека и животните - само химическата енергия, отделяна при разграждане
- 7. Стационарно състояние и термодинамично равновесие Химичните реакции в отворените системи: рядко до равновесно състояние еднопосочно продуктите
- 8. Спрягане на екзергонични и ендергонични реакции Доставящи енергия - окислителни, катаболитни и екзергонични пр. гликолиза, β-окисление
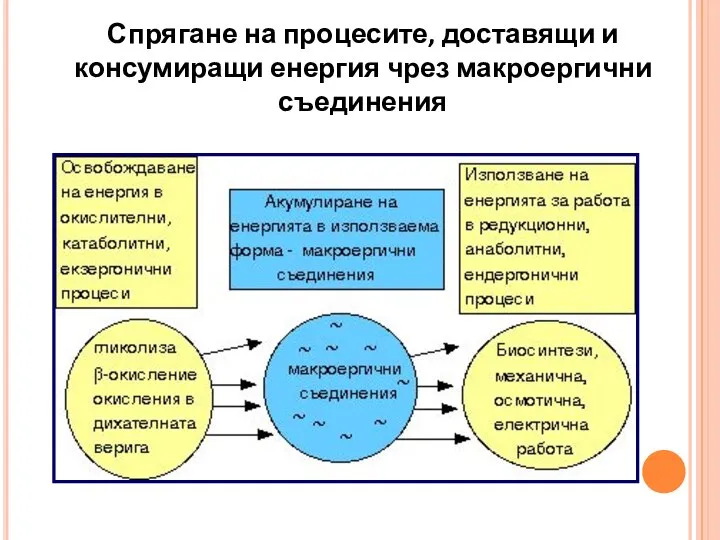
- 9. Спрягане на процесите, доставящи и консумиращи енергия чрез макроергични съединения
- 10. Едновременно или последователно протичане с общ метаболит – енергия за протичането на ендергоничната реакция: Ендергонична реакция
- 11. Макроергични съединения Макроергични връзки: при хидролитно разграждане ΔG°' ≥ 30 кJ/mol (до 70 кJ/mol) обикновени ковалентни
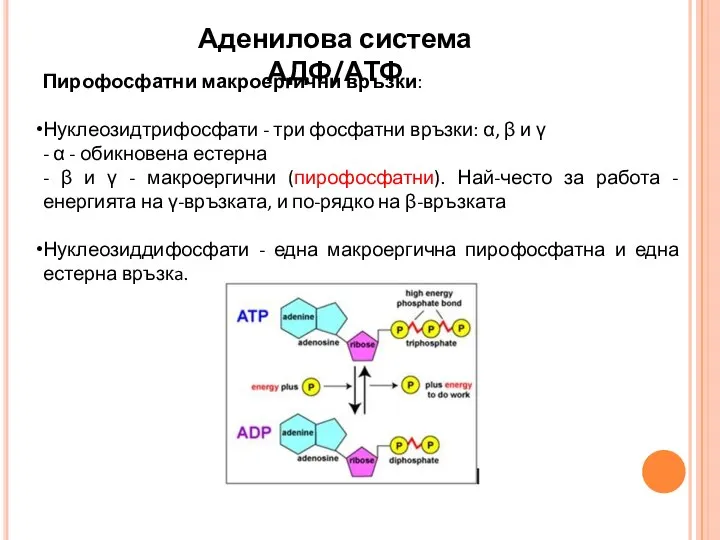
- 12. Пирофосфатни макроергични връзки: Нуклеозидтрифосфати - три фосфатни връзки: α, β и γ - α - обикновена
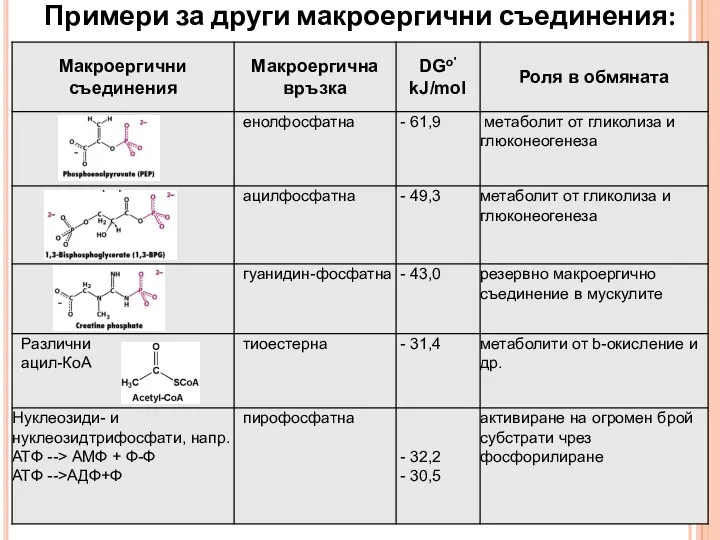
- 13. Примери за други макроергични съединения:
- 14. Различни енергетични нива на фосфорната киселина в организма нулево енергетично ниво - свободната фосфорна киселина нормално
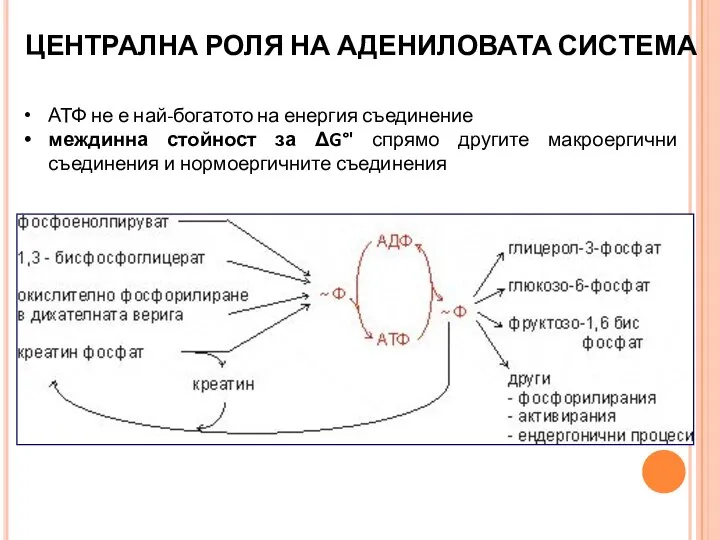
- 15. ЦЕНТРАЛНА РОЛЯ НА АДЕНИЛОВАТА СИСТЕМА АТФ не е най-богатото на енергия съединение междинна стойност за ΔG°'
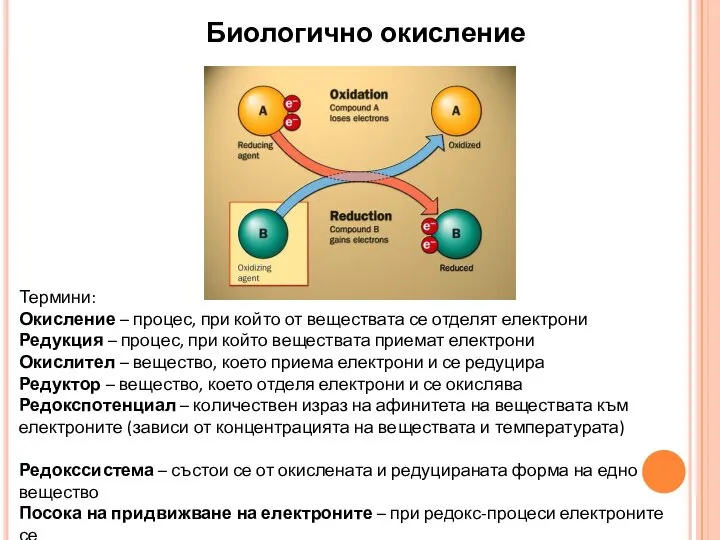
- 16. Биологично окисление Термини: Окисление – процес, при който от веществата се отделят електрони Редукция – процес,
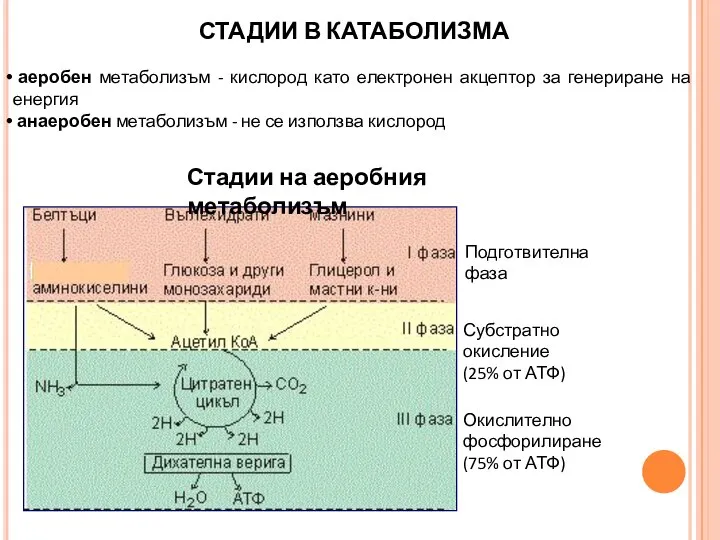
- 17. СТАДИИ В КАТАБОЛИЗМА аеробен метаболизъм - кислород като електронен акцептор за генериране на енергия анаеробен метаболизъм
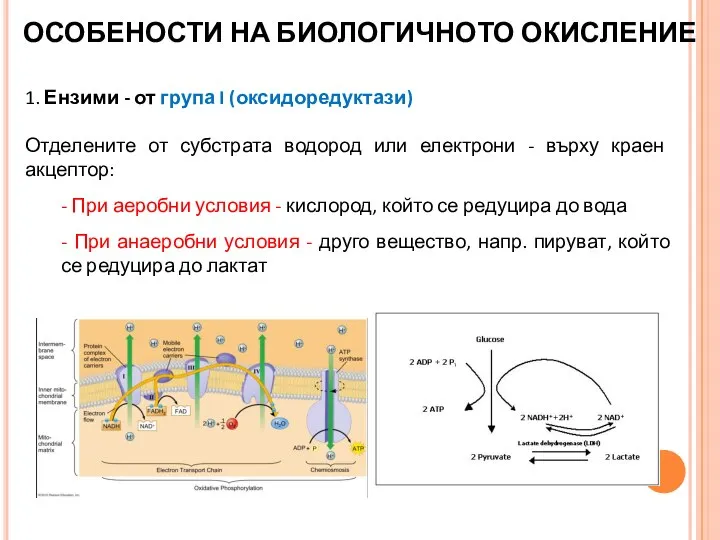
- 18. ОСОБЕНОСТИ НА БИОЛОГИЧНОТО ОКИСЛЕНИЕ 1. Ензими - от група I (оксидоредуктази) Отделените от субстрата водород или
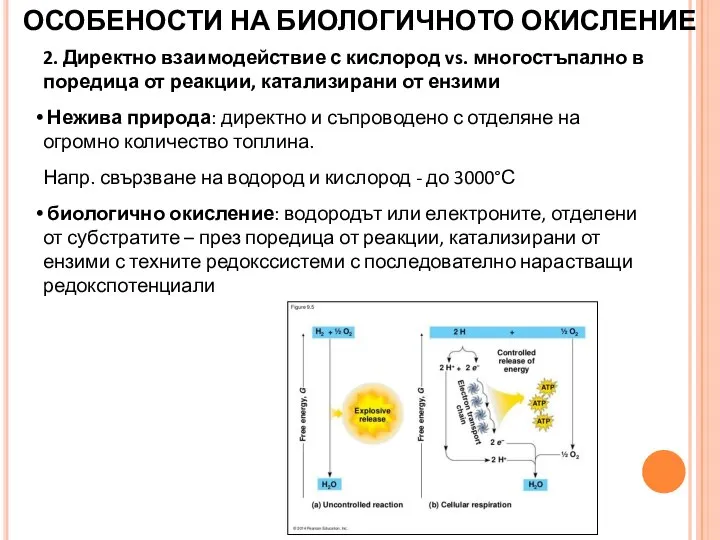
- 19. 2. Директно взаимодействие с кислород vs. многостъпално в поредица от реакции, катализирани от ензими Нежива природа:
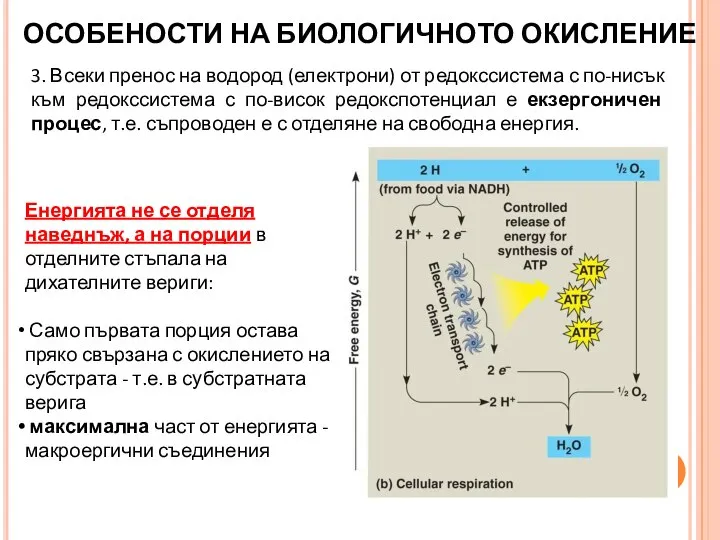
- 20. 3. Всеки пренос на водород (електрони) от редокссистема с по-нисък към редокссистема с по-висок редокспотенциал е
- 21. ОКСИДОРЕДУКТАЗИ (ЕНЗИМИ, ОСЪЩЕСТВЯВАЩИ БИОЛОГИЧНО ОКИСЛЕНИЕ) Дехидрогенази анаеробни, т. е. не могат да използват кислород като акцептор
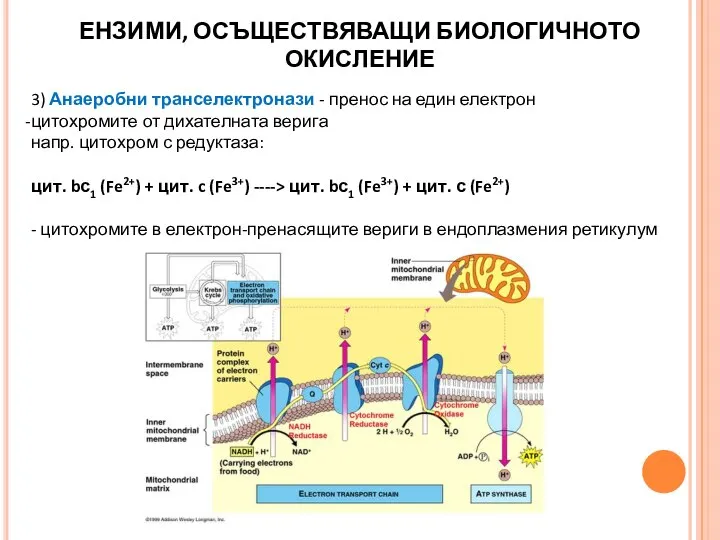
- 22. 3) Анаеробни транселектронази - пренос на един електрон цитохромите от дихателната верига напр. цитохром с редуктаза:
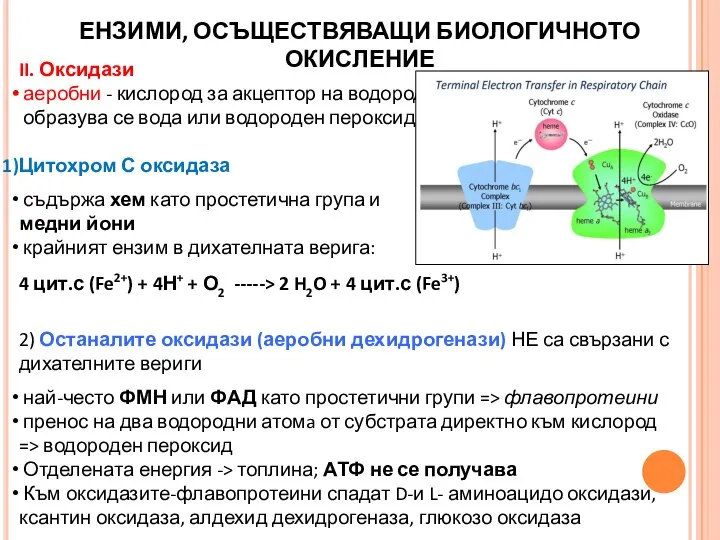
- 23. II. Оксидази аеробни - кислород за акцептор на водород, образува се вода или водороден пероксид Цитохром
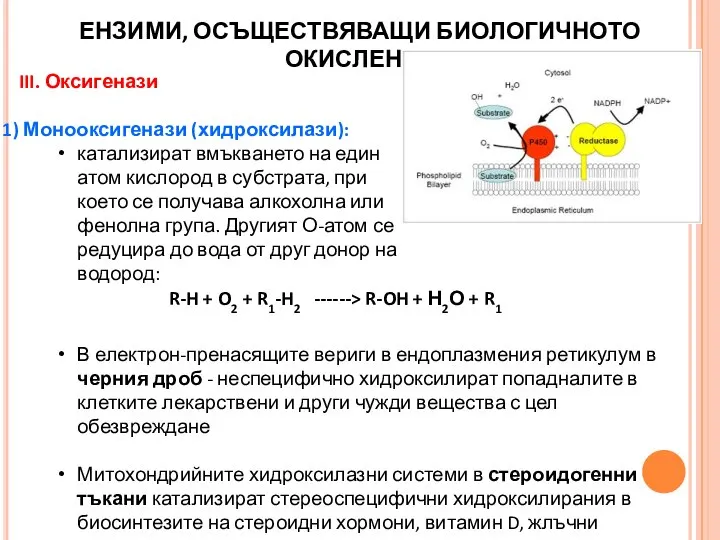
- 24. III. Оксигенази Монооксигенази (хидроксилази): катализират вмъкването на един атом кислород в субстрата, при което се получава
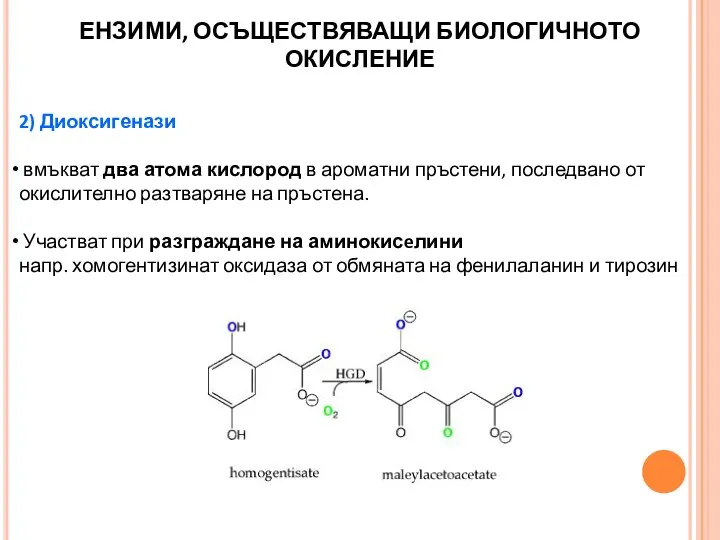
- 25. 2) Диоксигенази вмъкват два атома кислород в ароматни пръстени, последвано от окислително разтваряне на пръстена. Участват
- 26. IV. Хидроксипероксидази разграждане на вредните за организма пероксиди и получаващите се от тях свободни радикали 1)
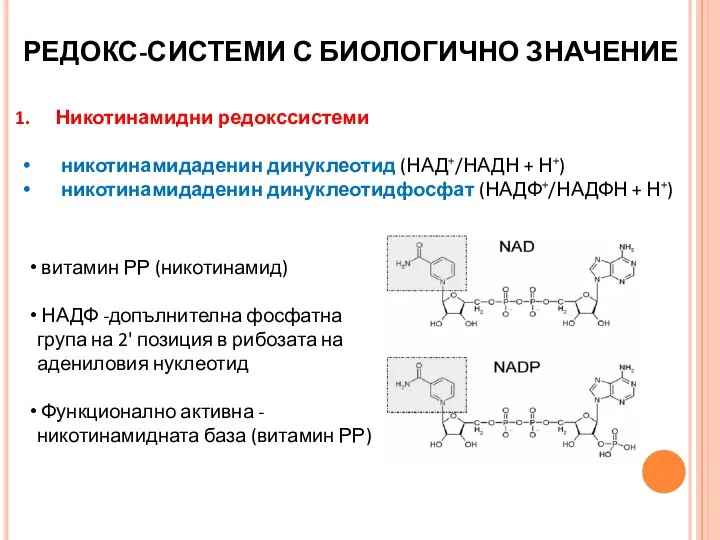
- 27. РЕДОКС-СИСТЕМИ С БИОЛОГИЧНО ЗНАЧЕНИЕ Никотинамидни редокссистеми никотинамидаденин динуклеотид (НАД+/НАДН + Н+) никотинамидаденин динуклеотидфосфат (НАДФ+/НАДФН + Н+)
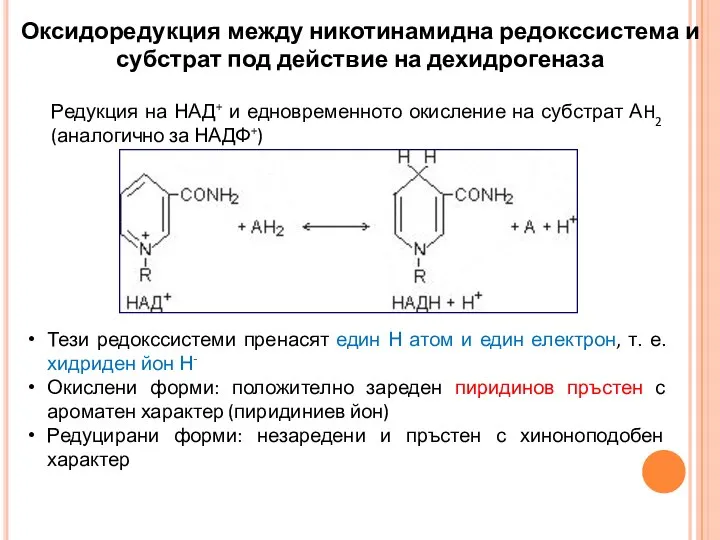
- 28. Тези редокссистеми пренасят един Н атом и един електрон, т. е. хидриден йон Н- Окислени форми:
- 29. Никотинамидните редокссистеми: близка структура, много близък, при това нисък нормален редокспотенциал (по-нисък от на флавиновите) =>
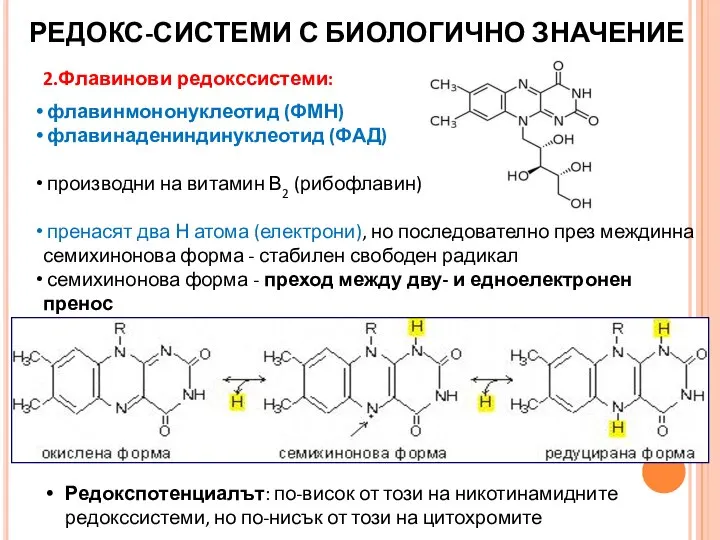
- 30. 2.Флавинови редокссистеми: флавинмононуклеотид (ФМН) флавинадениндинуклеотид (ФАД) производни на витамин В2 (рибофлавин) пренасят два Н атома (електрони),
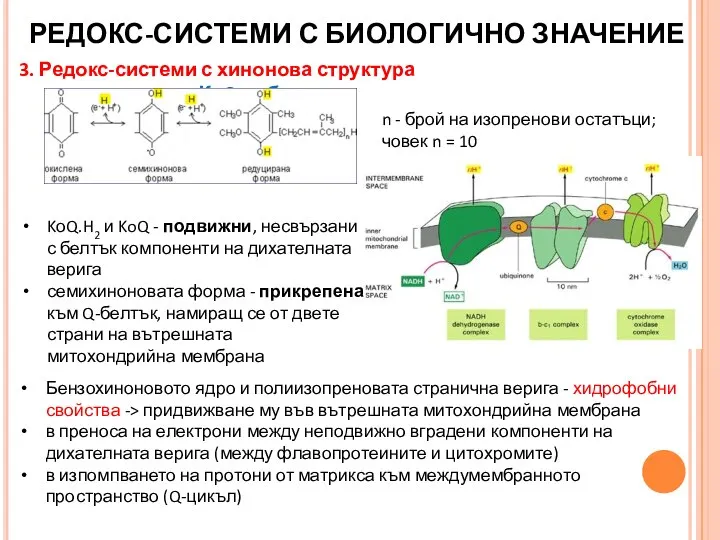
- 31. 3. Редокс-системи с хинонова структура КоQ – убихинон РЕДОКС-СИСТЕМИ С БИОЛОГИЧНО ЗНАЧЕНИЕ KоQ.H2 и KoQ -
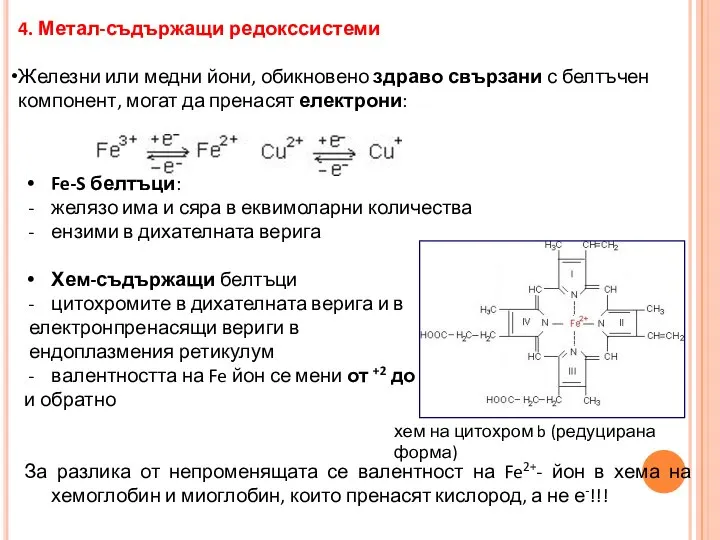
- 32. 4. Метал-съдържащи редокссистеми Железни или медни йони, обикновено здраво свързани с белтъчен компонент, могат да пренасят
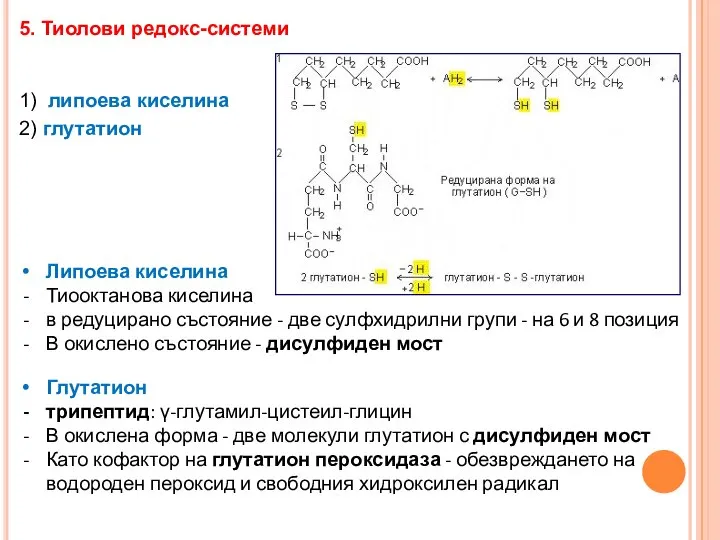
- 33. 5. Тиолови редокс-системи 1) липоева киселина 2) глутатион Липоева киселина Тиооктанова киселина в редуцирано състояние -
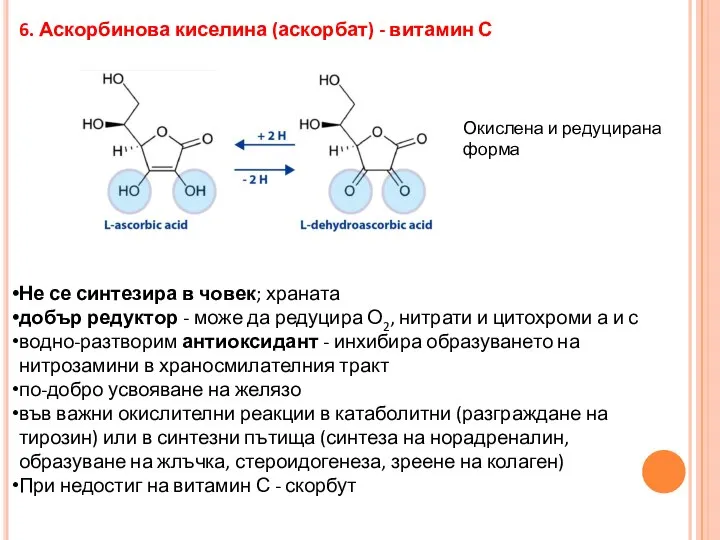
- 34. 6. Аскорбинова киселина (аскорбат) - витамин С Не се синтезира в човек; храната добър редуктор -
- 35. СУБСТРАТНО ОКИСЛЕНИЕ едностъпално анаеробно дехидрогениране на стотици различни субстрати под действие на специфични дехидрогенази, кооперирани най-често
- 36. ОКИСЛИТЕЛНО ФОСФОРИЛИРАНЕ НА СУБСТРАТНО НИВО Синтезата на АТФ или други макроергични съединения за сметка на енергия,
- 37. Скромен количествен принос, но има значение, тъй като: В условията на кислородна недостатъчност - единствен източник
- 39. Скачать презентацию















 Переваривание и всасывание в тонком и толстом кишечнике. Роль поджелудочной железы и печени
Переваривание и всасывание в тонком и толстом кишечнике. Роль поджелудочной железы и печени Физическое развитие, индивидуальные особенности внешнего облика в подростковый период. Различия в развитии мальчиков и девочек
Физическое развитие, индивидуальные особенности внешнего облика в подростковый период. Различия в развитии мальчиков и девочек Клеточный уровень организации. Строение клетки
Клеточный уровень организации. Строение клетки Урбопопуляции птиц и животных
Урбопопуляции птиц и животных Рыжий муравей
Рыжий муравей Берёза. Что такое берёза
Берёза. Что такое берёза Анализаторы
Анализаторы Нервно-мышечный аппарат
Нервно-мышечный аппарат Механизмы нервной и гуморальной регуляции сна
Механизмы нервной и гуморальной регуляции сна Науки, изучающие организм человека
Науки, изучающие организм человека Археи. Общие особенности, экология, эволюционное значение
Археи. Общие особенности, экология, эволюционное значение Волшебный цветок
Волшебный цветок Анализаторы сенсорной системы. Кроссворд
Анализаторы сенсорной системы. Кроссворд Класс Рептилии. Отряды Крокодилы, Черепахи
Класс Рептилии. Отряды Крокодилы, Черепахи Химический состав и организация растительных гидробионтов
Химический состав и организация растительных гидробионтов Ч. Дарвин об эволюции органического мира
Ч. Дарвин об эволюции органического мира Развитие органического мира
Развитие органического мира Опорно-двигательный аппарат человека
Опорно-двигательный аппарат человека Открытия в области биотехнологии
Открытия в области биотехнологии Морфофункциональная функция аппарата крово - лимфообращения
Морфофункциональная функция аппарата крово - лимфообращения Evolution & other sciences
Evolution & other sciences Популяционно-видовой уровень: общая характеристика
Популяционно-видовой уровень: общая характеристика Красная книга Республики Беларусь
Красная книга Республики Беларусь 1 апреля Международный день птиц
1 апреля Международный день птиц Производственная структура питомника
Производственная структура питомника Викторина Чудесница - природа
Викторина Чудесница - природа Комнатные растения
Комнатные растения Жизнь растений. Фотосинтез. 6 класс
Жизнь растений. Фотосинтез. 6 класс