Содержание
- 2. Цель работы: Изучить глобальные биогеохимические циклы ионов металлов и их влияние на жизнедеятельность организмов Задачи работы:
- 3. Актуальность данной работы Одним из сильнейших по действию и наиболее распространенным химическим загрязнением является загрязнение тяжелыми
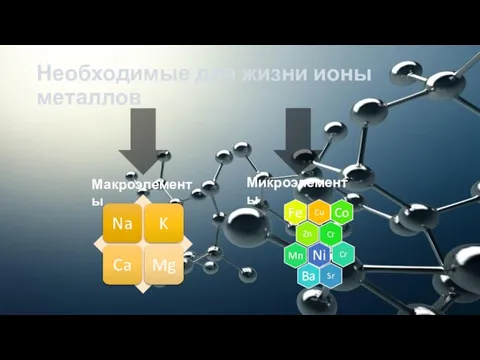
- 4. Необходимые для жизни ионы металлов Макроэлементы Микроэлементы
- 5. Калий Функции в организме: регулирует водно-солевой обмен поддерживает нормальную работу мышечной системы регулирует водный баланс важен
- 6. Натрий Функции в организме: С помощью разности концентрации натрия генерируются электрические сигналы – основа нервной системы.
- 7. Магний Функции в организме: Участвует в обмене углеводов и белков и энергией между клетками. Улучшает работу
- 8. Кальций Функции в организме: Служит основой для построения костей, зубов, волос. Необходим в нейронных и мышечных
- 9. В таблице представлены характерные симптомы дефицита химических элементов в организме человека
- 10. К чему ведет избыток микроэлементов в организме
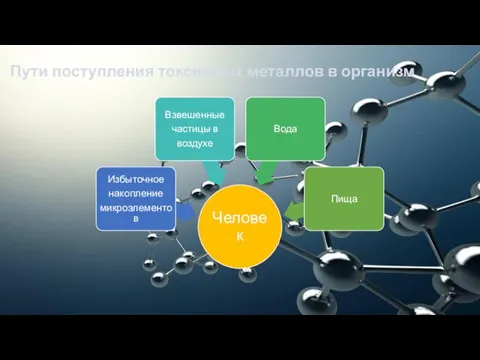
- 11. Пути поступления токсичных металлов в организм
- 12. Наиболее опасные токсичные металлы Ртуть (Hg) — высокотоксичный, кумулятивный (т. е. способный накапливаться в организме) яд.
- 13. Наиболее опасные токсичные металлы 2. Свинец (Pb) является одним из весьма распространенных в окружающей среде токсичных
- 14. Наиболее опасные токсичные металлы Кадмий (Cd) — элемент высокой токсичности. Поражает: процессы поглощения аминокислот, фосфора и
- 15. Наиболее опасные токсичные металлы Таллий (Tl) — очень токсичный металл. Из-за высокой токсичности получил прозвище «химический
- 16. ЗАГРЯЗНЕНИЕ ЭКОСИСТЕМ ТОКСИЧНЫМИ МЕТАЛЛАМИ
- 17. Загрязнение водного пространства тяжелыми металлами Тяжелые металлы и их соли — широко распространенные промышленные загрязнители. В
- 18. Выявление тяжелых металлов в водной среде В настоящее время существуют две основные группы аналитических методов для
- 19. Определения содержания тяжёлых металлов электрохимическими методами Электрохимические методы полярографический потенциометрический кулонометрический кондуктометрическим
- 20. Загрязнение почвенного покрова тяжелыми металлами Наиболее часто в нарушении равновесно состоянию почвы повинен человек: Атмосферный перенос
- 21. Выявление тяжелых металлов в почве Определение тяжелых металлов в первую очередь проводят: В почвах, расположенных в
- 22. Загрязнение атмосферы тяжелыми металлами Часть техногенных выбросов тяжелых металлов, поступающих в атмосферу в виде аэрозолей, переносится
- 23. Попадание ртути в экосистемы Гидросфера: Первоначально ртуть попадает в океан в виде Нg2+, затем она взаимодействует
- 24. Попадание свинца в экосистемы При добыче и переработке свинцовых руд теряется более 20 % свинца. Наиболее
- 25. Попадание кадмия в экосистемы Атмосфера: Около 1 млн. кг кадмия попадает в атмосферу ежегодно в результате
- 26. БИОГЕОХИМИЧЕСКИЕ ЦИКЛЫ ИОНОВ МЕТАЛЛОВ
- 27. Биогеохимические циклы калия В биологический круговорот на суше вовлекается ежегодно около 1,8х109 тонн калия. Освобождающаяся из
- 28. Биогеохимические циклы натрия В условиях влажного климата натрий легко выходит из биологического круговорота и выносится с
- 29. Биогеохимические циклы кальция В геохимических процессах выступает как двухзарядный катион Са+2. В аридном климате кальций легко
- 30. Биогеохимические циклы алюминия, железа и марганца Известно, что соединения алюминия, железа и марганца в почвах с
- 31. Задача людей состоит не только в том, чтобы защитить свой организм от негативного влияния токсичных металлов,
- 33. Скачать презентацию




























 Генетический код
Генетический код Костно - мышечная система
Костно - мышечная система Дыхательная система
Дыхательная система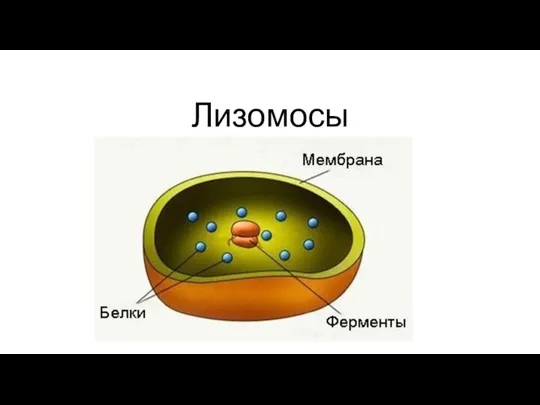 Лизомосы. Функции
Лизомосы. Функции Паразитизм – это вторичное явление
Паразитизм – это вторичное явление История появления и сущность ГМО;
История появления и сущность ГМО; Двомембранні органели
Двомембранні органели Увидеть невидимое
Увидеть невидимое Тромбоэмболия легочной артерии к.м.н. М. Мукаров АО «Национальный научный кардиохирургический центр
Тромбоэмболия легочной артерии к.м.н. М. Мукаров АО «Национальный научный кардиохирургический центр Snow barran South Yakut population
Snow barran South Yakut population Сорго. Значение и использование
Сорго. Значение и использование Обмен нуклеопротеинов
Обмен нуклеопротеинов Интерактивный чайнворд по теме: Кровь
Интерактивный чайнворд по теме: Кровь Ара. Ара пайдалану
Ара. Ара пайдалану Конструктивно- анатомическое строение фигуры человека
Конструктивно- анатомическое строение фигуры человека Генеалогический метод. Родословные. 9 класс
Генеалогический метод. Родословные. 9 класс Животный мир Псковской области
Животный мир Псковской области Спілкування тварин
Спілкування тварин Мейоз
Мейоз Хвойные и лиственные деревья
Хвойные и лиственные деревья Трансформация энергии на биомембранах
Трансформация энергии на биомембранах Шмель пахучий (шмель степной, исполинский)
Шмель пахучий (шмель степной, исполинский) Бесхвостые земноводные
Бесхвостые земноводные Тип Хордовые
Тип Хордовые Отряд пингвинообразные
Отряд пингвинообразные Клеточное строение организмов как доказательство их родства, единства живой природы
Клеточное строение организмов как доказательство их родства, единства живой природы Нуклеиновые кислоты
Нуклеиновые кислоты Усатая пирарара
Усатая пирарара