Содержание
- 2. Процессинг иРНК – процесс созревания зрелой иРНК 5’ 3’ Кэпирование Присоединение полиаденилового «хвоста» Вырезание интронов Сплайсинг
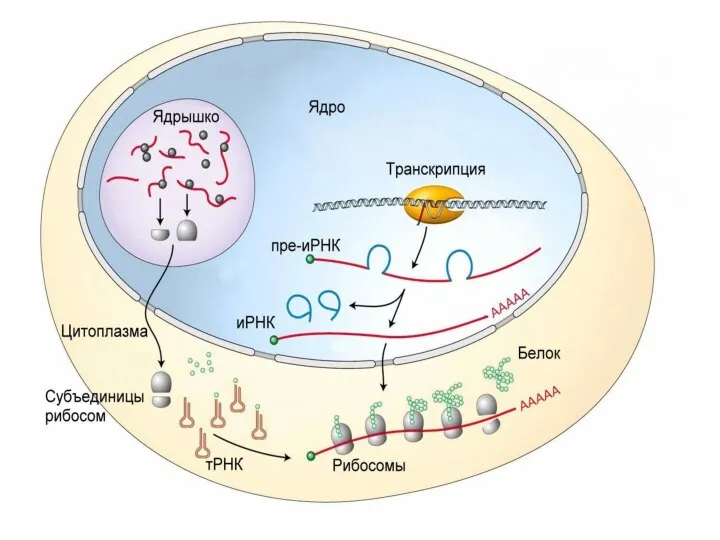
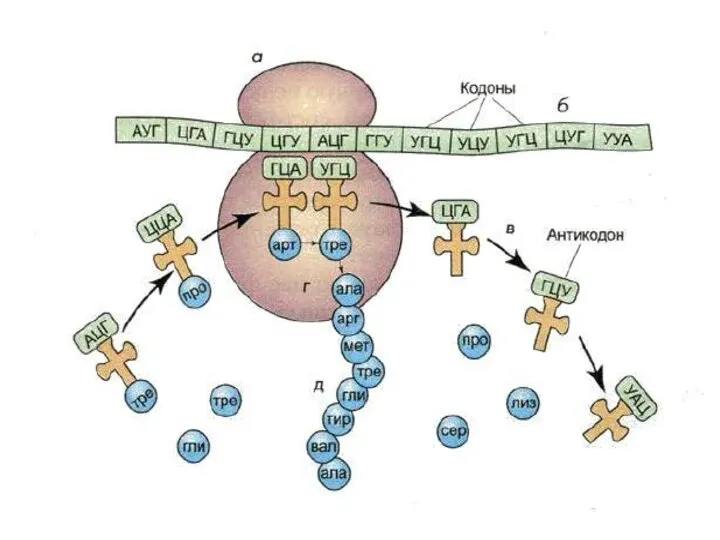
- 3. Трансляция – это синтез белковой молекулы (полипептида) на матрице и-РНК. Проходит в цитоплазме клетки или на
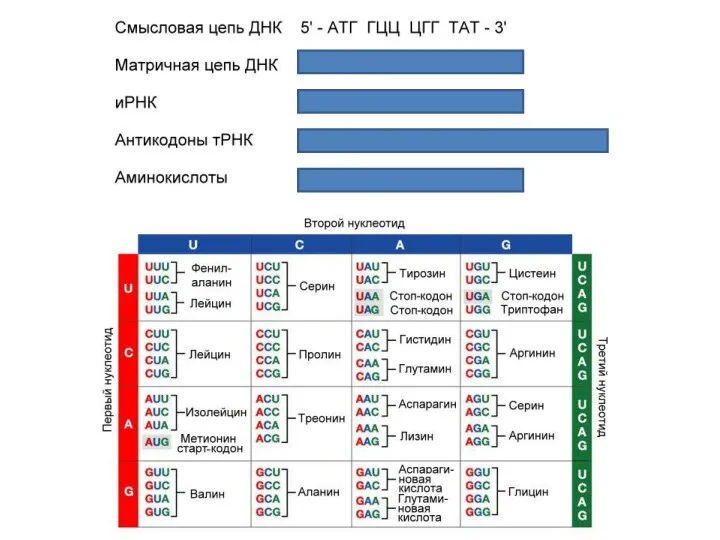
- 5. Для трансляции необходимы: 1. иРНК, кодирующая последовательность аминокислот в полипептиде; 2. рибосомы, образующие полипептид; 3. тРНК,
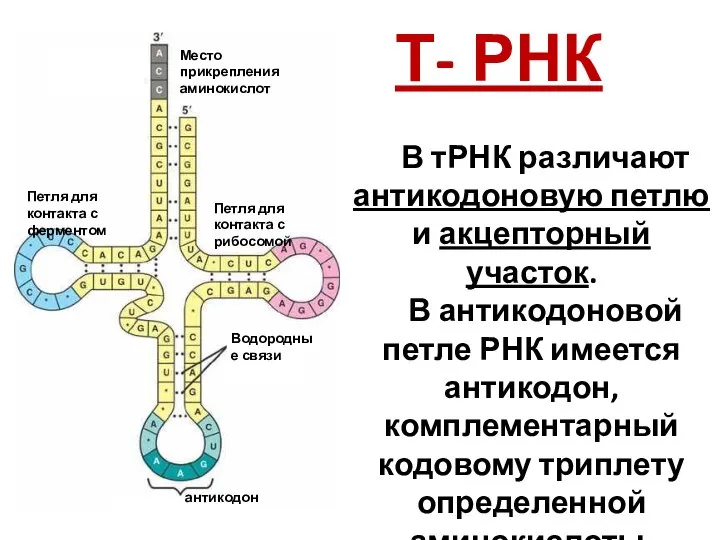
- 6. Т- РНК В тРНК различают антикодоновую петлю и акцепторный участок. В антикодоновой петле РНК имеется антикодон,
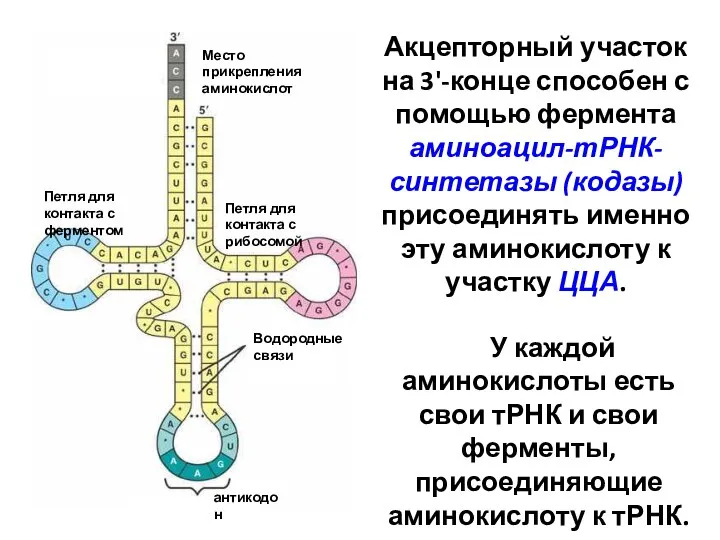
- 7. Акцепторный участок на 3'-конце способен с помощью фермента аминоацил-тРНК-синтетазы (кодазы) присоединять именно эту аминокислоту к участку
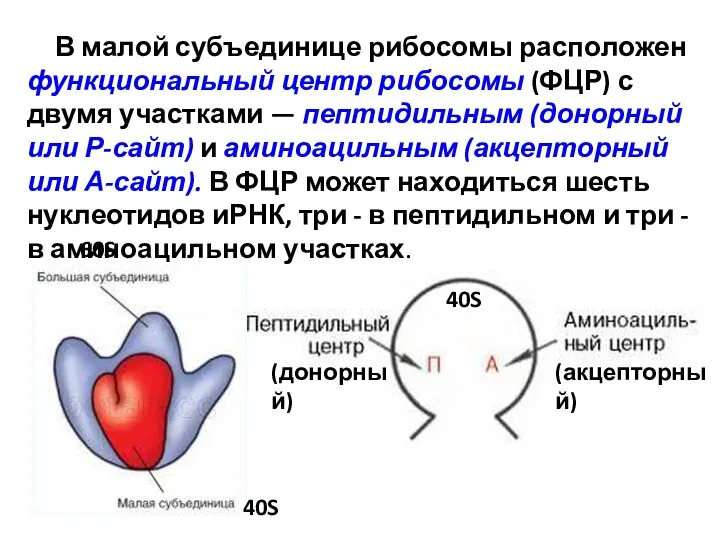
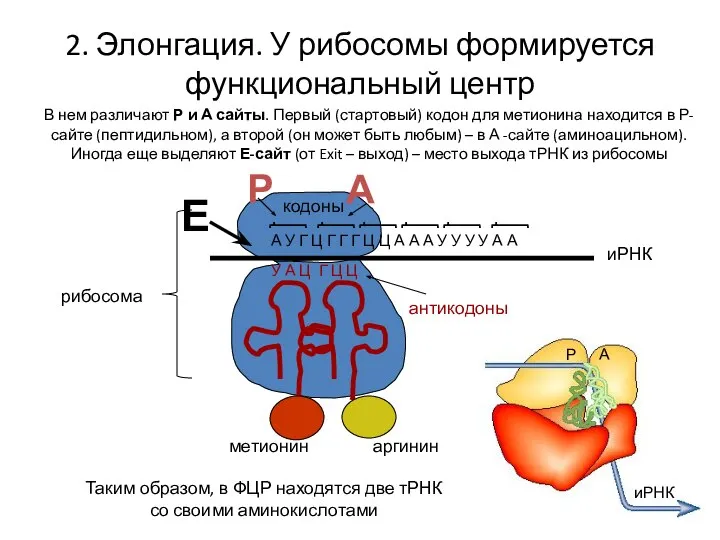
- 8. В малой субъединице рибосомы расположен функциональный центр рибосомы (ФЦР) с двумя участками — пептидильным (донорный или
- 10. Различают три этапа в трансляции: Инициация. Синтез белка начинается с того момента, когда к 5'-концу иРНК
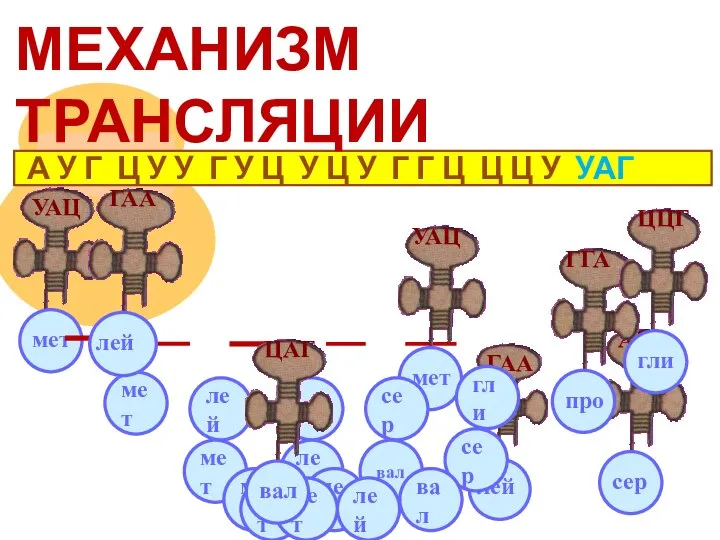
- 11. А У Г Ц У У Г У Ц У Ц У Г Г Ц Ц
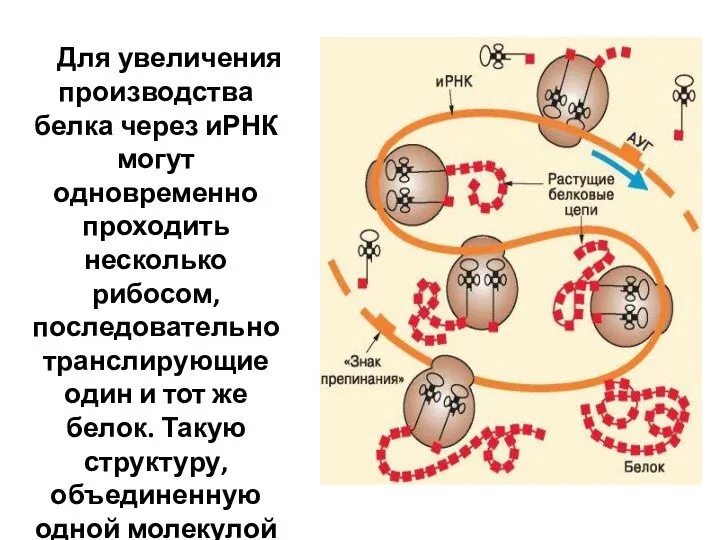
- 12. Для увеличения производства белка через иРНК могут одновременно проходить несколько рибосом, последовательно транслирующие один и тот
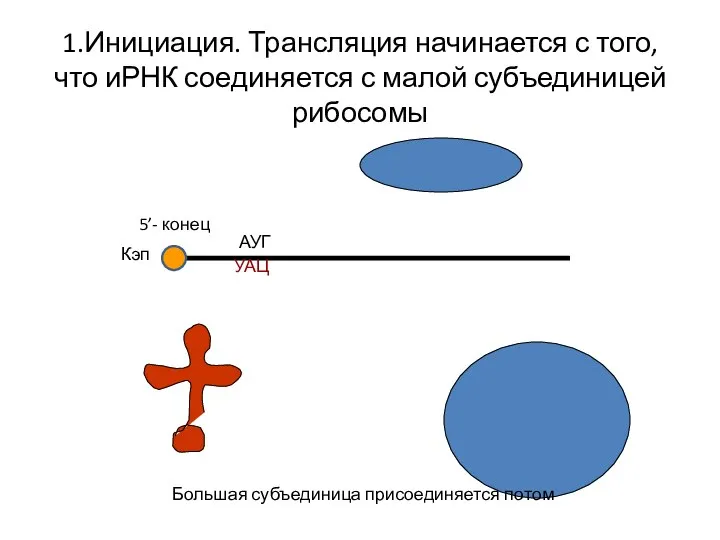
- 14. 1.Инициация. Трансляция начинается с того, что иРНК соединяется с малой субъединицей рибосомы АУГ УАЦ Большая субъединица
- 15. 2. Элонгация. У рибосомы формируется функциональный центр А У Г Ц Г Г Г Ц Ц
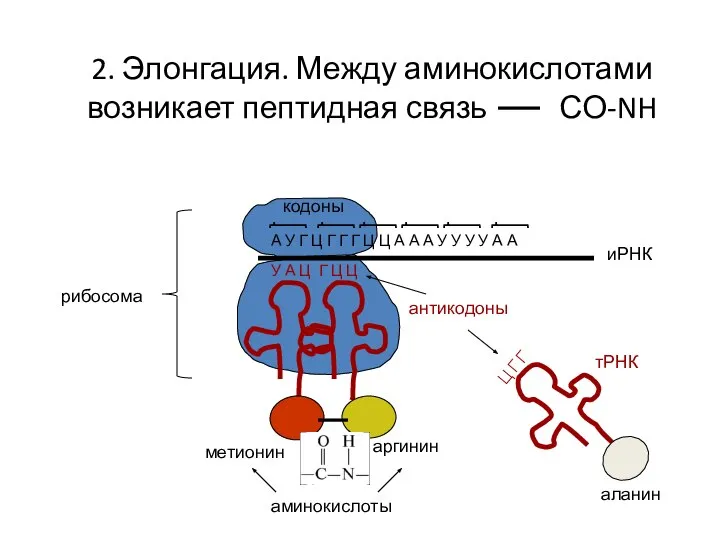
- 16. 2. Элонгация. Между аминокислотами возникает пептидная связь СО-NH А У Г Ц Г Г Г Ц
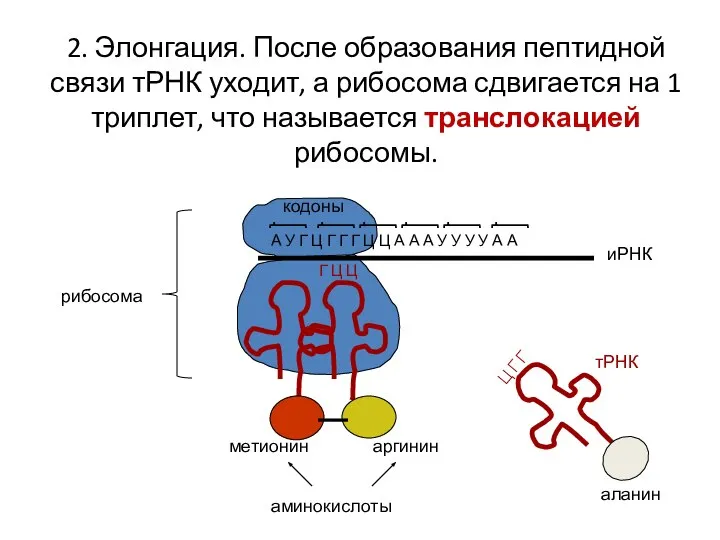
- 17. 2. Элонгация. После образования пептидной связи тРНК уходит, а рибосома сдвигается на 1 триплет, что называется
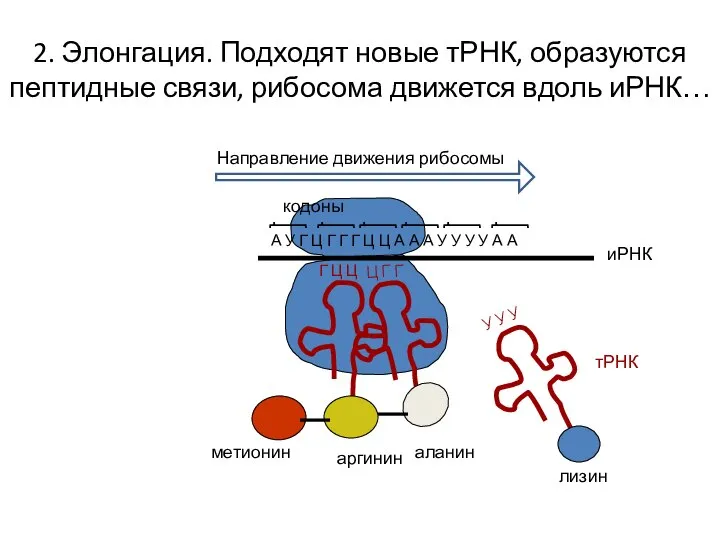
- 18. 2. Элонгация. Подходят новые тРНК, образуются пептидные связи, рибосома движется вдоль иРНК… А У Г Ц
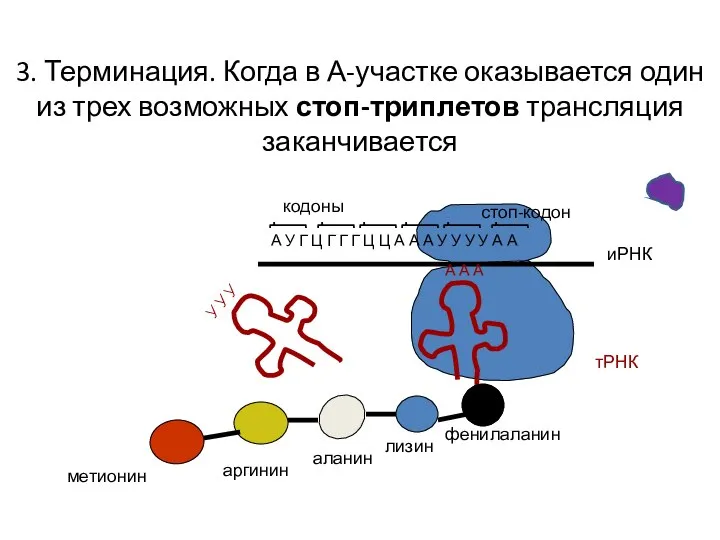
- 19. 3. Терминация. Когда в А-участке оказывается один из трех возможных стоп-триплетов трансляция заканчивается А У Г
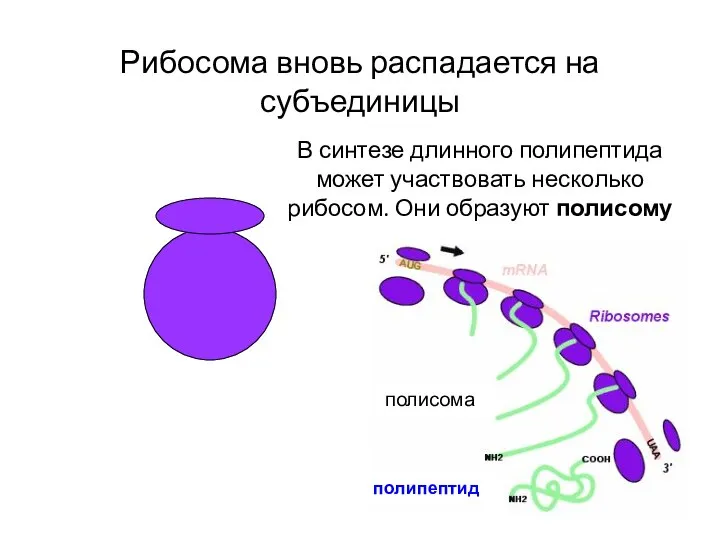
- 20. Рибосома вновь распадается на субъединицы В синтезе длинного полипептида может участвовать несколько рибосом. Они образуют полисому
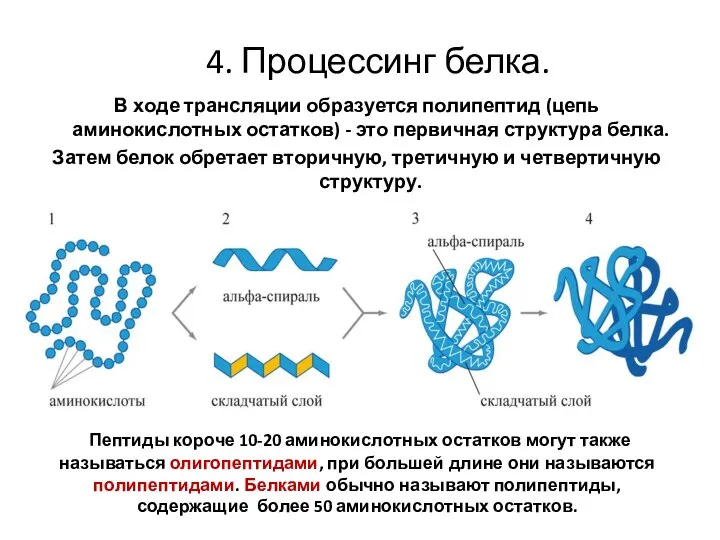
- 21. 4. Процессинг белка. В ходе трансляции образуется полипептид (цепь аминокислотных остатков) - это первичная структура белка.
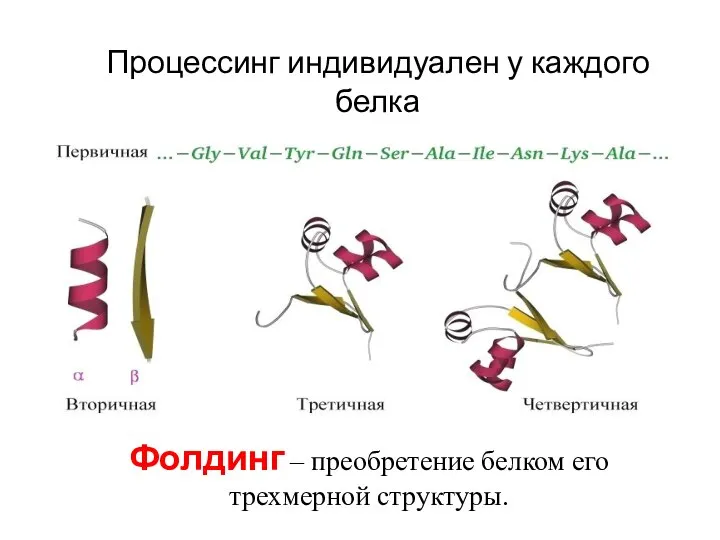
- 22. Процессинг индивидуален у каждого белка Фолдинг – преобретение белком его трехмерной структуры.
- 23. К основным реакциям процессинга белков относятся: 1. Удаление с N-конца метионина или даже нескольких аминокислот. 2.
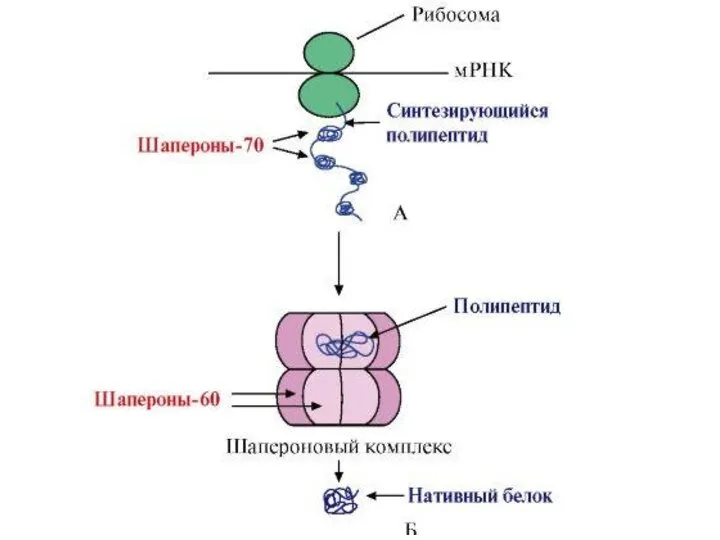
- 24. Фолдинг белков Фолдинг – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную структуру. Для обеспечения
- 28. Скачать презентацию






 Нервная система. Функции нервной системы
Нервная система. Функции нервной системы Биополимеры: липиды. Их роль в жизнедеятельности клетки
Биополимеры: липиды. Их роль в жизнедеятельности клетки Кто в Байкале воду очищает
Кто в Байкале воду очищает Ретикулярная формация
Ретикулярная формация Презентация на тему Зоны корня. Корень – орган минерального питания растений
Презентация на тему Зоны корня. Корень – орган минерального питания растений  Рыбы
Рыбы Введение в аквариумистику. Рыбки в аквариумах
Введение в аквариумистику. Рыбки в аквариумах Лекарственные растения
Лекарственные растения Мембрана и органоиды клетки (1)
Мембрана и органоиды клетки (1) Собака
Собака методы иссл
методы иссл Путешествие Орлаши
Путешествие Орлаши Les maîtres du déguisement
Les maîtres du déguisement Гусеобразные Мелеузовского района
Гусеобразные Мелеузовского района Энциклопедия леса. Деревья
Энциклопедия леса. Деревья Бурый медведь
Бурый медведь Бассет хаунд
Бассет хаунд Размножение
Размножение Сон - лучшее лекарство
Сон - лучшее лекарство Отдел плауновидные: особенности строения и размножения
Отдел плауновидные: особенности строения и размножения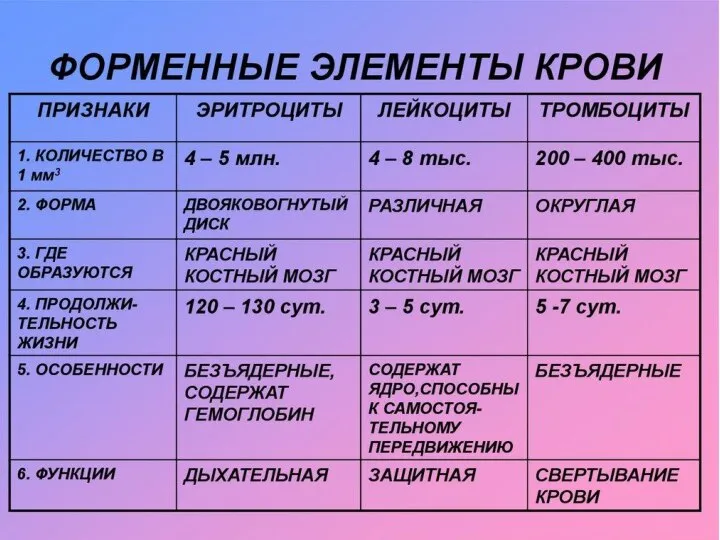 Форменные элементы крови
Форменные элементы крови Диагностика препаратов (снимки)
Диагностика препаратов (снимки) Мышечная и нервная ткани
Мышечная и нервная ткани 20150126_nauki_o_prirode
20150126_nauki_o_prirode Растительные ткани. Лекция 3
Растительные ткани. Лекция 3 Красная книга
Красная книга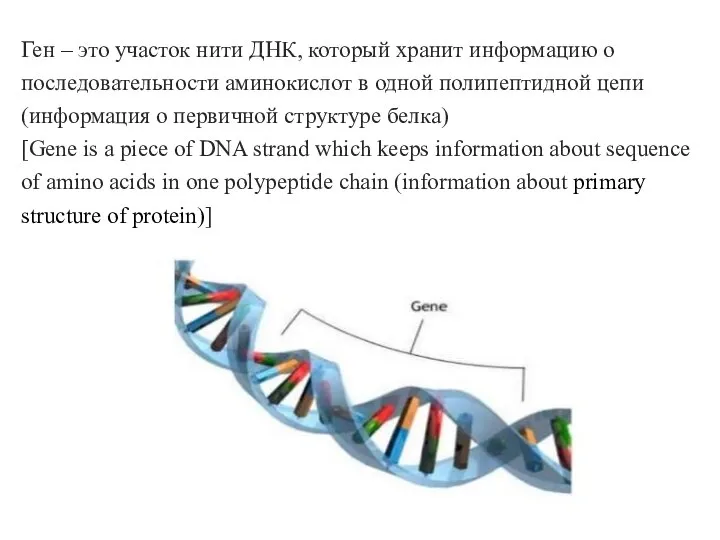 Биосинтез белков
Биосинтез белков Përçuarja e ujit nëpër bimë
Përçuarja e ujit nëpër bimë