Слайд 2ЭКОЛОГИЧЕСКАЯ ГЕНЕТИКА
-это отрасль знаний, исследующая взаимодействие экологических отношений и генетических процессов.
Она изучает

влияние различных экологических факторов на наследственность , устойчивость к заболеваниям, сопряженную эволюцию микро- и макроорганизмов, генетическую обусловленность накопление или выведение из организма вредных веществ, генетически детерминированные реакции на лекарственные препараты.
Будучи частью генетики, эта наука использует мощную методологию генетического анализа и включает все разнообразие методов экологии
Слайд 3Проблемы оценки генетического риска, обусловленного факторами окружающей среды, − важнейшая задача экогенетики.

Эти исследования сфокусированы на следующих вопросах:
-Каким образом данный фактор действует на генетический материал;
-Насколько широко подвергается популяция воздействию этого фактора;
-Каково вероятное увеличение частоты мутаций по сравнению с частотой спонтанных мутаций;
-Каковы долговременные последствия увеличения частоты мутаций для популяции.
Слайд 4НАПРАВЛЕНИЯ ЭКОГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ
Выделяют два основных направления экогенетических исследований:
Генетическая предопределенность экологических отношений.

Воздействие экологических факторов на генетические процессы (в первую очередь, мутагенез).
Слайд 5ПОДРАЗДЕЛЫ ЭКОГЕНЕТИКИ
-Разработка элементарных эколого-генетических моделей;
-Исследование биологических факторов изменчивости;
-Изучение устойчивости

организмов к абиотическим факторам окружающей среды;
-Генетическая токсикология, нацеленная на выявление генетически активных факторов среды и предотвращение их влияния, прежде всего на усугубление генетического груза
Слайд 6МЕТОДЫ ЭКОЛОГИЧЕСКОЙ ГЕНЕТИКИ
1.Генетические методы.
-Клинико-генеалогический. Составлении и анализе родословных, прослеживание болезни в

ряду поколений.
-Близнецовый. Сравнение однояйцевых близнецов с одинаковым генотипом позволяет судить об относительном значении наследственности и среды.
-Популяционно-статистический. Составление карт распространения генов, определяющих развитие нормальных признаков и наследственных болезней.
-Молекулярно-генетический. Анализ генов, что позволяет выявлять нарушения или мутации.
Слайд 72.Биохимические методы.
-Массовый биохимический скрининг. Взятие проб на исследование патологических процессов.
-Молекулярно-цитогенетический.

Количественное определение метаболитов, их кинетики и накопления
Слайд 8
3.Токсикологические методы
-Методы in chemico («в пробирке»). Исследование взаимодействия токсикантов при

их непосредственном контакте с белками, ДНК или РНК
-Клеточные тесты. Исследования на изолированных культурах клеток или тканей
-In vitro («в стекле»). Осуществляются вне живого организма с использованием модели культуры животного или человеческого происхождения.
4.Фармакологические методы
-Исследования лекарственных средств. Действие лекарств на человека
Слайд 9ЭКОГЕНЕТИЧЕСКИЕ БОЛЕЗНИ
Экогенетические реакции или болезни представляют собой патологические состояния, возникающие как результат

проявления конкретных аллелей гена или изменения экспрессии при влиянии на организм определенных факторов среды.
Экогенетические болезни могут быть обусловлены редкими мутантными аллелями генов или полиморфными системами. Могут контролироваться одним геном или несколькими. Соответственно характер распределения данных реакций в потомстве будет соответствовать моно или полигенным моделям наследования. В то же время для проявления патологического ответа необходимо воздействие конкретного средового фактора на данный индивид
Слайд 10ФАКТОРЫ ОКРУЖАЮЩЕЙ СРЕДЫ
При воздействии неблагоприятных факторов окружающей среды на человека могут наблюдаться
нежелательные эффекты в виде:
-Изменения наследственных структур (индуцированный мутационный процесс);
-Патологических проявлений экспрессии генов в ответ на специфические факторы среды;
-Изменений генофонда популяций в результате нарушения генетического равновесия между основными популяционными процессами (мутационным процессом, отбором, миграции, дрейфом генов).
Слайд 111.Физические.
Источник: Климат, Ультрафиолетовое излучение. Пример: Пигментная ксеродерма (1: 5–500 тысяч) аутосомно-рецессивного

типа наследования, высокая чувствительность кожи человека к действию солнечного света
2.Химические.
Источник: химические вещества. Пример: Недостаточность фермента — антитрипсина, мощного антипротеиназным фермента, участвующим в дезактивации эластаз, Наследственный дефицит этого фермента привод к разрушению межальвеолярных перегородок легких
3.Биологические.
Источник- Чужеродные и собственные измененные антигены. Пример: Гемоглобинопатия и энзимопатии
Слайд 12МЕТОДЫ ПРОФИЛАКТИКИ ЭКОГЕНЕТИЧЕСКИХ ЗАБОЛЕВАНИЙ
Профилактика направлена на создание оптимальной среды для каждого человека

(пища, лекарства, работа), чтобы исключить появление фактора, способного привести в действие механизм развития экогенетической болезни.
– Привести к минимуму вредные факторы.
– Лечение болезни на ранней стадии.
– Наличие генетической предрасположенности к определенному заболеванию может повлиять на схему лечения.
Слайд 13ФАРМАКОГЕНЕТИКА
— новое направление в клинической фармакологии, изучающее генетически детерминированные реакции больного человека

на лекарственные средства, имеющие существенное клиническое значение.
Это направление как раздел экологической медицинской генетики и клинической фармакологии зародилось в результате практической потребности разобраться в осложнениях лекарственного лечения. Клиническая фармакология накапливала наблюдения патологических реакций на лекарства, а медицинская генетика расшифровывала механизмы их возникновения.
Слайд 14РАЗВИТИЕ ФАРМОГЕНЕТИКИ
Основные положения фармакогенетики были сформулированы в 1950-1970 гг. Термин «фармакогенетика» был

введен в 1958 г. немецким ученым Ф. Фогелем. Развитие фармакогенетики основывалось на регистрации нежелательных лекарственных реакций с их анализом сначала клинико-генеалогическим и близнецовым методами, а в последующем - молекулярно-генетическим. При этом изучался не только конечный патологический фенотип, но и биохимические ступени метаболизма лекарства, что давало возможность понять сущность нежелательных лекарственных реакций и их ключевые точки.
Слайд 15ЗАДАЧИ ФАРМАКОГЕНЕТИКИ
-Определение роли наследственных факторов в формировании реакций организма на вводимые лекарства,

в том числе неблагоприятных реакций, нередко ведущих к тяжелым последствиям;
-Разработка эффективных мер их профилактики и лечения;
-Изыскание новых путей повышения эффективности фармакотерапии различных заболеваний, в том числе наследственных;
-Изучение сущности уже известных и вновь обнаруживаемых энзимопатий, при которых резко нарушается действие лекарственных средств;
-Разработка доступных методов выявления лиц — носителей атипичных ферментов, которые прямо или косвенно влияют ни фармакокинетику и фармакодинамику лекарств.
Слайд 16Важной проблемой клинической фармакогенетики является индивидуальная чувствительность людей к лекарственным средствам в

зависимости от генотипа. Известно, что больные в разной степени реагируют на лекарственные препараты. Специальные исследования показали, что индивидуальная чувствительность ко многим лекарствам колеблется.
В результате специально проведенных фармакологических исследований установлено, что ведущую роль в действии лекарственных веществ играют генетические факторы. Период полувыведения лекарств из плазмы колеблется у различных индивидов в больших пределах. Эти различия несколько меньше выражены у двуяйцевых близнецов одной и той же пары и практически отсутствуют у однояйцевых близнецов.
Слайд 17Существуют многочисленные доказательства того, что очень часто различия в чувствительности людей к
лекарствам связаны с неодинаковой интенсивностью их метаболизма из-за генетически обусловленных различий в активности ферментов, обеспечивающих этот процесс. При высокой активности ферментов метаболизм соответствующих лекарственных веществ происходит быстро, поэтому содержание их в крови, органах и тканях может не достигать терапевтического уровня, и наоборот. Наряду с этим могут иметь значение и генетические факторы, обеспечивающие всасывание и распределение лекарств в организме, как и чувствительность рецепторов органов-мишеней к ним.
Слайд 18Генетический полиморфизм определяет три главных фенотипа метаболизаторов (лиц, принимающих лекарства): экстенсивные, медленные

и быстрые.
Экстенсивные метаболизаторы - индивиды с нормальной скоростью метаболизма рассматриваемых лекарственных средств. К этой группе принадлежит большинство населения. Они являются чаще всего гомозиготами по «дикому» аллелю соответствующего фермента.
Медленные метаболизаторы (иногда нулевые) характеризуются сниженной скоростью метаболизма рассматриваемого лекарственного средства. С генетической точки зрения они являются гомозиготами (при аутосомно-рецессивном типе наследования) или гетерозиготами (при аутосомно-доминантном типе наследования) по мутантному аллелю соответствующего фермента. У таких лиц синтез фермента отсутствует или синтезируется неактивный («дефектный») фермент, в результате чего лекарственное средство накапливается в высоких концентрациях, что и приводит к появлению нежелательных побочных реакций. Отсюда ясно, что для медленных метаболизаторов доза лекарства должна быть меньшей или назначают другое лекарство.
Слайд 19Быстрые (или сверхактивные) метаболизаторы характеризуются повышенной скоростью метаболизма определенных лекарств. В основном это гомозиготы (при

аутосомно-рецессивном типе наследования) или гетерозиготы (при аутосомно-доминантном типе наследования) по «быстрому» аллелю соответствующего фермента. Достаточно часто встречаются индивиды с копиями функциональных аллелей, что также приводит к повышенному метаболизму лекарства. Быстрый метаболизм лекарства не позволяет при стандартных дозах достичь его терапевтической концентрации в крови, поэтому доза лекарства для быстрых метаболизаторов должна быть выше, чем для нормальных метаболизаторов.
Слайд 20Выяснение сущности индивидуальной чувствительности людей к лекарственным препаратам необходимо для определения оптимальных
доз любого лекарственного средства для каждого больного и составления индивидуальных программ высокоэффективной безопасной фармакотерапии.
Слайд 21ИММУНОГЕНЕТИКА
- это раздел иммунологии, который изучает генетическую обусловленность факторов иммунитета, внутривидовое разнообразие и наследование тканевых Аг (антигенов),
генетическое и популяционное взаимодействие макро- и микроорганизмов, тканевую несовместимость.
Слайд 22ЗАДАЧИ ИММУНОГЕНЕТИКИ
Наследственно детерминированные биологические системы, такие как иммуногенетические образования, в виде групп крови

и полиморфных белков крови и молока не изменяются в процессе онтогенеза и являются пожизненной генетической характеристикой каждой особи, необходимой для использования:
- определения отцовства у животных;
- зиготности у близнецов;
- фримартинизма у телочек;
- разнояйцовых близнецов;
- оценки производителей по качеству потомства;
- совместимости отцовских пар при чистопородном разведении;
- прогнозирования продуктивности животных;
- прогнозирования резистентности против заболеваний.
Слайд 23Биологическая сущность иммуногенетики заключается в том, что организм состоит в основном из
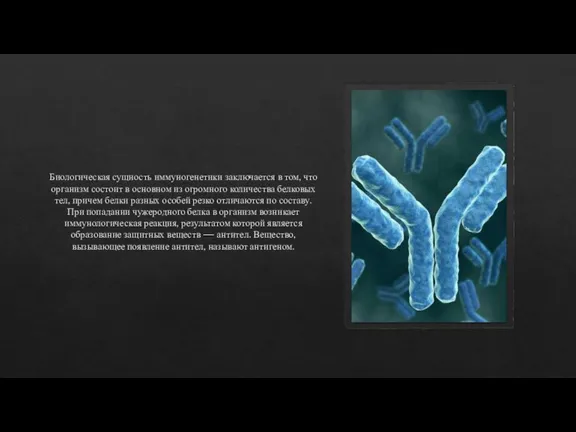
огромного количества белковых тел, причем белки разных особей резко отличаются по составу. При попадании чужеродного белка в организм возникает иммунологическая реакция, результатом которой является образование защитных веществ — антител. Вещество, вызывающее появление антител, называют антигеном.
Слайд 24ГЕННЕТИЧЕСКИЙ КОНТРОЛЬ ИММУНОГО ОТВЕТА
Генами иммунного ответа являются Ir-гены. При иммунизации инбредных линий мышей синтетическими

антигенами выявлены линии с сильным и слабым иммунным ответом. Анализ потомства от возвратного скрещивания дал основание сделать заключение, что высокое антителообразование кодируется одним доминантным геном, а низкая иммунная реакция – рецессивным. В дальнейшем было уточнено, что высота иммунного ответа детерминирована более чем одной парой генов. Локус, отвечающий за силу иммунного ответа, был обозначен как Ir =1 (иммунный ответ=1). Он оказался сцеплен с главным комплексом гистосовместимости Н-2. Этот локус обусловливает иммунный ответ к многим антигенам. Сейчас известно, что в области I комплекса Н-2 существует не один, а три локуса Ir(Ir-1А, Ir-1В, Ir-1С). Кроме этого, открыты Ir –гены, локализованные вне Н-2-комплекса. Это локусы Ir -2, Ir -4, а также локус Ir, сцепленный с полом. Во многих случаях иммунный ответ против антигенов наследуется полигенно.























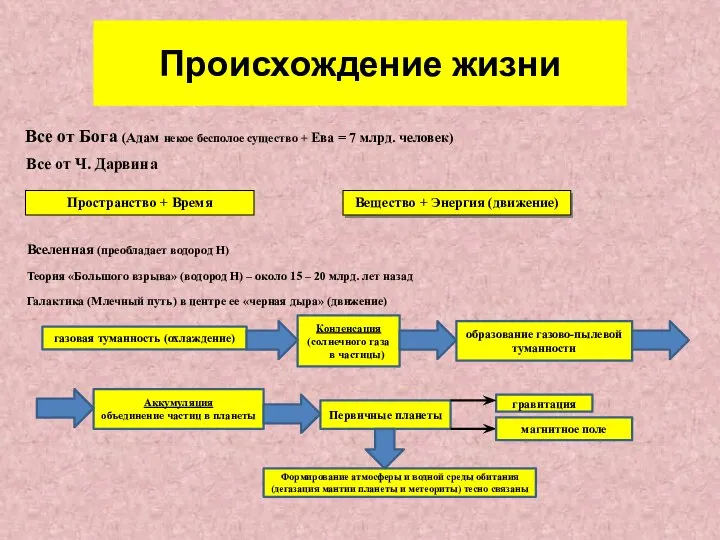 Происхождение жизни
Происхождение жизни Строение зародышевых оболочек рептилий и птиц
Строение зародышевых оболочек рептилий и птиц Владельческий менеджмент. Как собственнику отойти от оперативного управления с сохранением контроля над бизнесом
Владельческий менеджмент. Как собственнику отойти от оперативного управления с сохранением контроля над бизнесом Клумба школьного двора
Клумба школьного двора Задачи селекции. Методы селекции растений
Задачи селекции. Методы селекции растений Гаметогенез и дробление
Гаметогенез и дробление Презентация на тему Строение и жизнедеятельность бактерий
Презентация на тему Строение и жизнедеятельность бактерий  Строение стебля
Строение стебля Презентация на тему Опорно-двигательная система человека
Презентация на тему Опорно-двигательная система человека  Анатомия, физиология и гигиена сенсорных систем. Орган зрения
Анатомия, физиология и гигиена сенсорных систем. Орган зрения Инвазионная биология
Инвазионная биология Состав экосистемы. Консументы. Фитофаги
Состав экосистемы. Консументы. Фитофаги 4a3feaa551594845be7673ba53b03930
4a3feaa551594845be7673ba53b03930 Микроклимат
Микроклимат Презентация на тему Нужны ли минеральные соли животным и человеку (5 класс)
Презентация на тему Нужны ли минеральные соли животным и человеку (5 класс)  Глюкоза. Строение глюкозы
Глюкоза. Строение глюкозы Бельгийский тервюрен, процедура грумминга
Бельгийский тервюрен, процедура грумминга Сцепленное наследование. Генетический эффект кроссинговера
Сцепленное наследование. Генетический эффект кроссинговера Опорно-двигательный аппарат
Опорно-двигательный аппарат Питание растений и грибов
Питание растений и грибов Метаболизм и питание микроорганизмов
Метаболизм и питание микроорганизмов Жгутики. Структура, механизм их работы
Жгутики. Структура, механизм их работы Семейство лучеперых рыб из отряда
Семейство лучеперых рыб из отряда Рыба и рыбные товары
Рыба и рыбные товары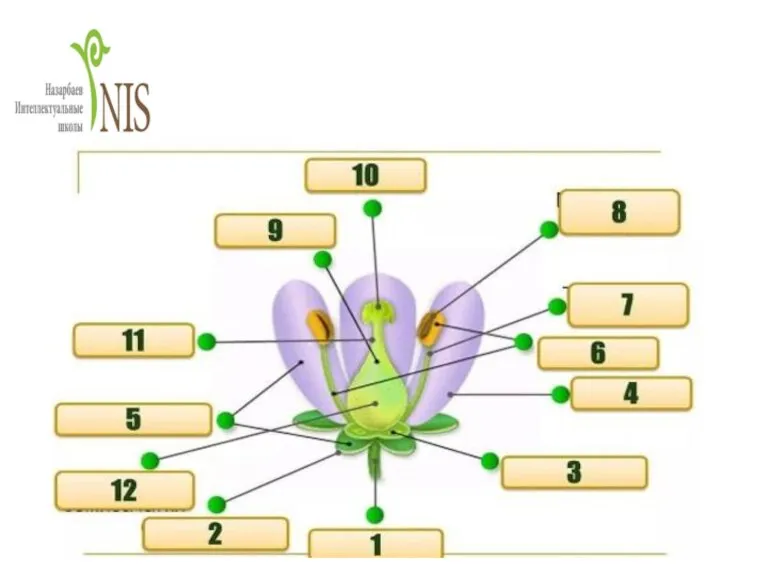 Строение цветка. Виды опыления. Цветение и опыление
Строение цветка. Виды опыления. Цветение и опыление Органы дыхания и газообмен
Органы дыхания и газообмен Яркая окраска у животных
Яркая окраска у животных Развитие биохимии и биофизики
Развитие биохимии и биофизики