Содержание
- 2. Общие свойства, механизм действия и классификация ферментов Ферменты - это биологические катализаторы белковой природы Активный центр
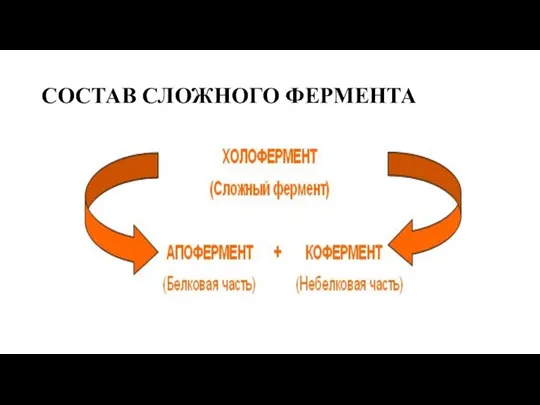
- 3. СОСТАВ СЛОЖНОГО ФЕРМЕНТА
- 4. СТРОЕНИЕ ФЕРМЕНТА
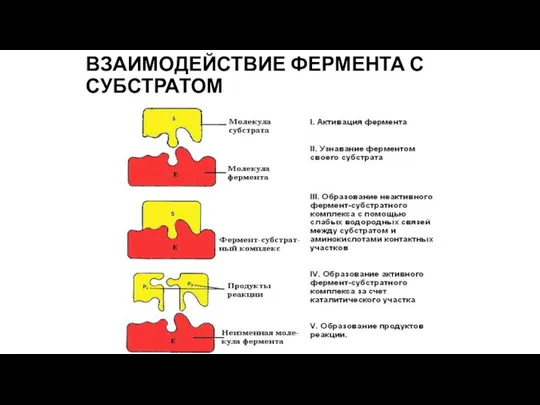
- 5. ВЗАИМОДЕЙСТВИЕ ФЕРМЕНТА С СУБСТРАТОМ
- 6. ВЗАИМОДЕЙСТВИЕ ФЕРМЕНТА С СУБСТРАТОМ
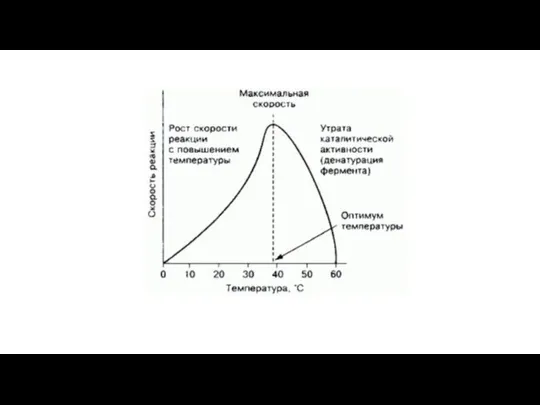
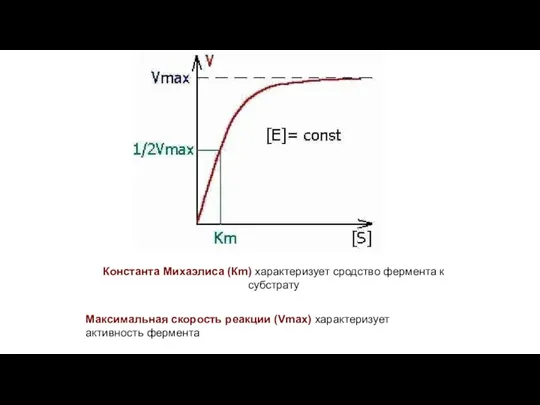
- 10. Константа Михаэлиса (Кm) характеризует сродство фермента к субстрату Максимальная скорость реакции (Vmax) характеризует активность фермента
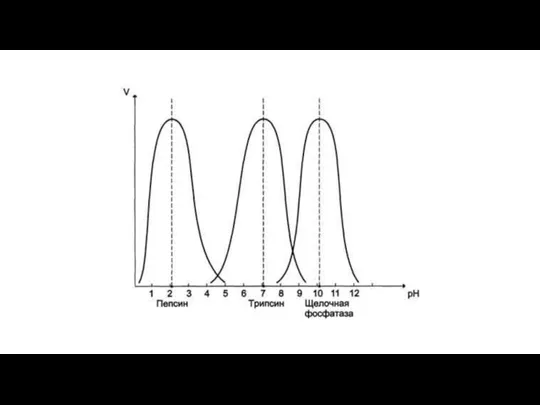
- 11. ВИДЫ СПЕЦИФИЧНОСТИ ФЕРМЕНТОВ Специфичность – фермент действует либо на одно вещество, либо на группу родственных веществ
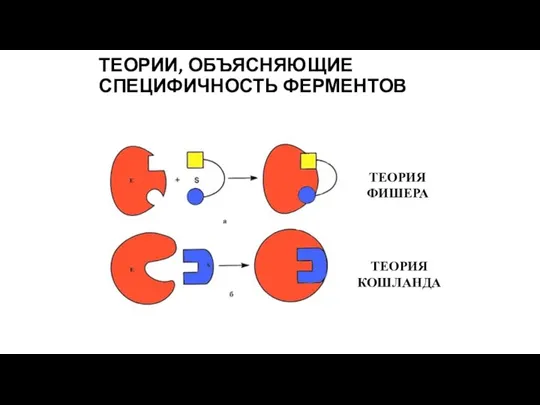
- 12. ТЕОРИИ, ОБЪЯСНЯЮЩИЕ СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ ТЕОРИЯ ФИШЕРА ТЕОРИЯ КОШЛАНДА
- 13. Скорость метаболических путей зависит от: количества фермента доступности кофакторов и коферментов количества субстрата активности фермента
- 14. МЕХАНИЗМ КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ФЕРМЕНТОВ
- 15. ПРИНЦИПЫ ИЗМЕРЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ 1. По скорости убывания количества субстрата реакции 2. По скорости возрастания количества
- 16. КЛАСИФИКАЦИЯ ФЕРМЕНТОВ 1. Оксидоредуктазы 2. Трансферазы 3. Гидролазы 4. Лиазы 5. Изомеразы 6. Лигазы (синтетазы)
- 17. Классификация ферментов основана на типе катализируемой реакции 1. Оксидоредуктазы катализируют ОВР используют коферменты НАД+, НАДФ+, ФАД,
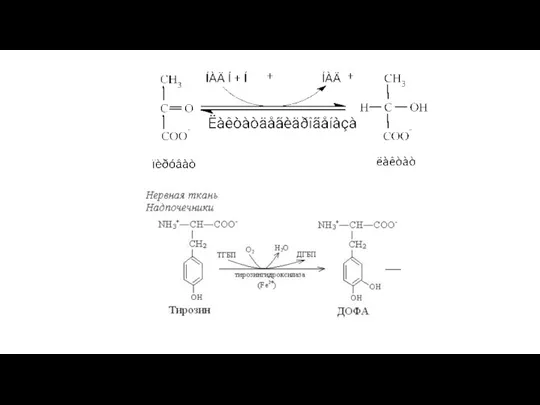
- 18. 2. Оксидазы - переносят электроны на кислород с образованием воды или перекиси водорода. Например: О2 +
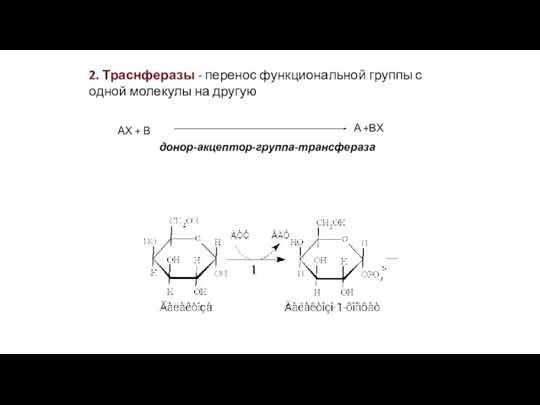
- 20. 2. Траснферазы - перенос функциональной группы с одной молекулы на другую АХ + В А +ВХ
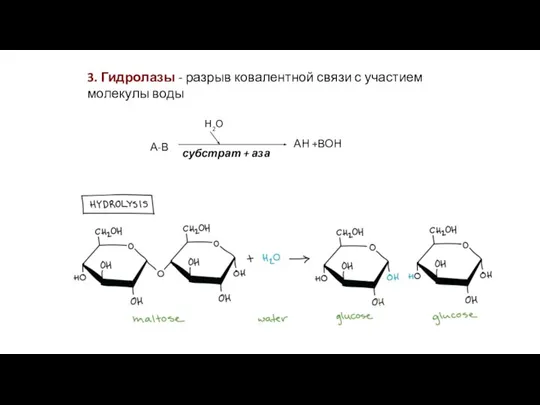
- 21. 3. Гидролазы - разрыв ковалентной связи с участием молекулы воды субстрат + аза
- 22. 4. Лиазы - негидролитическое расщепление субстрата, присоединение воды по двойной связи, отщепление воды с образованием двойной
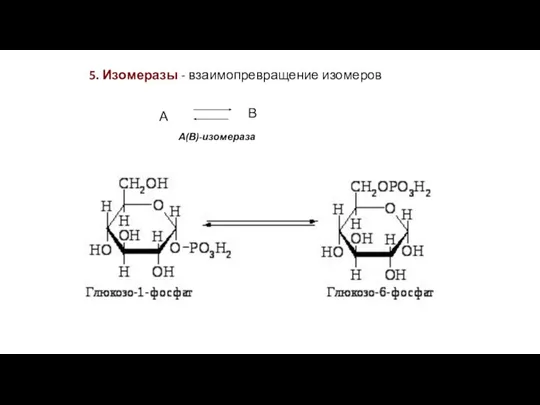
- 24. 5. Изомеразы - взаимопревращение изомеров А В А(В)-изомераза
- 26. Скачать презентацию













 Мышцы таза
Мышцы таза Презентация на тему Разнообразие плоских червей сосальщики и цепни (7 класс)
Презентация на тему Разнообразие плоских червей сосальщики и цепни (7 класс)  История генетики
История генетики Правила поведения в природе
Правила поведения в природе Генетика человека. Наследственность и изменчивость нормальных и аномальных признаков человека
Генетика человека. Наследственность и изменчивость нормальных и аномальных признаков человека Вирусы, их строение, размножение, значение в сельском хозяйстве
Вирусы, их строение, размножение, значение в сельском хозяйстве Бактерии Прокариоты
Бактерии Прокариоты Клеточный цикл. Деление клетки. Классическая генетика
Клеточный цикл. Деление клетки. Классическая генетика Комнатные растения
Комнатные растения Введение в остеологию кости туловища
Введение в остеологию кости туловища Cytogenetic method
Cytogenetic method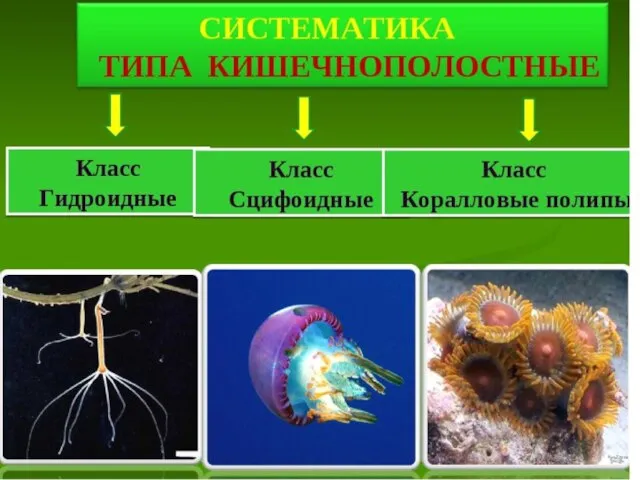 Систематика типа Кишечнополостные
Систематика типа Кишечнополостные Презентация на тему Человек как житель биосферы
Презентация на тему Человек как житель биосферы  Лист — часть побега, внешнее и внутреннее строение листа. 7 класс
Лист — часть побега, внешнее и внутреннее строение листа. 7 класс Тип Кольчатые черви
Тип Кольчатые черви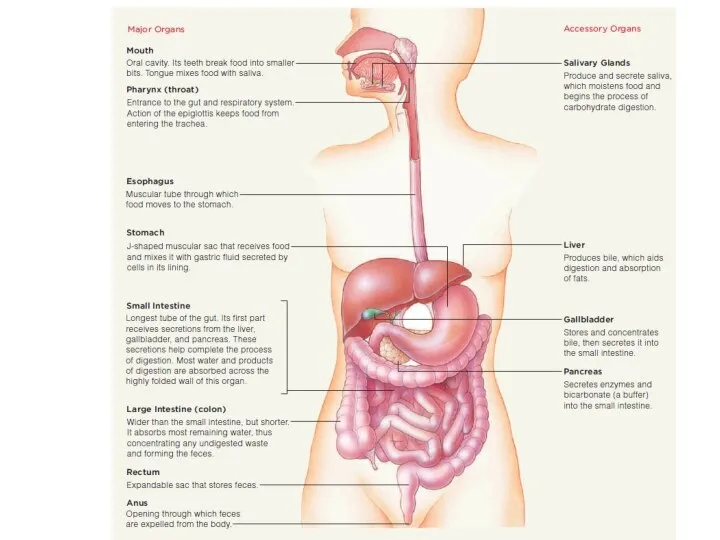 Пищеварение
Пищеварение Царство Вирусы
Царство Вирусы Скелет
Скелет Бесполое размножение организмов
Бесполое размножение организмов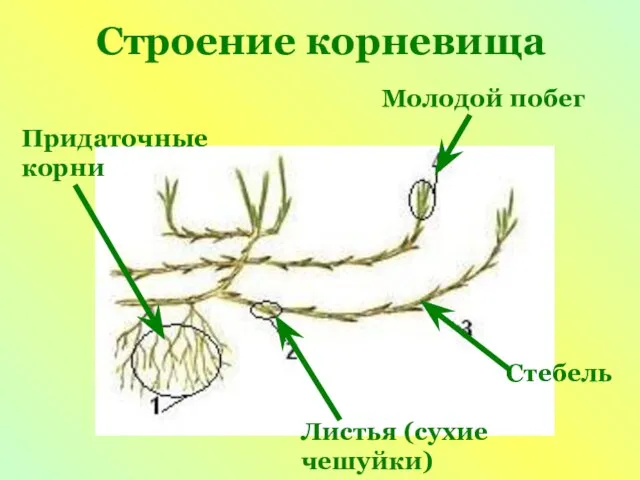 Презентация на тему Видоизмененные побеги
Презентация на тему Видоизмененные побеги  Многоклеточные организмы: грибы и растения
Многоклеточные организмы: грибы и растения Автор: Филатова Анжелика, ученица 6 класса Руководитель: Филатова С.Н., учитель биологии МБОУ СОШ №6 город Ливны 2012 год
Автор: Филатова Анжелика, ученица 6 класса Руководитель: Филатова С.Н., учитель биологии МБОУ СОШ №6 город Ливны 2012 год Подражание Форма научения
Подражание Форма научения Опорно-двигательная система человека
Опорно-двигательная система человека Органы женского малого таза
Органы женского малого таза Многоклеточные водоросли
Многоклеточные водоросли Животные тайги
Животные тайги Метод экспериментального количественного сравнения концентрации каротиноидов в образце моркови и в филе рыбы семейства лососевых
Метод экспериментального количественного сравнения концентрации каротиноидов в образце моркови и в филе рыбы семейства лососевых