Содержание
- 2. Фермент и субстрат Вещество, на которое действует фермент, называется субстрат
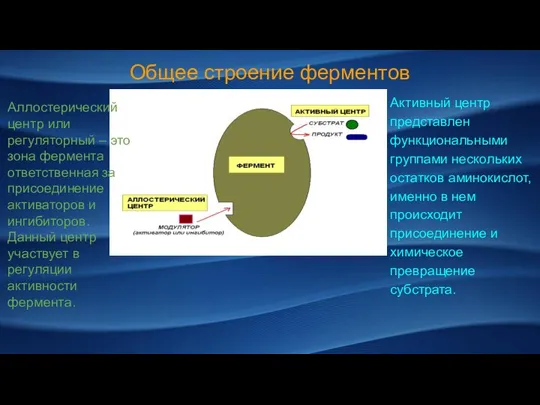
- 3. Общее строение ферментов Активный центр представлен функциональными группами нескольких остатков аминокислот, именно в нем происходит присоединение
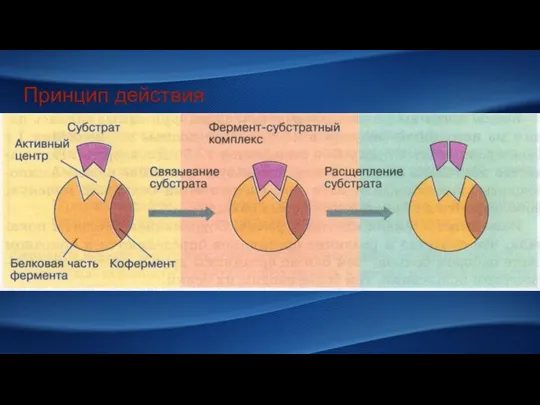
- 4. Принцип действия
- 5. Кофермент присоединяется на время реакции и может отсоединяться после Простетическая группа прочно связана с белковой частью
- 6. Свойства ферментов 1.Все ферменты - белковой природы. 2.Ферменты обладают высокой молекулярной массой. 3.Они хорошо растворимы в
- 7. 6.Ферменты высокоспецифичны по отношению к субстратам. 7.Ферменты для своего действия требуют строго определенного значения рН (пепсин
- 8. Специфичность действия ферментов По специфичности действия ферменты делятся на две группы: обладающие абсолютной специфичностью и с
- 9. Относительная специфичность Относительная специфичность наблюдается, когда фермент катализирует реакции одного типа с более чем одним структуроподобным
- 10. Абсолютная специфичность Абсолютная специфичность проявляется тогда, когда фермент действует лишь на одно-единственное вещество и катализирует лишь
- 11. Обратимость Некоторые ферменты могут катализировать как прямую реакцию, так и обратную. Например, лактатдегидрогеназа, фермент катализирующий окисление
- 12. Систематическая номенклатура: Название фермента является сложным и состоит из 4 частей: Название субстрата, т. е. вещества
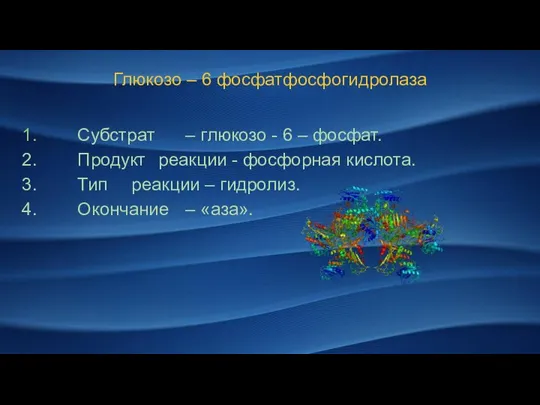
- 13. Глюкозо – 6 фосфатфосфогидролаза Субстрат – глюкозо - 6 – фосфат. Продукт реакции - фосфорная кислота.
- 14. Классификация ферментов 1 - Оксидоредуктазы – катализируют окислительно-восстановительные реакции (ЛДГ катализирует восстановление пирувата до лактата). 2
- 15. 4 - Лиазы – катализируют не гидролитическое расщепление соединений с двойной связью (декарбоксилаза – фермент отщепляющий
- 16. Изоферменты Изоферменты – это ферменты, катализирующие одну и ту же реакцию, но отличающиеся друг от друга
- 17. ЛДГ-5 - локализован в клетках печени, скелетной мускулатуре. ЛДГ-1 - Сердце, почки ЛДГ-2 - Эритроциты, тромбоциты,
- 18. Кинетика ферментативных реакций. Кинетика изучает изменение скорости ферментативной реакции во времени в зависимости от ряда факторов:
- 20. Скачать презентацию













 Биоэнергетика. Часть вторая. Заставим єлектроні бегать
Биоэнергетика. Часть вторая. Заставим єлектроні бегать Растения в городе
Растения в городе Зимующие птицы. Покормите птиц зимой
Зимующие птицы. Покормите птиц зимой Бабочка семейства Павлиноглазки Samia Cynthia, или Айлантовый шелкопряд. Опыт разведения в неволе
Бабочка семейства Павлиноглазки Samia Cynthia, или Айлантовый шелкопряд. Опыт разведения в неволе Тренажёр Красная книга Пермского края. Папоротники и Плауны
Тренажёр Красная книга Пермского края. Папоротники и Плауны Проведение бактериологического метода исследования с изучением морфологических, культуральных и биохимических свойств бактерий
Проведение бактериологического метода исследования с изучением морфологических, культуральных и биохимических свойств бактерий Видоизменения вегетативных органов и их биологическое значение
Видоизменения вегетативных органов и их биологическое значение Законы Менделя
Законы Менделя Что такое большие данные?
Что такое большие данные? Тип членистоногие (фотографии)
Тип членистоногие (фотографии) Физиология дыхания
Физиология дыхания Конечный мозг
Конечный мозг Презентация на тему Основные понятия генетики
Презентация на тему Основные понятия генетики  Особенности полового и пищевого поведение пауков
Особенности полового и пищевого поведение пауков Класс Млекопитающие или Звери
Класс Млекопитающие или Звери Презентация на тему ОРГАНЫ ДЫХАНИЯ
Презентация на тему ОРГАНЫ ДЫХАНИЯ  Молекулярно-генетический уровень жизни
Молекулярно-генетический уровень жизни Изучение представителей простейших
Изучение представителей простейших Значение дыхания. Биологическая роль кислорода
Значение дыхания. Биологическая роль кислорода Полуавтономные органоиды клетки
Полуавтономные органоиды клетки Нарушение осанки и плоскостопие. Развитие опорно-двигательной системы (8 класс)
Нарушение осанки и плоскостопие. Развитие опорно-двигательной системы (8 класс) Птицы (фотографии)
Птицы (фотографии) Физиология и биохимия микроорганизмов
Физиология и биохимия микроорганизмов Экспериментальная экология
Экспериментальная экология Старение человека
Старение человека Класс Сосальщики (Trematoda)
Класс Сосальщики (Trematoda) Genetics. Purpose of my presentation
Genetics. Purpose of my presentation Лист. Внешнее и внутреннее строение
Лист. Внешнее и внутреннее строение