Содержание
- 2. Теория скользящих нитей
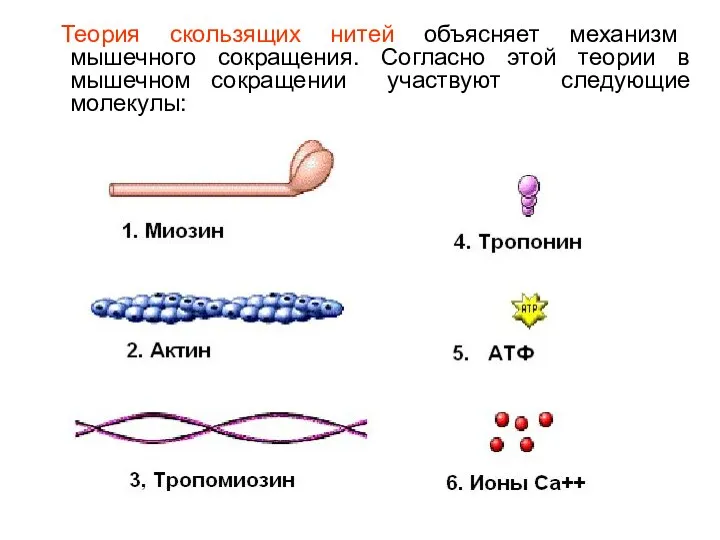
- 3. Теория скользящих нитей объясняет механизм мышечного сокращения. Согласно этой теории в мышечном сокращении участвуют следующие молекулы:
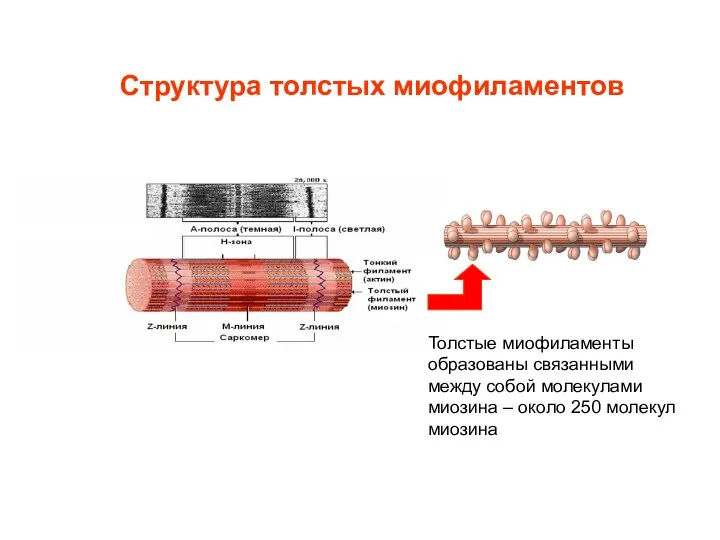
- 4. Структура толстых миофиламентов Толстые миофиламенты образованы связанными между собой молекулами миозина – около 250 молекул миозина
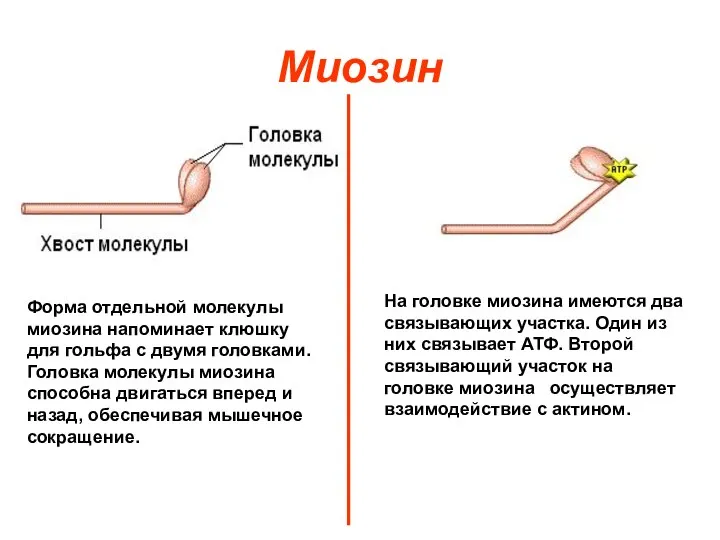
- 5. Миозин Форма отдельной молекулы миозина напоминает клюшку для гольфа с двумя головками. Головка молекулы миозина способна
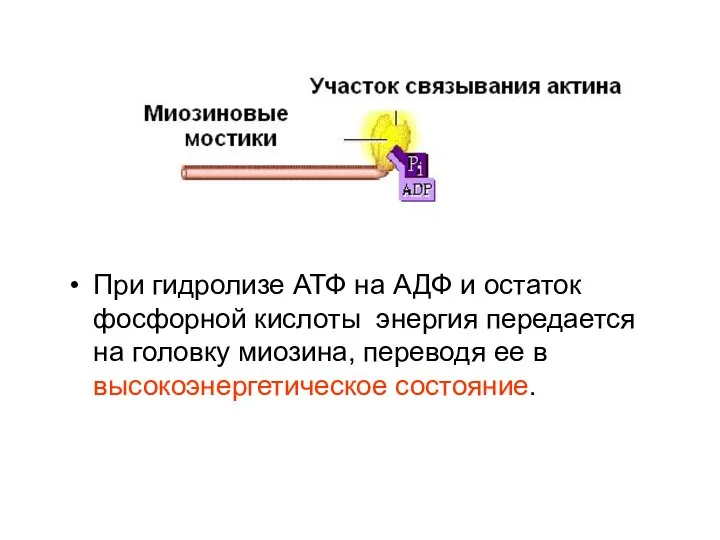
- 6. При гидролизе АТФ на АДФ и остаток фосфорной кислоты энергия передается на головку миозина, переводя ее
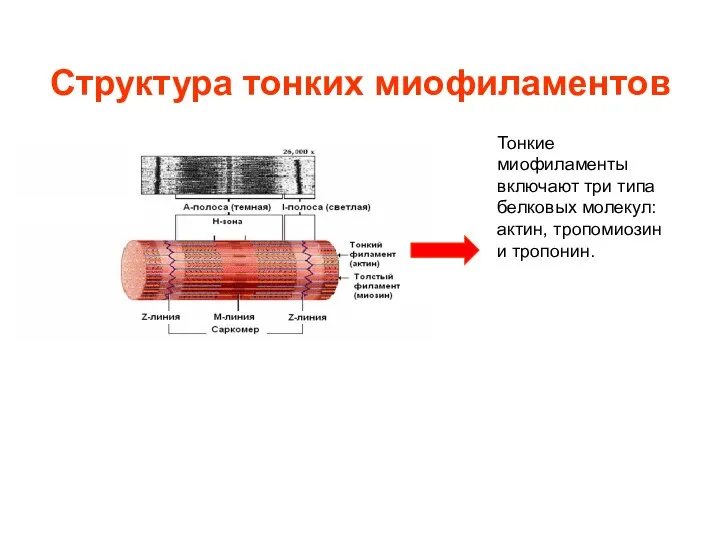
- 7. Структура тонких миофиламентов Тонкие миофиламенты включают три типа белковых молекул: актин, тропомиозин и тропонин.
- 8. Актин Актин - основной компонент тонких филаментов. Актиновые субъединицы соединены в виде двух нитей бус, скрученных
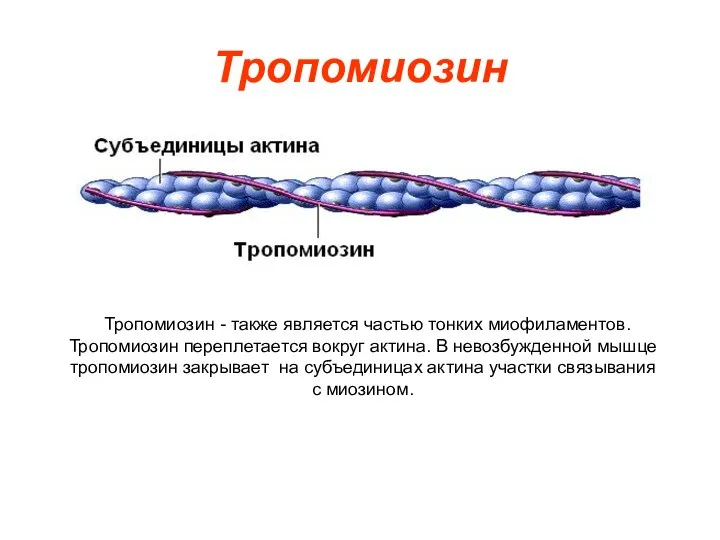
- 9. Тропомиозин Тропомиозин - также является частью тонких миофиламентов. Тропомиозин переплетается вокруг актина. В невозбужденной мышце тропомиозин
- 10. Тропонин Третий белковый компонент тонких миофиламентов тропонин. Молекулы тропонина с определенной периодичностью прилежат к молекулам тропомиозина.
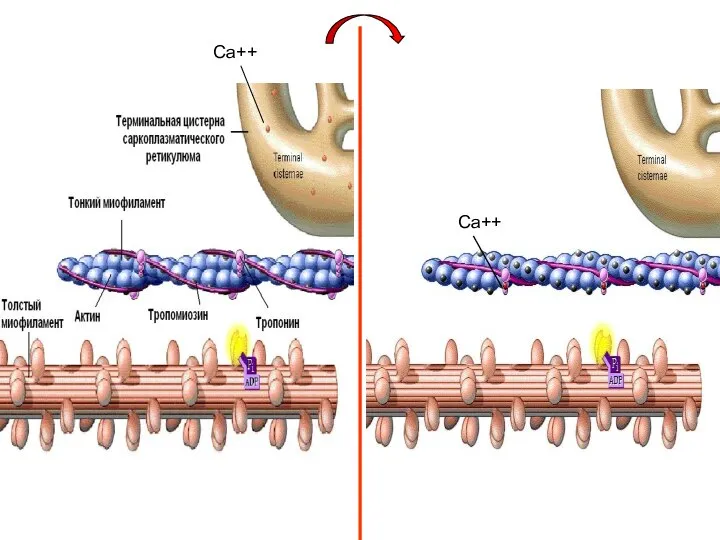
- 11. Первый этап мышечного сокращения – освобождение участков связывания миозина на субъединицах актина Потенциал действия проходит по
- 12. Са++ Са++
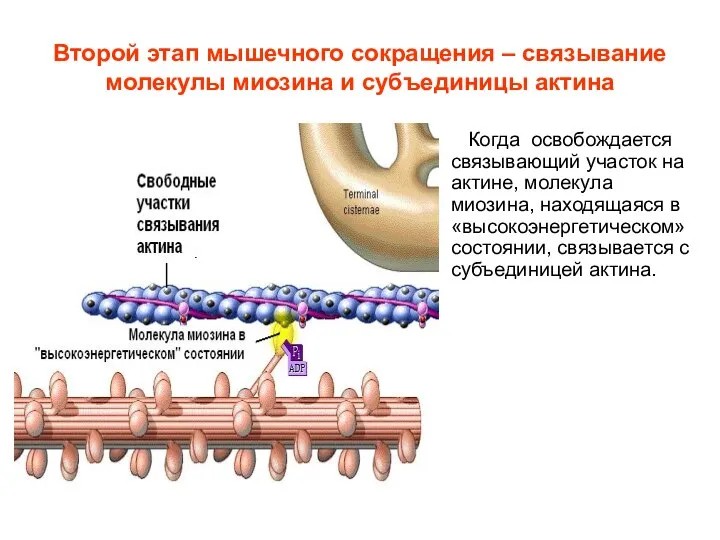
- 13. Второй этап мышечного сокращения – связывание молекулы миозина и субъединицы актина Когда освобождается связывающий участок на
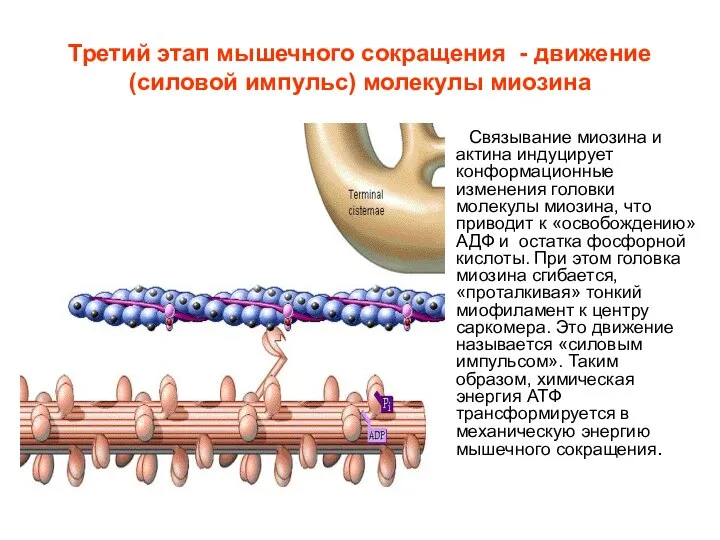
- 14. Третий этап мышечного сокращения - движение (силовой импульс) молекулы миозина Связывание миозина и актина индуцирует конформационные
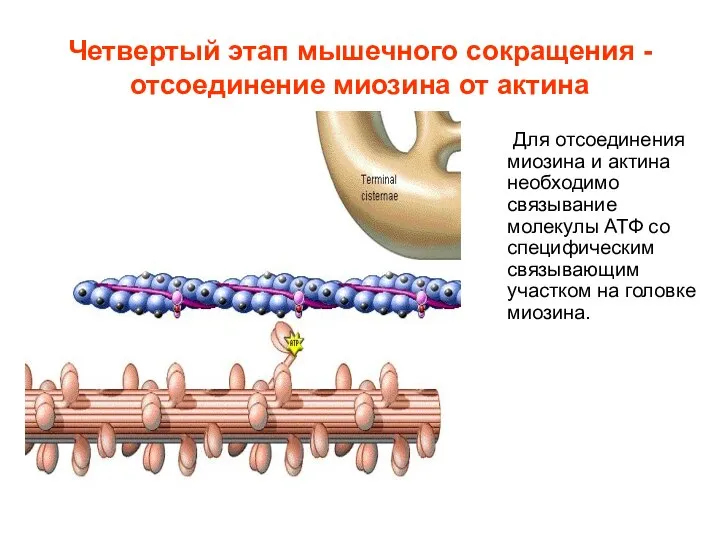
- 15. Четвертый этап мышечного сокращения - отсоединение миозина от актина Для отсоединения миозина и актина необходимо связывание
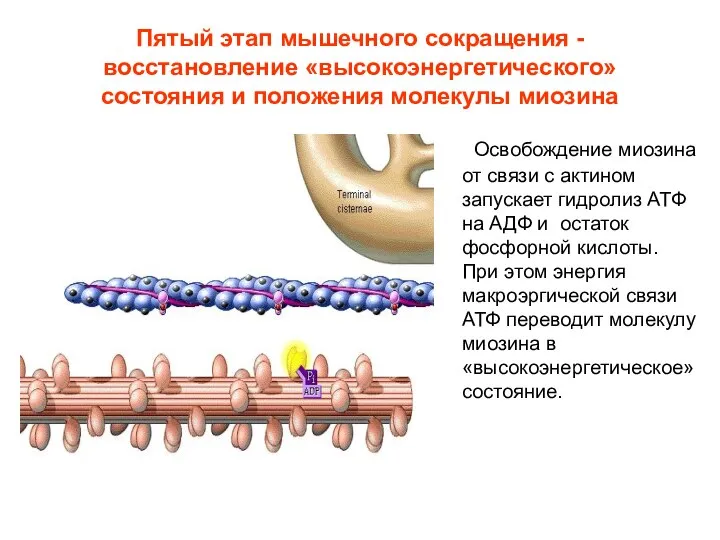
- 16. Пятый этап мышечного сокращения - восстановление «высокоэнергетического» состояния и положения молекулы миозина Освобождение миозина от связи
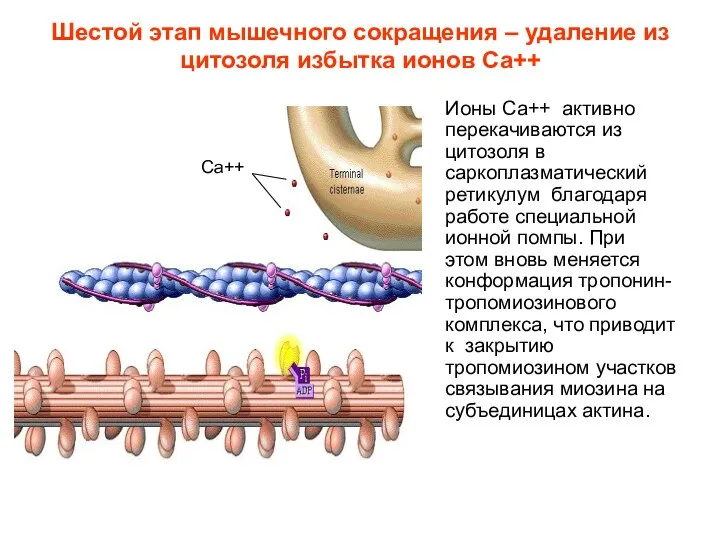
- 17. Шестой этап мышечного сокращения – удаление из цитозоля избытка ионов Са++ Ионы Са++ активно перекачиваются из
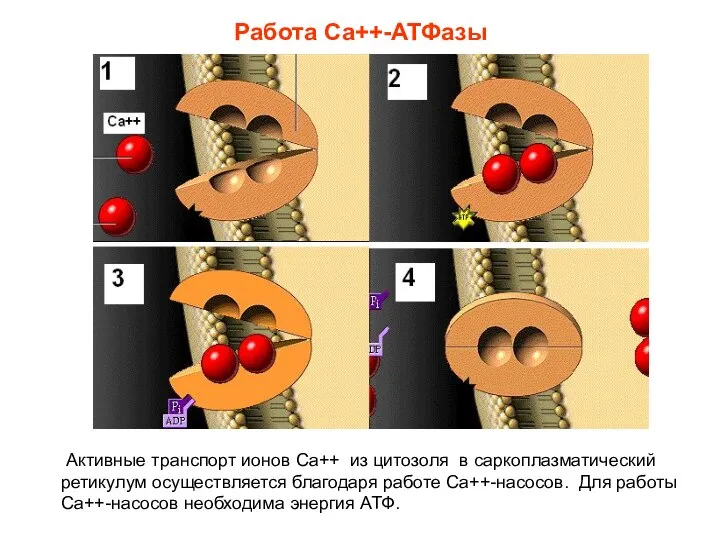
- 18. Работа Са++-АТФазы Активные транспорт ионов Са++ из цитозоля в саркоплазматический ретикулум осуществляется благодаря работе Са++-насосов. Для
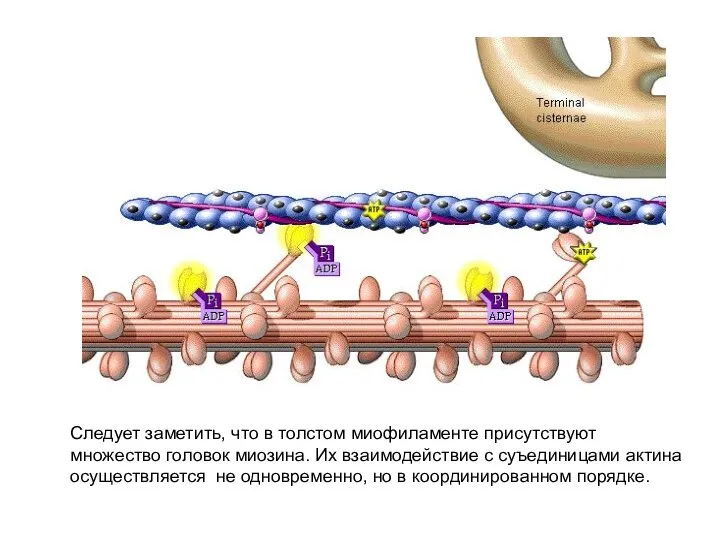
- 19. Следует заметить, что в толстом миофиламенте присутствуют множество головок миозина. Их взаимодействие с суъединицами актина осуществляется
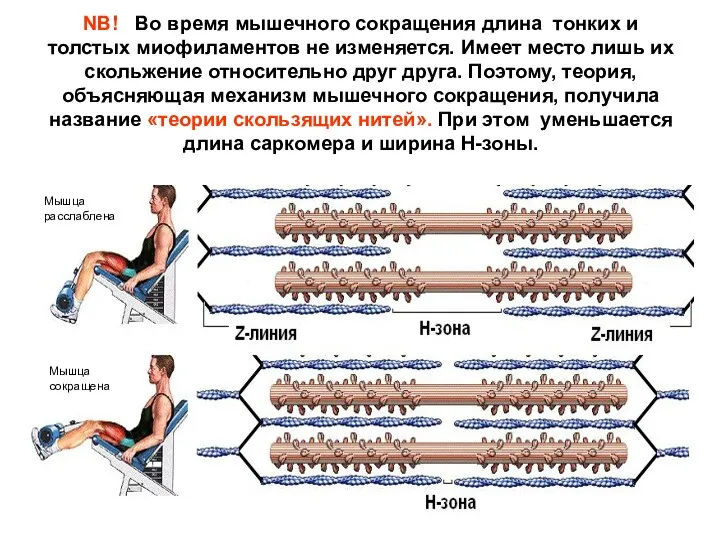
- 20. NB! Во время мышечного сокращения длина тонких и толстых миофиламентов не изменяется. Имеет место лишь их
- 21. Роль АТФ в мышечном сокращении: АТФ обеспечивает энергией «силовой импульс» головки молекулы миозина; с помощью АТФ
- 23. Скачать презентацию





 Своя игра Юный турист
Своя игра Юный турист О жизни на Земле
О жизни на Земле Bognaýaklylar. Boýunaýaklylar toparyndan
Bognaýaklylar. Boýunaýaklylar toparyndan Биотехнологии
Биотехнологии Мутации. Номенклатура бактериальных генов
Мутации. Номенклатура бактериальных генов Разговор о птицах
Разговор о птицах Современные методы психогенетики
Современные методы психогенетики Nerve
Nerve Дождевые черви: факты и разоблачение мифов
Дождевые черви: факты и разоблачение мифов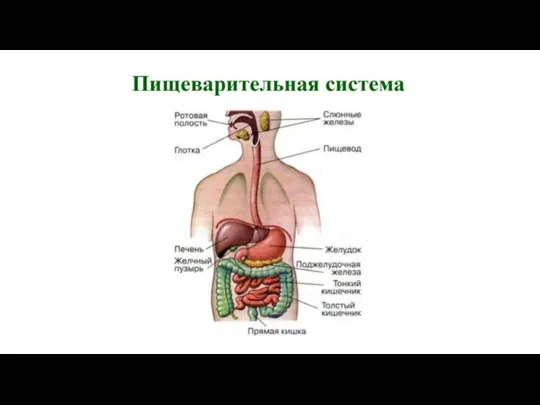 Пищеварительная система человека
Пищеварительная система человека Морфо-функциональные и возрастные особенности организма человека
Морфо-функциональные и возрастные особенности организма человека Учение Вернадского о биосфере
Учение Вернадского о биосфере Уровни организации живых систем
Уровни организации живых систем Земляника в селекции
Земляника в селекции Строение семян
Строение семян Самостоятельная работа по теме Побег
Самостоятельная работа по теме Побег Как размножаются живые организмы. 6 класс
Как размножаются живые организмы. 6 класс Электростанция. Бег, как способ вырабатывания энергии
Электростанция. Бег, как способ вырабатывания энергии Теломеры и их функции
Теломеры и их функции Обмен углеводов
Обмен углеводов Ритза. Работа По Профориентации 2
Ритза. Работа По Профориентации 2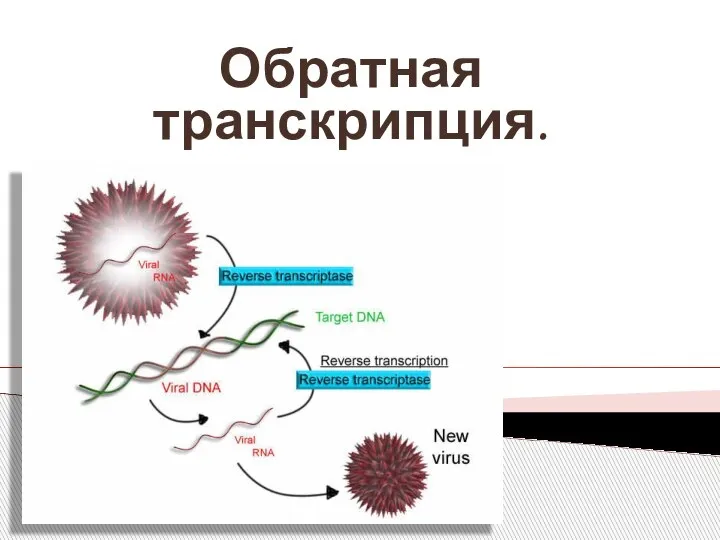 Обратная транскрипция, синтез ДНК на РНК
Обратная транскрипция, синтез ДНК на РНК Функции зрения
Функции зрения Реакция клеток на стресс. Гибель клеток
Реакция клеток на стресс. Гибель клеток Психоактивные вещества
Психоактивные вещества Лишайники
Лишайники Анатомия и физиология глаза человека
Анатомия и физиология глаза человека Характеристика пяти царств живых организмов: прокариоты, протисты, грибы, растения, животные
Характеристика пяти царств живых организмов: прокариоты, протисты, грибы, растения, животные