Содержание
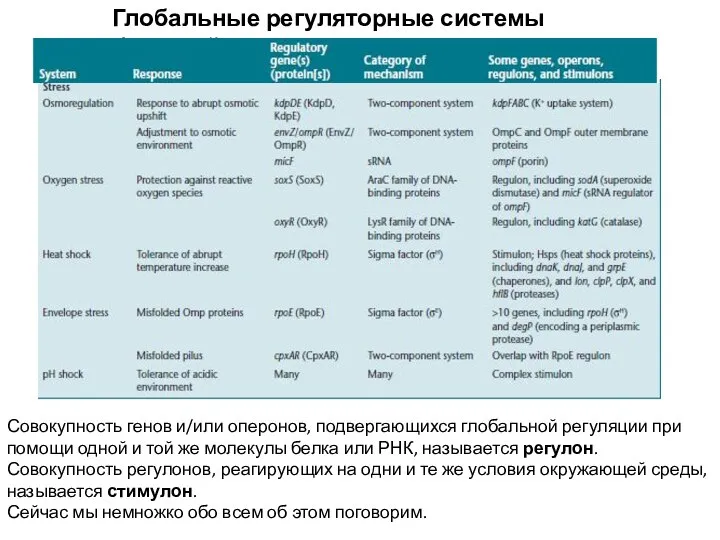
- 2. Глобальные регуляторные системы бактерий Совокупность генов и/или оперонов, подвергающихся глобальной регуляции при помощи одной и той
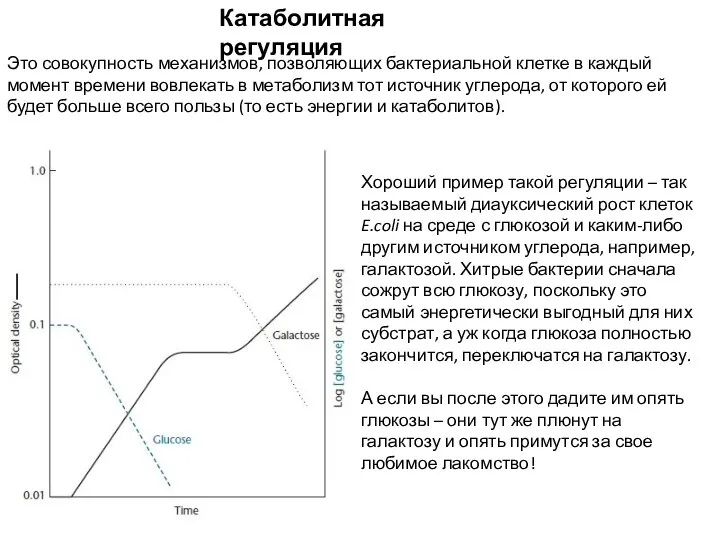
- 3. Катаболитная регуляция Это совокупность механизмов, позволяющих бактериальной клетке в каждый момент времени вовлекать в метаболизм тот
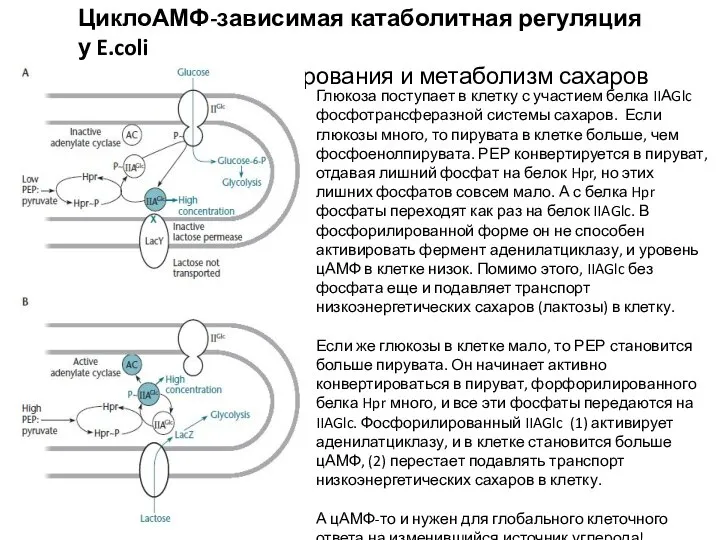
- 4. ЦиклоАМФ-зависимая катаболитная регуляция у E.coli Каскад фосфорилирования и метаболизм сахаров Глюкоза поступает в клетку с участием
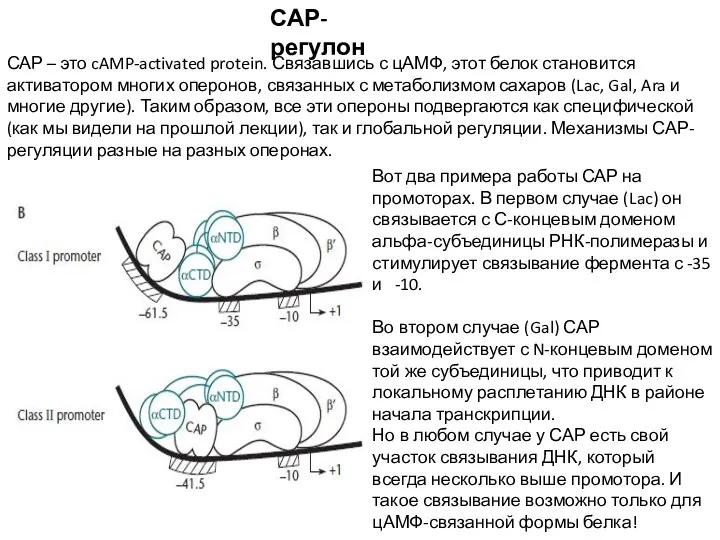
- 5. САР-регулон САР – это cAMP-activated protein. Связавшись с цАМФ, этот белок становится активатором многих оперонов, связанных
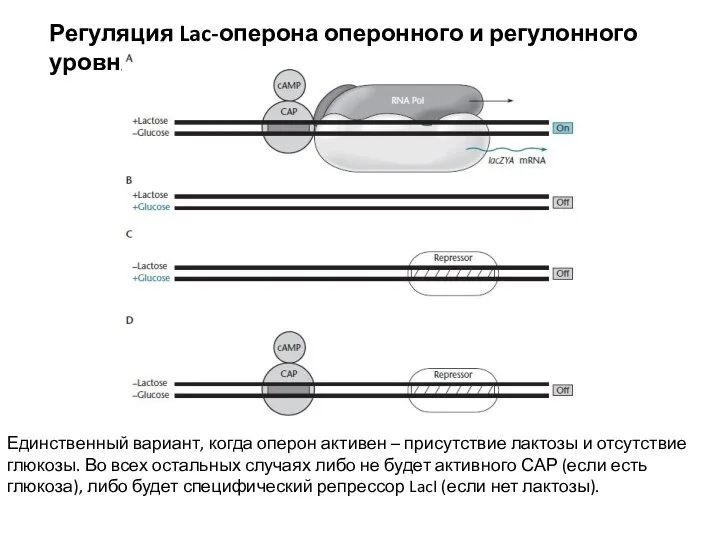
- 6. Регуляция Lac-оперона оперонного и регулонного уровня Единственный вариант, когда оперон активен – присутствие лактозы и отсутствие
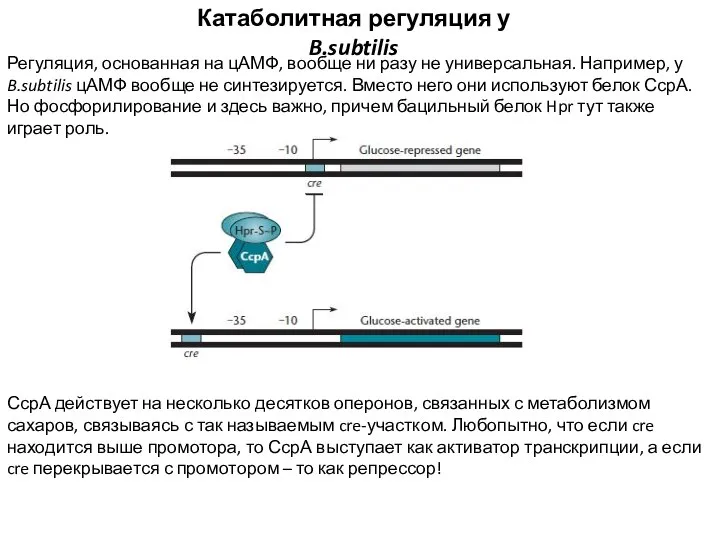
- 7. Катаболитная регуляция у B.subtilis Регуляция, основанная на цАМФ, вообще ни разу не универсальная. Например, у B.subtilis
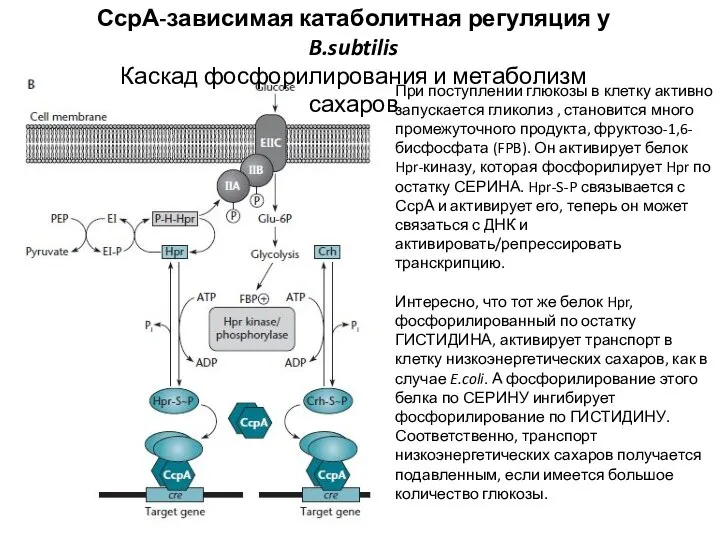
- 8. СсрА-зависимая катаболитная регуляция у B.subtilis Каскад фосфорилирования и метаболизм сахаров При поступлении глюкозы в клетку активно
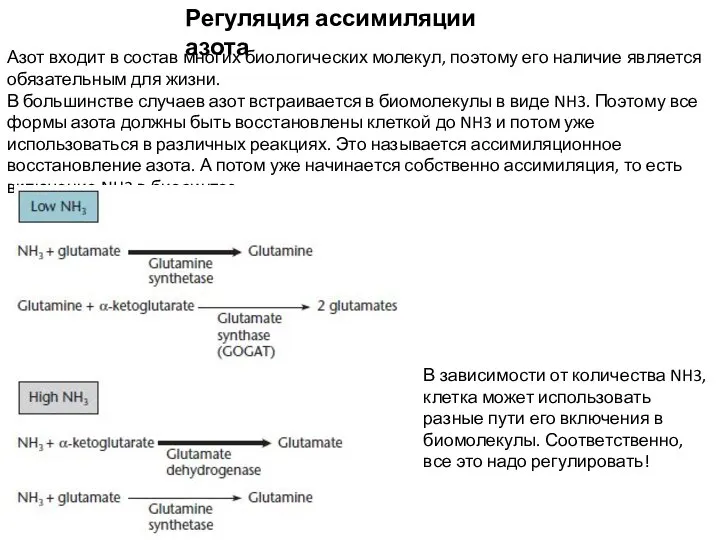
- 9. Регуляция ассимиляции азота Азот входит в состав многих биологических молекул, поэтому его наличие является обязательным для
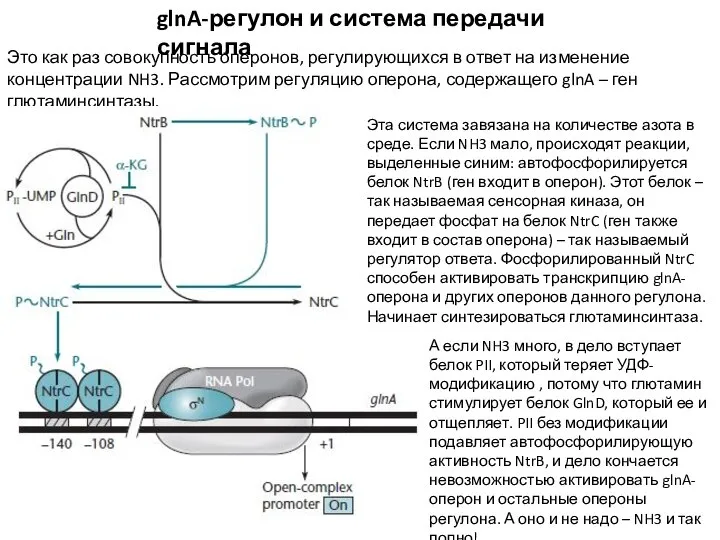
- 10. glnA-регулон и система передачи сигнала Это как раз совокупность оперонов, регулирующихся в ответ на изменение концентрации
- 11. glnA-оперон устроен любопытным образом В этом опероне три промотора, но только один (р2) подвержен NtrC-зависимой регуляции.
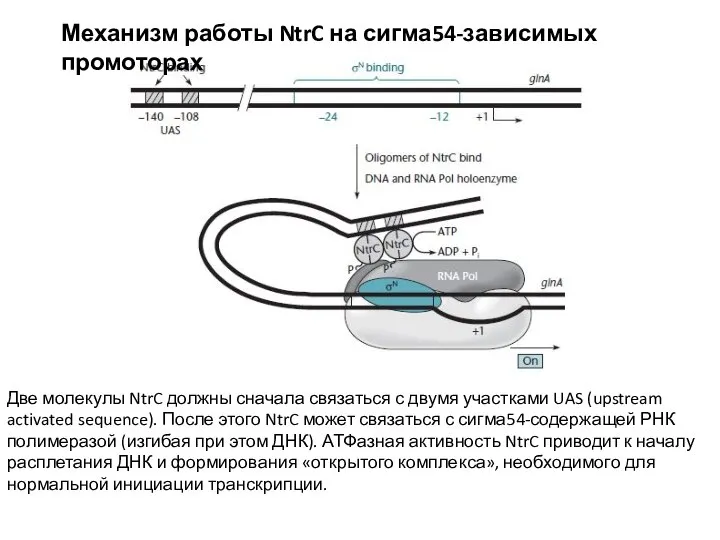
- 12. Механизм работы NtrC на сигма54-зависимых промоторах Две молекулы NtrC должны сначала связаться с двумя участками UAS
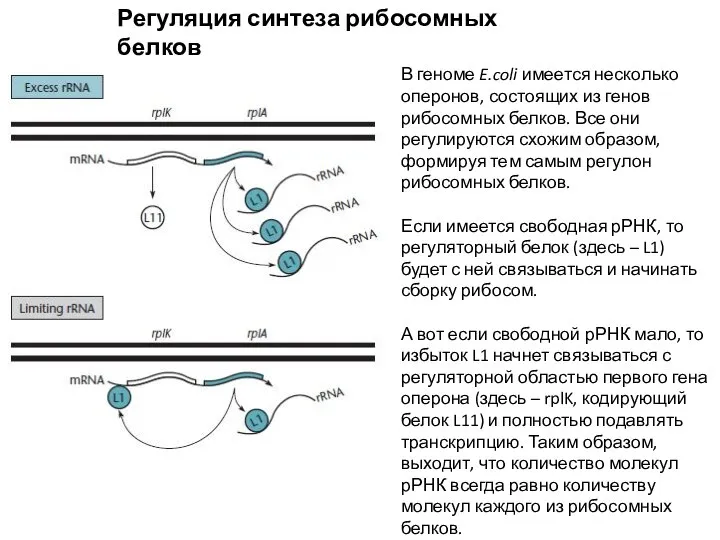
- 13. Регуляция синтеза рибосомных белков В геноме E.coli имеется несколько оперонов, состоящих из генов рибосомных белков. Все
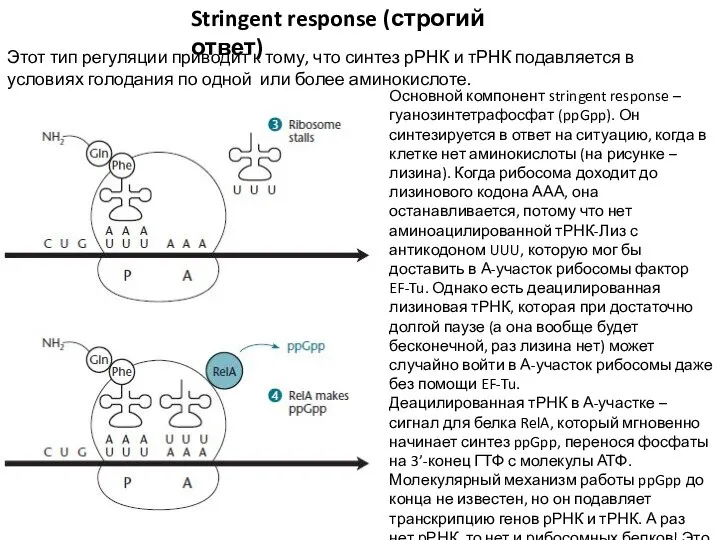
- 14. Stringent response (строгий ответ) Этот тип регуляции приводит к тому, что синтез рРНК и тРНК подавляется
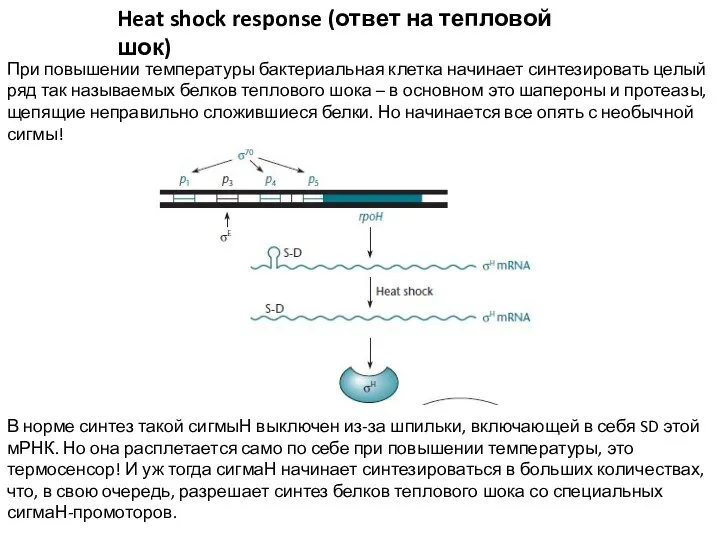
- 15. Heat shock response (ответ на тепловой шок) При повышении температуры бактериальная клетка начинает синтезировать целый ряд
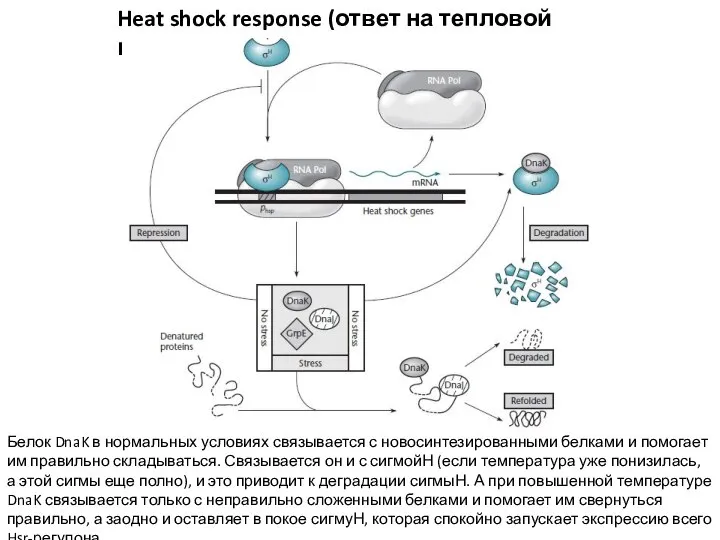
- 16. Heat shock response (ответ на тепловой шок) Белок DnaK в нормальных условиях связывается с новосинтезированными белками
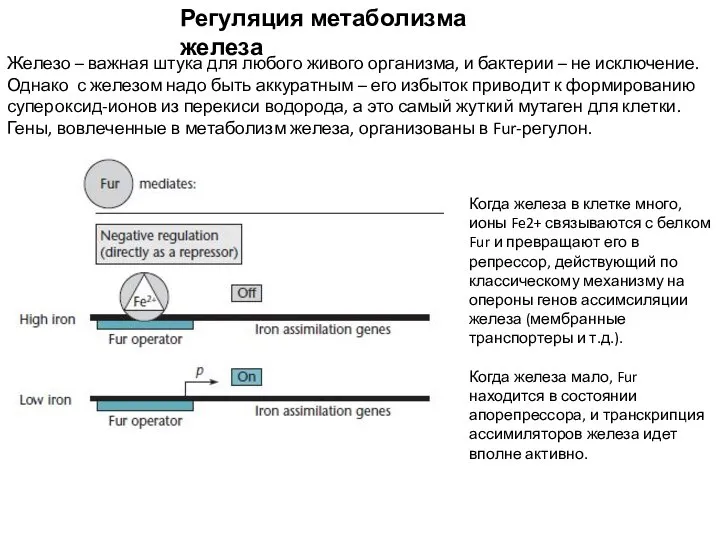
- 17. Регуляция метаболизма железа Железо – важная штука для любого живого организма, и бактерии – не исключение.
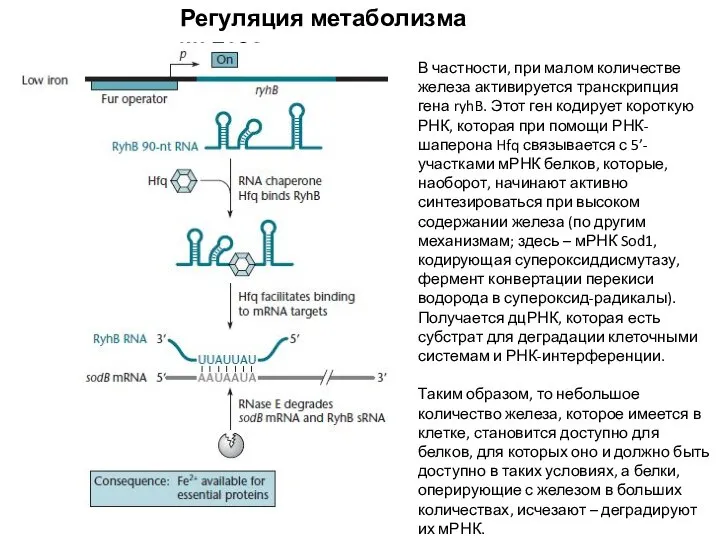
- 18. Регуляция метаболизма железа В частности, при малом количестве железа активируется транскрипция гена ryhB. Этот ген кодирует
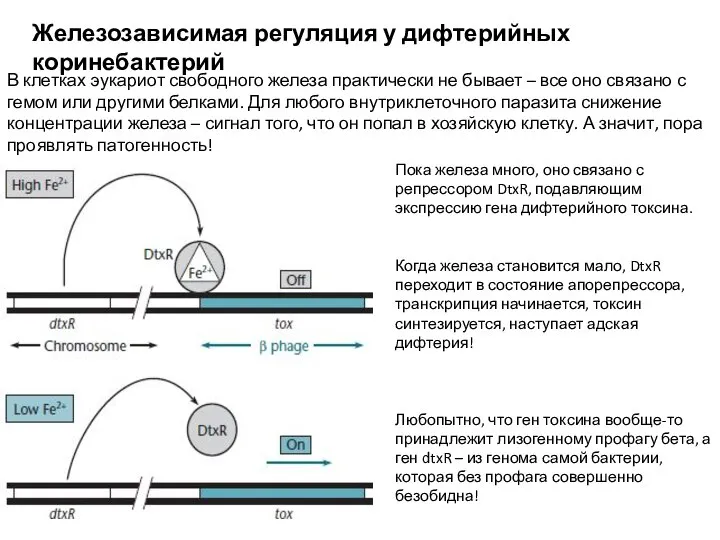
- 19. Железозависимая регуляция у дифтерийных коринебактерий В клетках эукариот свободного железа практически не бывает – все оно
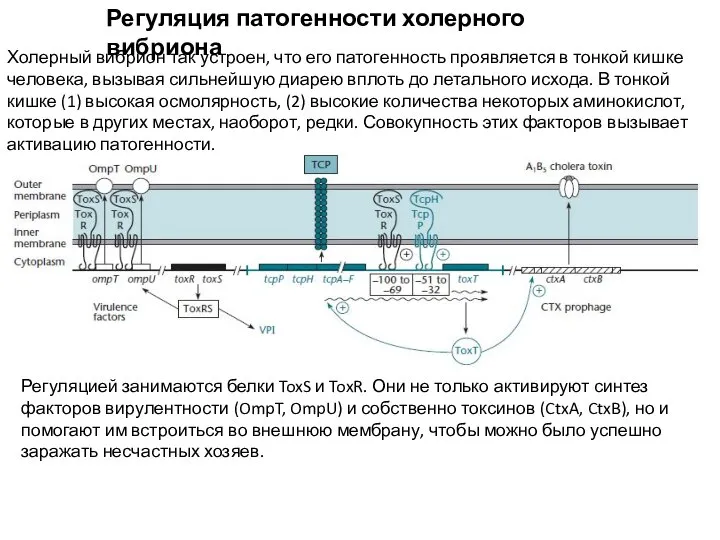
- 20. Регуляция патогенности холерного вибриона Холерный вибрион так устроен, что его патогенность проявляется в тонкой кишке человека,
- 22. Скачать презентацию

 Основы физиологии равновесия
Основы физиологии равновесия Общий план строения растительной клетки
Общий план строения растительной клетки Разнообразие растений
Разнообразие растений Сдаём ЁГЭ!
Сдаём ЁГЭ! Многообразие цветковых растений
Многообразие цветковых растений Растения Австралии
Растения Австралии Нуклеиновые кислоты. Функции и состав
Нуклеиновые кислоты. Функции и состав Ткани растений и животных
Ткани растений и животных Amoebozoa. Царство Conosea. Тип Archamoeba
Amoebozoa. Царство Conosea. Тип Archamoeba Noctule bat
Noctule bat Физиология анализаторов
Физиология анализаторов Ленточные черви. Занятие 6
Ленточные черви. Занятие 6 Механические ткани
Механические ткани Клетка – открытая система
Клетка – открытая система Животное надотряда скаты - манта
Животное надотряда скаты - манта Проект Зимующие птицы Тверской области
Проект Зимующие птицы Тверской области Млекопитающие
Млекопитающие Соматосенсорные органы
Соматосенсорные органы Покрытосеменные (Цветковые) растения
Покрытосеменные (Цветковые) растения Класс Птицы
Класс Птицы Шляпочные грибы. Итоговая практико-значимая работа по курсу Государство и общество. 6 класс
Шляпочные грибы. Итоговая практико-значимая работа по курсу Государство и общество. 6 класс Золотая осень. Что это за листья
Золотая осень. Что это за листья Изучение ценопопуляции прострела раскрытого в окрестностях Д. Клавдино
Изучение ценопопуляции прострела раскрытого в окрестностях Д. Клавдино Организм как единая саморазвивающаяся биологическая система
Организм как единая саморазвивающаяся биологическая система Анатомия центральной нервной системы. Оболочки и полости
Анатомия центральной нервной системы. Оболочки и полости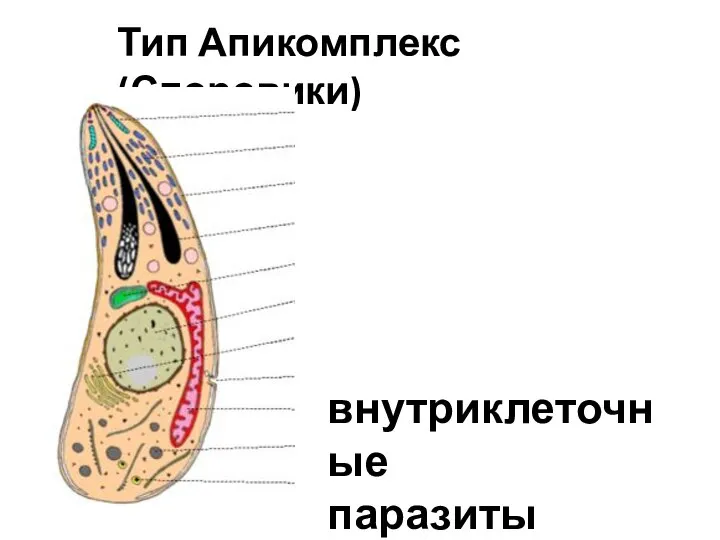 Тип Апикомплекс (Споровики). Внутриклеточные паразиты
Тип Апикомплекс (Споровики). Внутриклеточные паразиты Вирусы, как форма жизни
Вирусы, как форма жизни Акантоцефалезы (Тест)
Акантоцефалезы (Тест)