Содержание
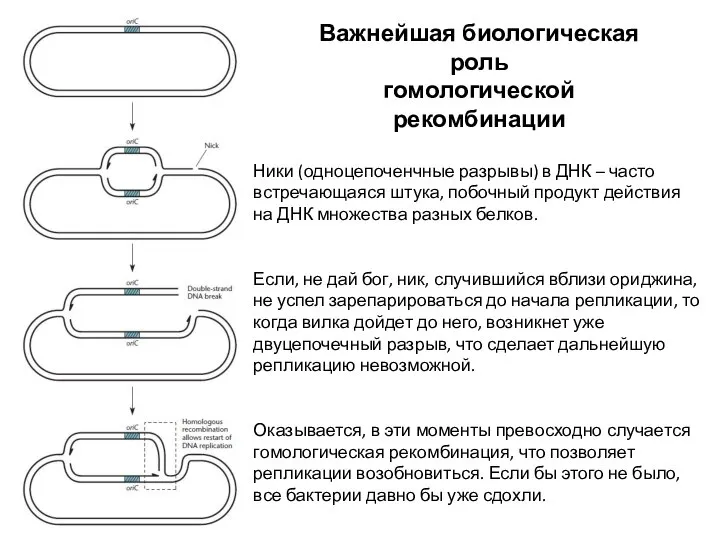
- 2. Ники (одноцепоченчные разрывы) в ДНК – часто встречающаяся штука, побочный продукт действия на ДНК множества разных
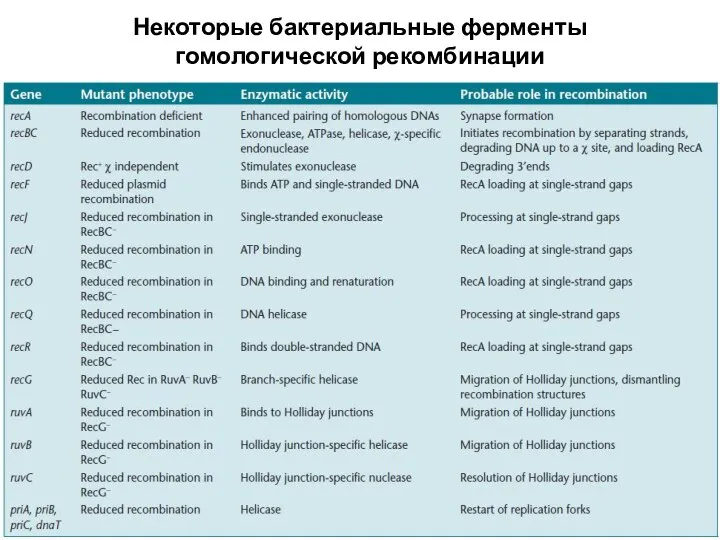
- 3. Некоторые бактериальные ферменты гомологической рекомбинации
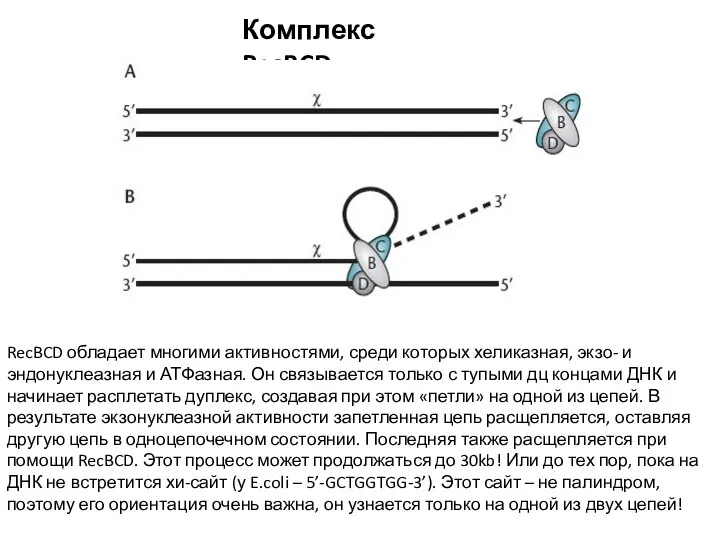
- 4. Комплекс RecBCD RecBCD обладает многими активностями, среди которых хеликазная, экзо- и эндонуклеазная и АТФазная. Он связывается
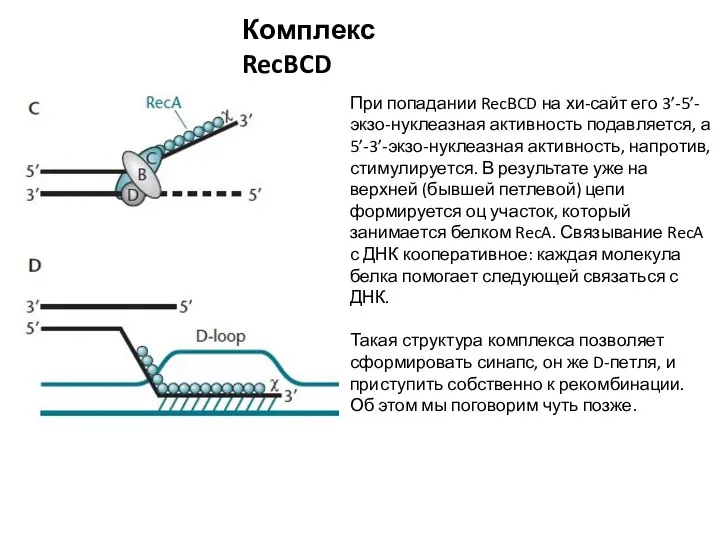
- 5. Комплекс RecBCD При попадании RecBCD на хи-сайт его 3’-5’-экзо-нуклеазная активность подавляется, а 5’-3’-экзо-нуклеазная активность, напротив, стимулируется.
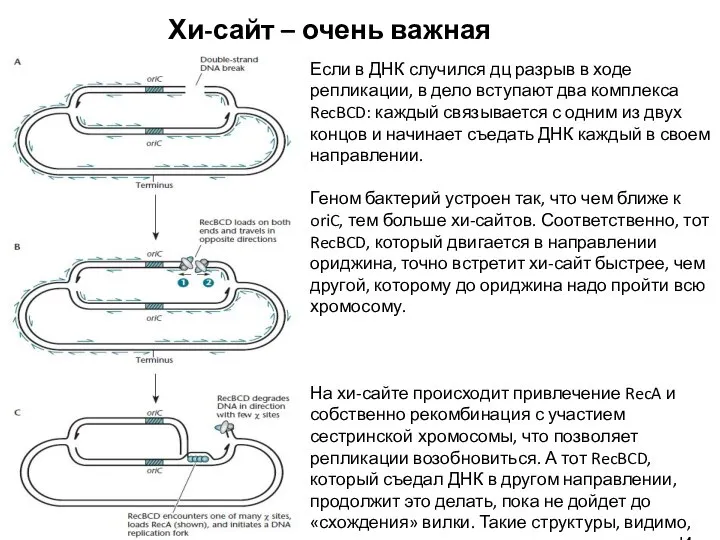
- 6. Хи-сайт – очень важная штука Если в ДНК случился дц разрыв в ходе репликации, в дело
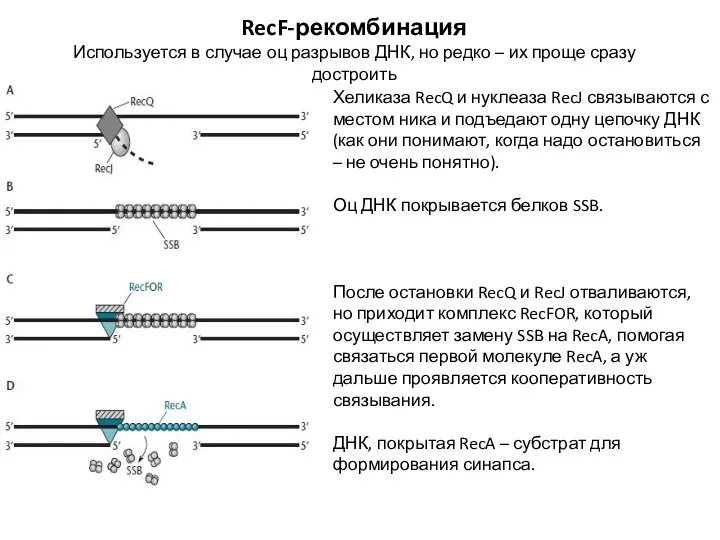
- 7. RecF-рекомбинация Используется в случае оц разрывов ДНК, но редко – их проще сразу достроить Хеликаза RecQ
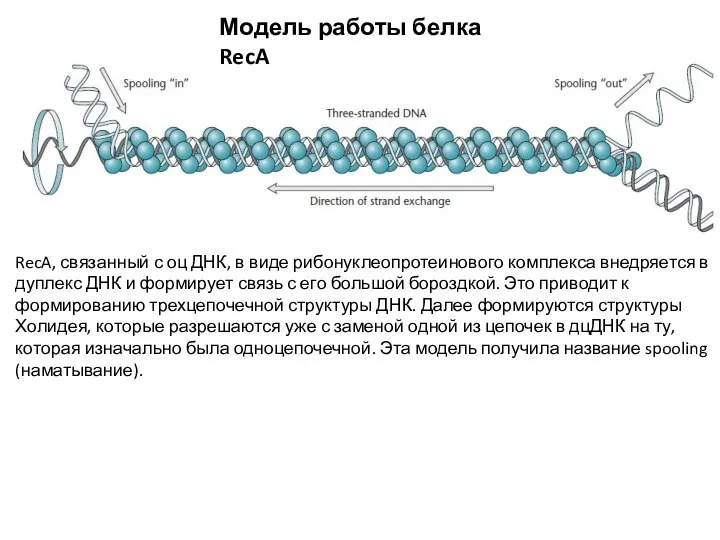
- 8. Модель работы белка RecA RecA, связанный с оц ДНК, в виде рибонуклеопротеинового комплекса внедряется в дуплекс
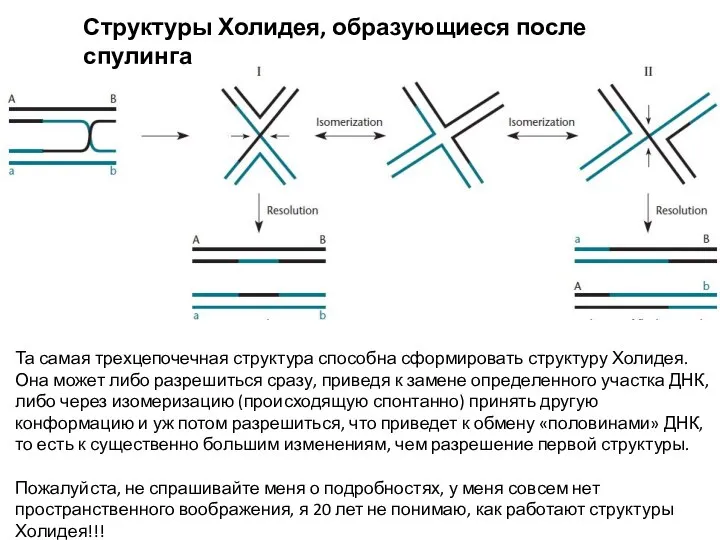
- 9. Структуры Холидея, образующиеся после спулинга Та самая трехцепочечная структура способна сформировать структуру Холидея. Она может либо
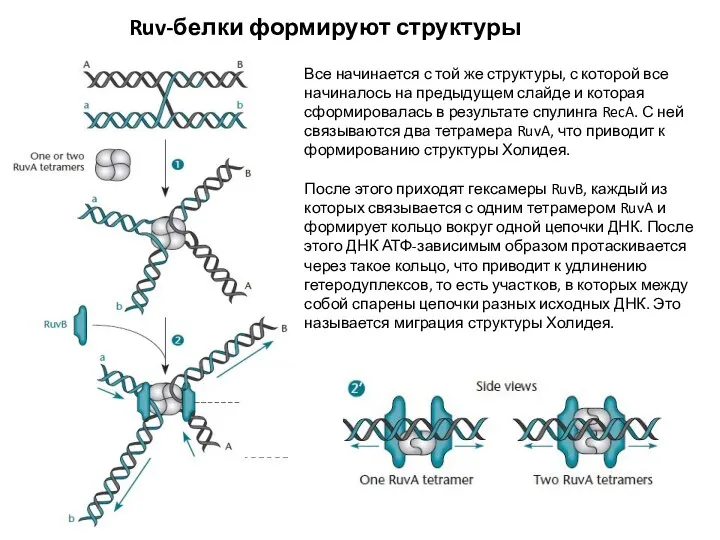
- 10. Ruv-белки формируют структуры Холидея Все начинается с той же структуры, с которой все начиналось на предыдущем
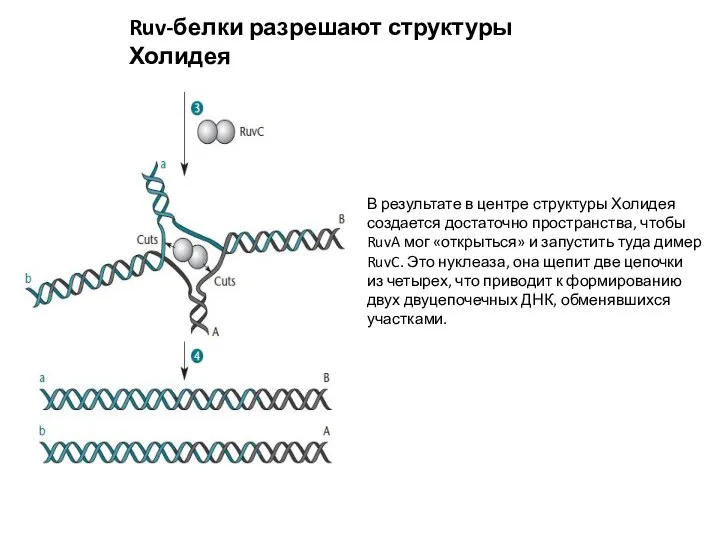
- 11. Ruv-белки разрешают структуры Холидея В результате в центре структуры Холидея создается достаточно пространства, чтобы RuvA мог
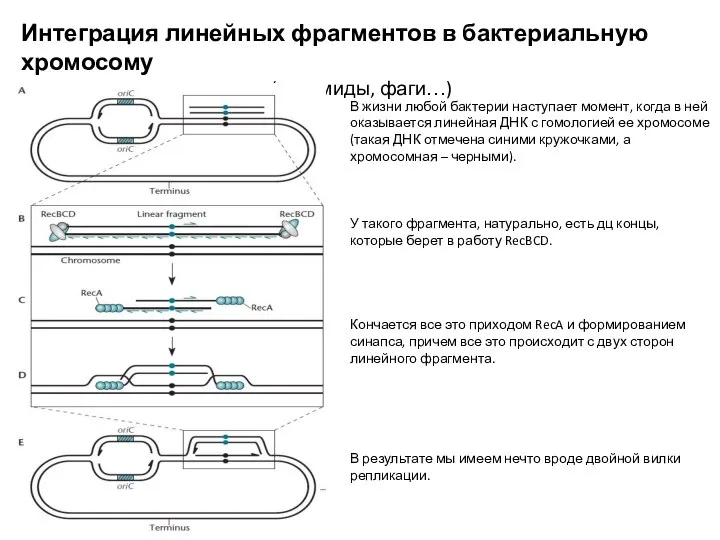
- 12. Интеграция линейных фрагментов в бактериальную хромосому (плазмиды, фаги…) В жизни любой бактерии наступает момент, когда в
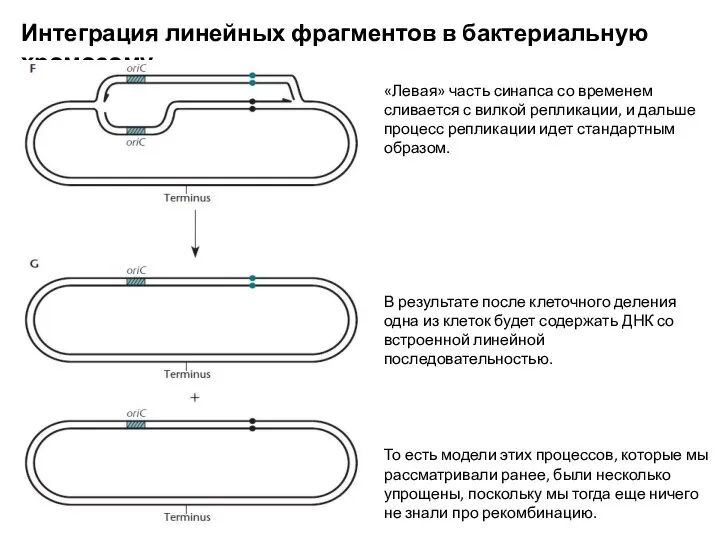
- 13. Интеграция линейных фрагментов в бактериальную хромосому «Левая» часть синапса со временем сливается с вилкой репликации, и
- 14. Репарация ДНК Репарация есть процесс исправления повреждений в ДНК. ДНК подвержена воздействиям многих факторов, среди которых
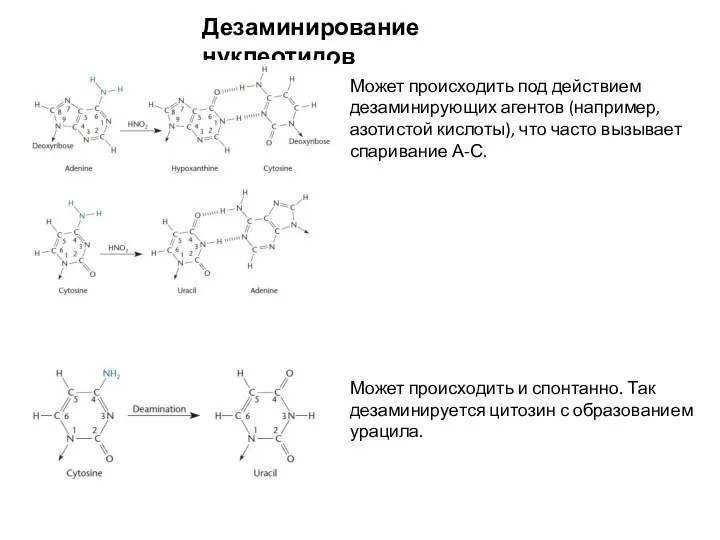
- 15. Дезаминирование нуклеотидов Может происходить под действием дезаминирующих агентов (например, азотистой кислоты), что часто вызывает спаривание А-С.
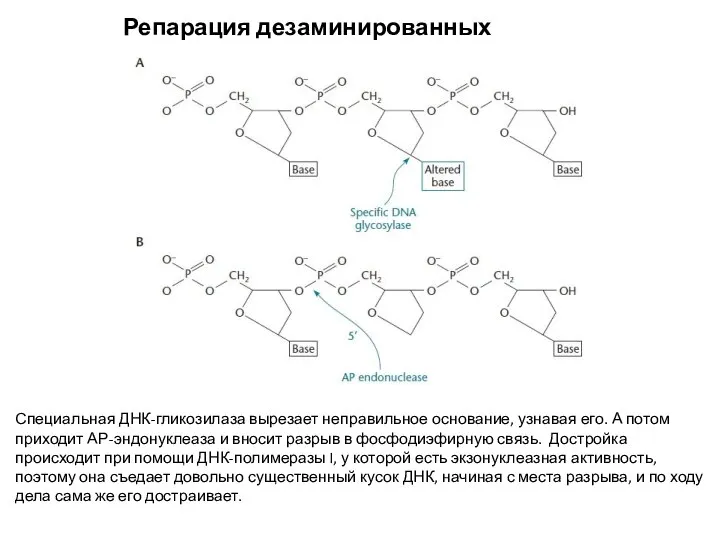
- 16. Репарация дезаминированных нуклеотидов Специальная ДНК-гликозилаза вырезает неправильное основание, узнавая его. А потом приходит АР-эндонуклеаза и вносит
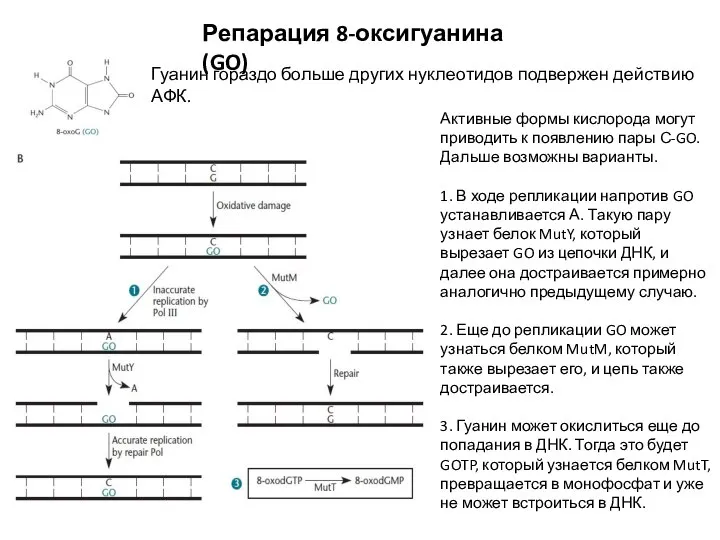
- 17. Репарация 8-оксигуанина (GO) Гуанин гораздо больше других нуклеотидов подвержен действию АФК. Активные формы кислорода могут приводить
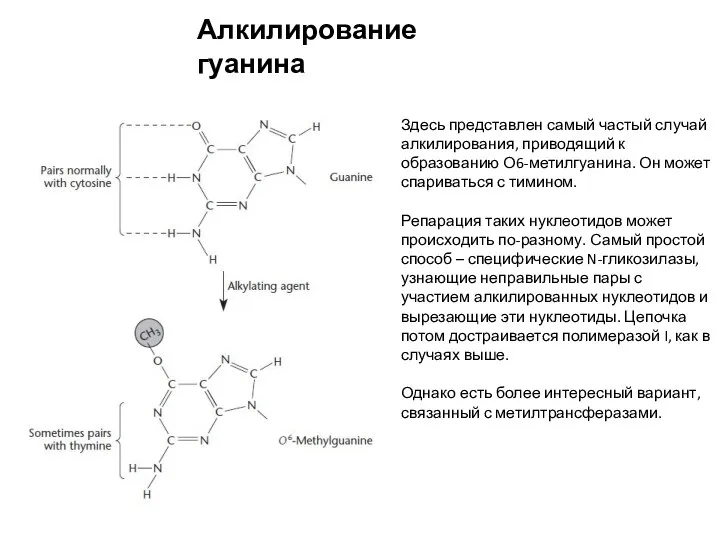
- 18. Алкилирование гуанина Здесь представлен самый частый случай алкилирования, приводящий к образованию О6-метилгуанина. Он может спариваться с
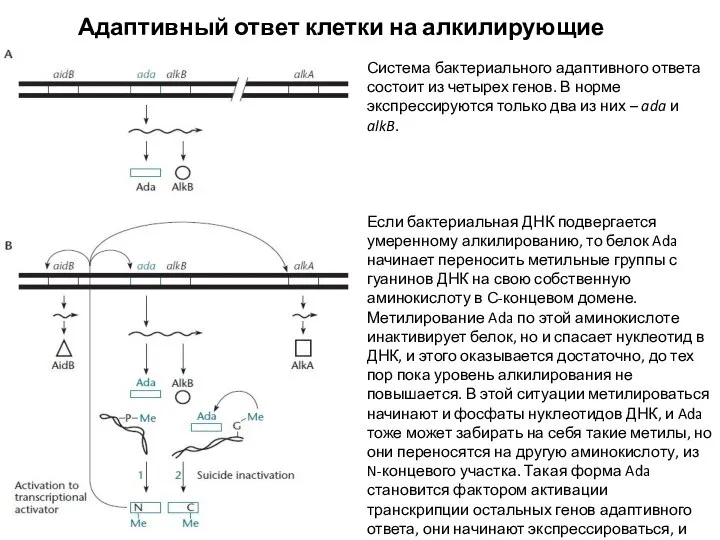
- 19. Адаптивный ответ клетки на алкилирующие агенты Система бактериального адаптивного ответа состоит из четырех генов. В норме
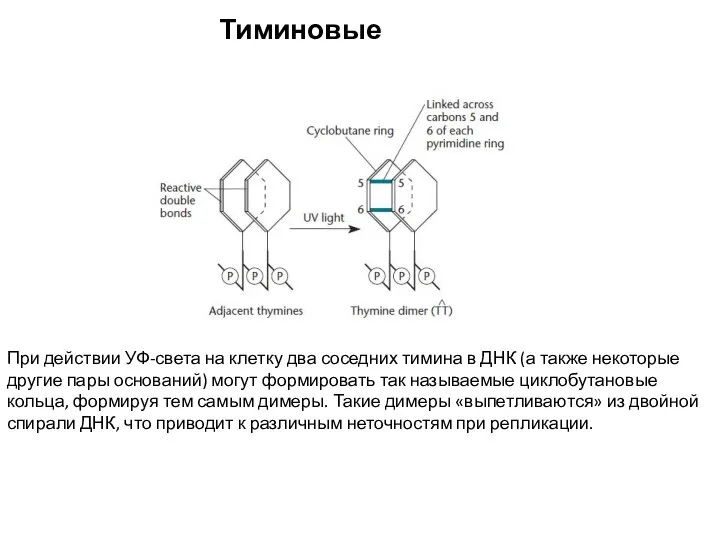
- 20. Тиминовые димеры При действии УФ-света на клетку два соседних тимина в ДНК (а также некоторые другие
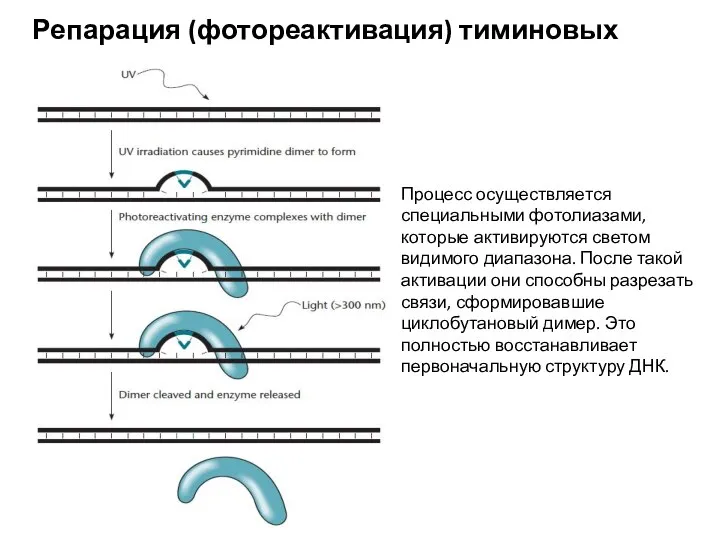
- 21. Репарация (фотореактивация) тиминовых димеров Процесс осуществляется специальными фотолиазами, которые активируются светом видимого диапазона. После такой активации
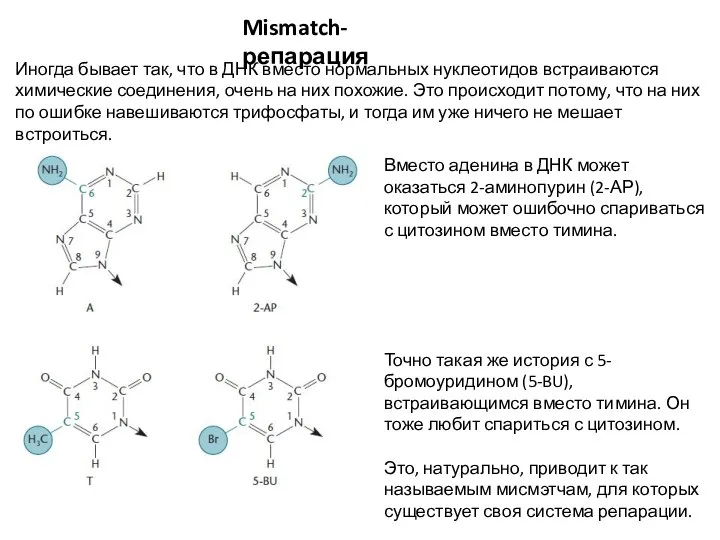
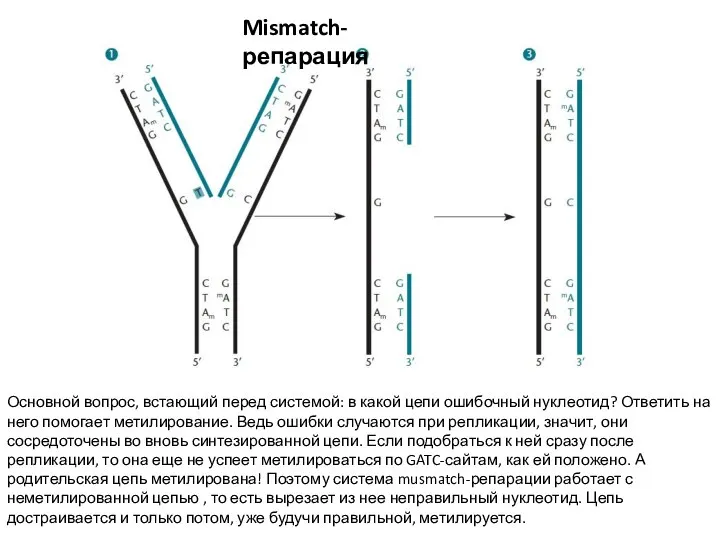
- 22. Mismatch-репарация Иногда бывает так, что в ДНК вместо нормальных нуклеотидов встраиваются химические соединения, очень на них
- 23. Mismatch-репарация Основной вопрос, встающий перед системой: в какой цепи ошибочный нуклеотид? Ответить на него помогает метилирование.
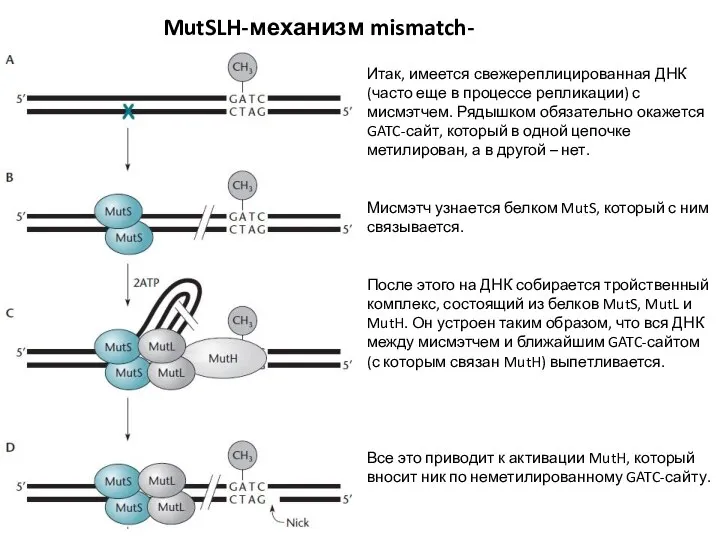
- 24. MutSLH-механизм mismatch-репарации Итак, имеется свежереплицированная ДНК (часто еще в процессе репликации) с мисмэтчем. Рядышком обязательно окажется
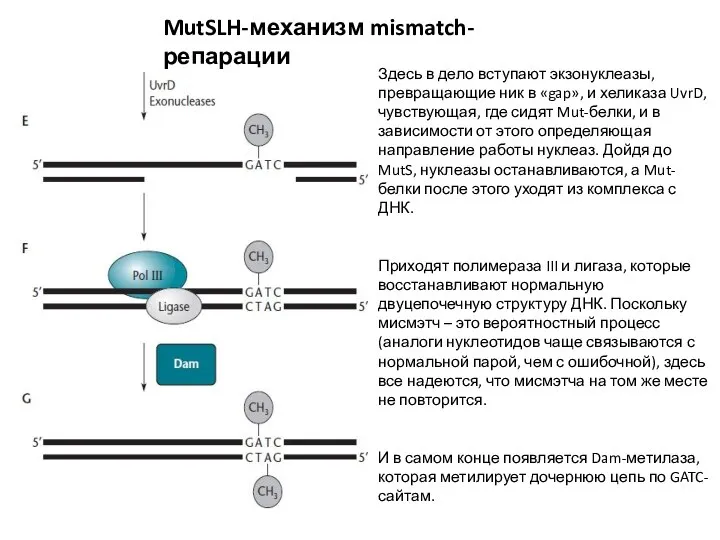
- 25. MutSLH-механизм mismatch-репарации Здесь в дело вступают экзонуклеазы, превращающие ник в «gap», и хеликаза UvrD, чувствующая, где
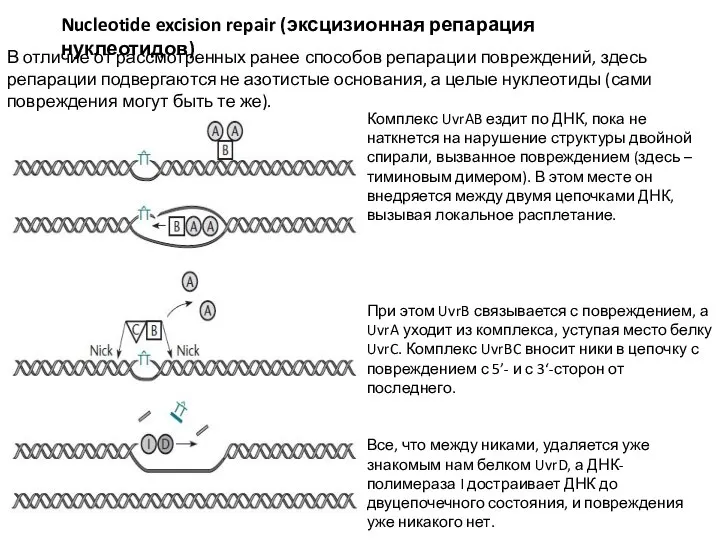
- 26. Nucleotide excision repair (эксцизионная репарация нуклеотидов) В отличие от рассмотренных ранее способов репарации повреждений, здесь репарации
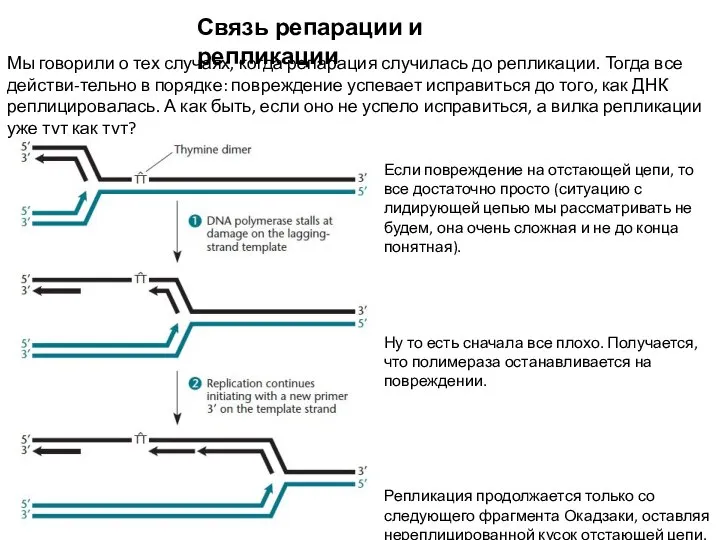
- 27. Связь репарации и репликации Мы говорили о тех случаях, когда репарация случилась до репликации. Тогда все
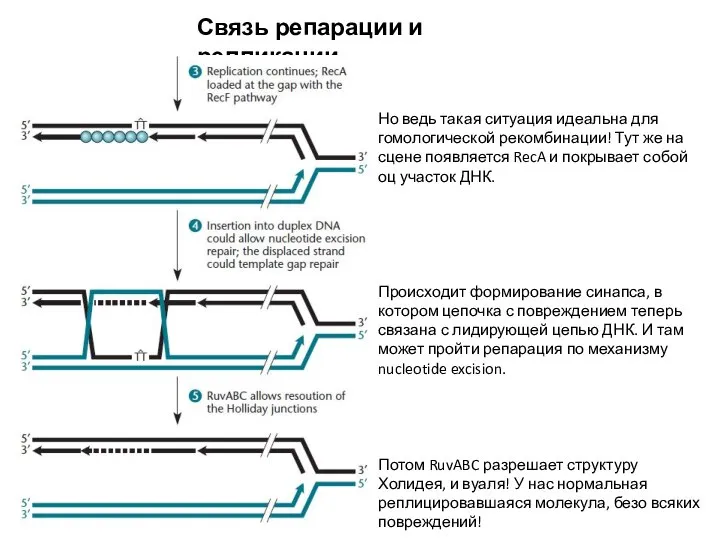
- 28. Связь репарации и репликации Но ведь такая ситуация идеальна для гомологической рекомбинации! Тут же на сцене
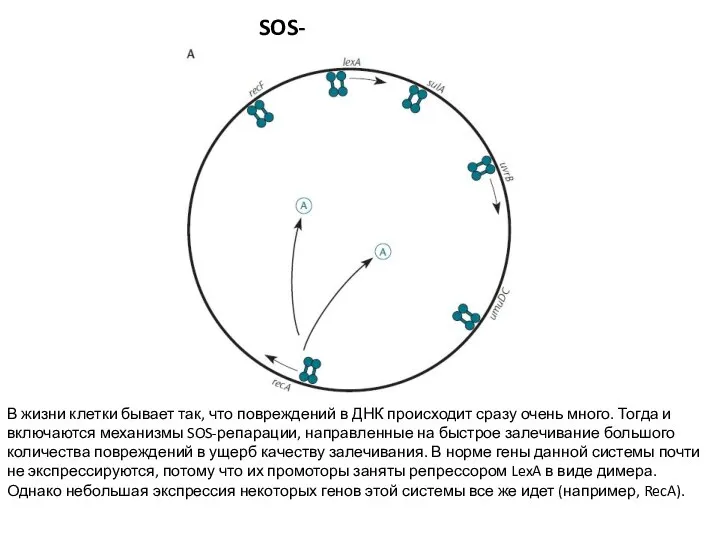
- 29. SOS-репарация В жизни клетки бывает так, что повреждений в ДНК происходит сразу очень много. Тогда и
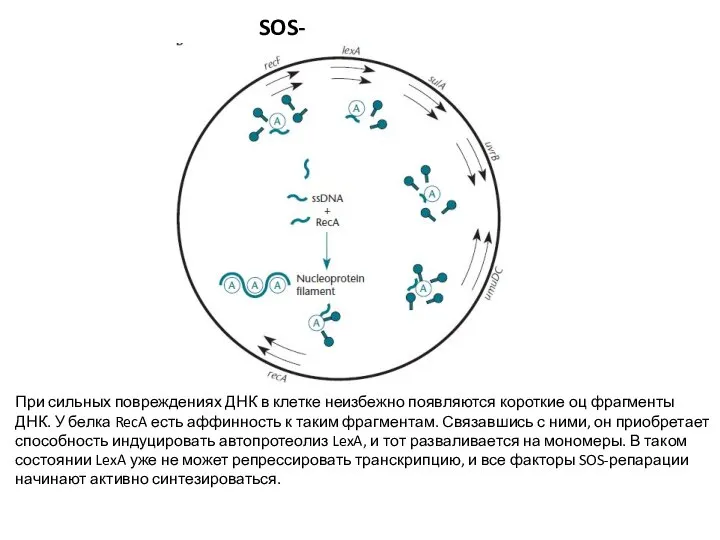
- 30. SOS-репарация При сильных повреждениях ДНК в клетке неизбежно появляются короткие оц фрагменты ДНК. У белка RecA
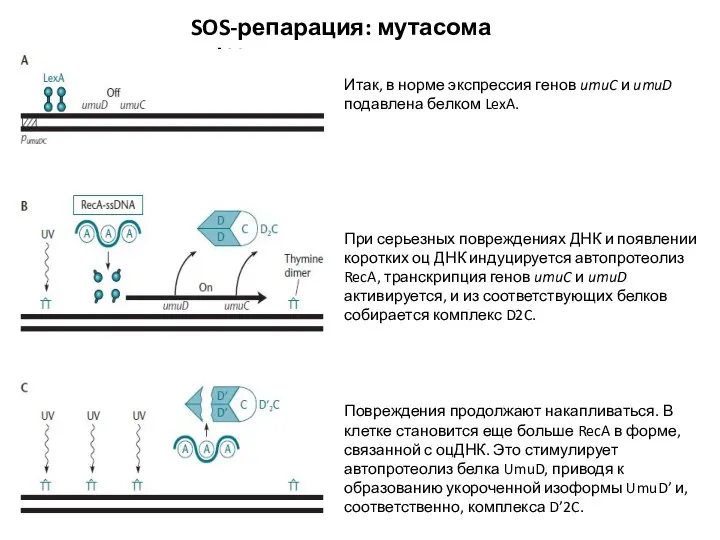
- 31. SOS-репарация: мутасома pol V Итак, в норме экспрессия генов umuC и umuD подавлена белком LexA. При
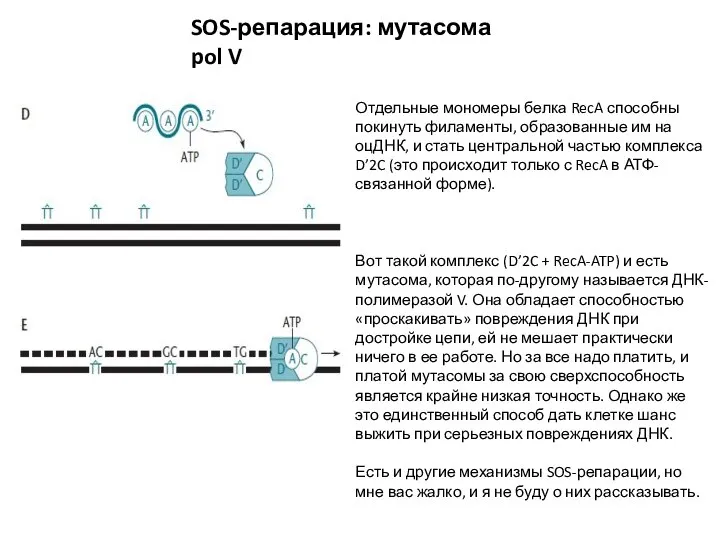
- 32. SOS-репарация: мутасома pol V Отдельные мономеры белка RecA способны покинуть филаменты, образованные им на оцДНК, и
- 34. Скачать презентацию

 Мозг человека
Мозг человека Устройство и подоготовка искуственных вагин
Устройство и подоготовка искуственных вагин Фотосинтез
Фотосинтез Презентация на тему Звук и здоровье человека
Презентация на тему Звук и здоровье человека  Биология - наука о живой природе
Биология - наука о живой природе Анатомические особенности строения человеческого тела
Анатомические особенности строения человеческого тела Ферменты. Высокая каталитическая активность
Ферменты. Высокая каталитическая активность Наука о растениях - ботаника. Царства живых организмов
Наука о растениях - ботаника. Царства живых организмов Размножение
Размножение Роль железа в организме человека
Роль железа в организме человека Углеводы
Углеводы Поділ клітин
Поділ клітин Способы размножения растений
Способы размножения растений Рекорды хвойных растений
Рекорды хвойных растений Задания по биологии (9 класс)
Задания по биологии (9 класс) § 43. Роль кожи в терморегуляции. Закаливание. Оказание первой помощи при тепловом и солнечном ударах 8 класс биология
§ 43. Роль кожи в терморегуляции. Закаливание. Оказание первой помощи при тепловом и солнечном ударах 8 класс биология Строение клетки. Основные части клетки
Строение клетки. Основные части клетки Дыхательная система человекка: строение и функции
Дыхательная система человекка: строение и функции Человек и общество
Человек и общество Ќаптаушы, адсорбциялаушы жјне тітіркендіруші заттар
Ќаптаушы, адсорбциялаушы жјне тітіркендіруші заттар 04. Немембранные и Двумембранные органоиды ЛИЦЕЙ
04. Немембранные и Двумембранные органоиды ЛИЦЕЙ Презентация на тему Удивительные птицы
Презентация на тему Удивительные птицы  Презентация томат, Пенькова Е.В., ПВ 1901
Презентация томат, Пенькова Е.В., ПВ 1901 Особенные водоросли
Особенные водоросли Свойства живых организмов
Свойства живых организмов Птицы водоемов. Проверка
Птицы водоемов. Проверка Internal organs
Internal organs Травоядные млекопитающие животные
Травоядные млекопитающие животные