Слайд 2Структура молекулы инсулина:
Молекула инсулина построена из двух пептидных цепей: цепь А содержит

21 аминокислотный остаток, цепь Б - 30 остатков.
Цепи соединены между собой двумя дисульфидными мостиками.
С инсулином человека наиболее сходен инсулин свиньи, различие имеется лишь в одной позиции: в цепи В, 30-я позиция (С-концевой остаток) - у человека Тре, у свиньи Ала:
Слайд 3Биосинтез инсулина
мРНК содержит 330 нуклеотидов → 110 аминокислот →препроинсулин, состоящий из одной
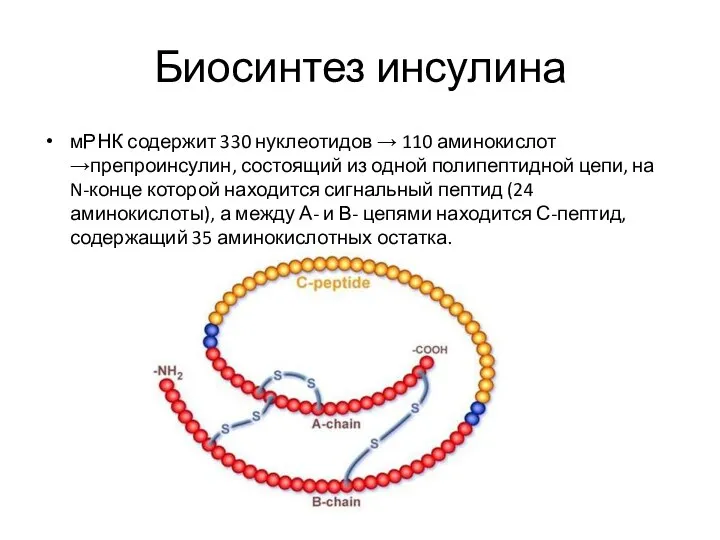
полипептидной цепи, на N-конце которой находится сигнальный пептид (24 аминокислоты), а между А- и В- цепями находится С-пептид, содержащий 35 аминокислотных остатка.
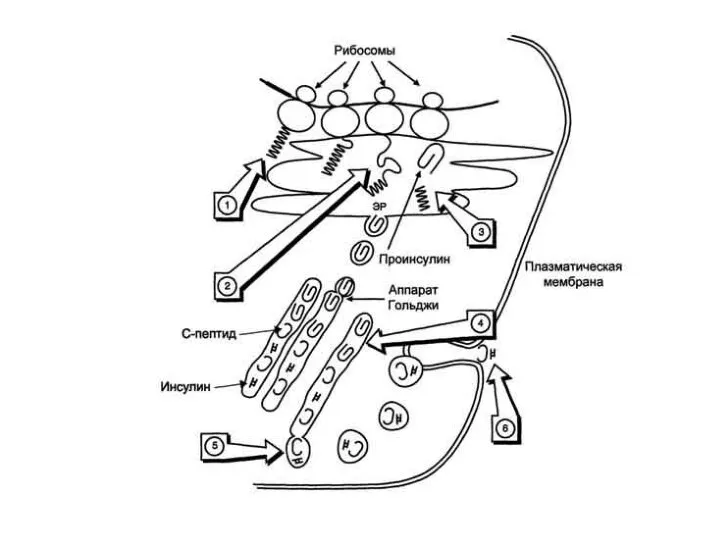
Слайд 4Синтез препроинсулина происходит на полирибосомах, связанных с эндоплазматическим ретикулумом.
Препроинсулин проникает в

люмен ретикулума, где от него отщепляется лидирующая последовательность - N-концевой фрагмент, содержащий 24 аминокислотных остатка.
Образовавшийся проинсулин (86 остатков) перемещается в люмене к аппарату Гольджи, где упаковывается в секреторные гранулы.
Слайд 5В аппарате Гольджи и секреторных гранулах происходит превращение проинсулина в инсулин.
В

этом участвуют две эндопептидазы: прогормон конвертазы 2 и 3 (ПГ2 и ПГ3; последнюю называют также ПГ1). Эти ферменты расщепляют связи Арг32-Глу33 и Арг65-Гли66.
Затем С-концевые остатки Арг и Лиз отщепляются карбоксипептидазой Е (КП-Е; известна также как КП-Н) [Е и Н - лат.]. Этот фермент есть во многих других органах, где участвует в процессинге ряда гормонов и нейромедиаторов.
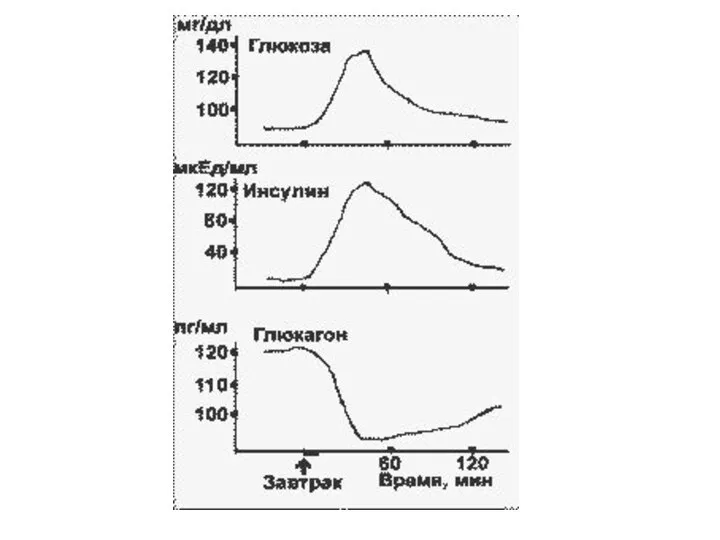
Слайд 7При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, а количество инсулиновой

мРНК в клетке возрастает в результате активации транскрипции и стабилизации мРНК.
Активация транскрипции требует образования метаболитов глюкозы на стадиях гликолиза.
Синтез и секреция инсулина не являются прочно сопряженными процессами. Например, при отсутствии Ca2+ в среде глюкоза не стимулирует секрецию инсулина, в то время как синтез активируется.
Слайд 8Глюкоза стимулирует синтез инсулиновой мРНК при продолжительной инкубации (2 - 72 часа).

При инкубации в течение 1 часа сколько-нибудь существенного увеличения мРНК не происходит, и в то же время включение меченых аминокислот в проинсулин возрастает в 10 - 20 раз.
При этом актиномицин D (ингибитор транскрипции) не подавляет синтез проинсулина. Из этого следует, что первоначальная стимуляция синтеза (в течение примерно 20 минут после добавления глюкозы) происходит с использованием предсуществующей мРНК и регулируется на уровне трансляции.
Слайд 9Секреция инсулина и С-пептида происходит путем экзоцитоза. Инсулин в растворе легко образует

олигомерные агрегаты, преимущественно димеры и гексамеры; ионы цинка способствуют такой агрегации. В такой форме инсулин находится в секреторных гранулах. После секреции содержимого гранул в кровь олигомеры распадаются.
Слайд 10Глюкоза, аминокислоты (особенно аргинин и лизин), кетоновые тела и жирные кислоты в

физиологических концентрациях стимулируют секрецию инсулина, причем стимуляция аминокислотами, кетоновыми телами и жирными кислотами проявляется при определенной (субстимулирующей) концентрации глюкозы.
Лактат, пируват, глицерин не влияют.
Слайд 12Распад инсулина
Время полураспада инсулина в крови - 3-10 мин, С-пептида - около

30 мин.
Кровь при однократном прохождении через печень теряет до 60 % инсулина.
В почках задерживается до 40% инсулина, содержащегося в протекающей через почки крови, причем в клубочках инсулин фильтруется, а затем, наряду с другими белками первичной мочи (альбумин, гемоглобин и др.), реабсорбируется и разрушается в клетках проксимальных канальцев.









 Дополнительная литература по биологии за 6-8 классы
Дополнительная литература по биологии за 6-8 классы Вишня и слива
Вишня и слива Чудесные цветники весной
Чудесные цветники весной Западносибирский речной бобр
Западносибирский речной бобр Царство грибы. Плесневые грибы.
Царство грибы. Плесневые грибы. Здоровье на крыльях пчёл
Здоровье на крыльях пчёл Домики, которые построила природа. ИЗО
Домики, которые построила природа. ИЗО Животные Австралии. Кенгугу
Животные Австралии. Кенгугу Состав и функции белков
Состав и функции белков Презентация на тему ВНУТРЕННЕЕ СТРОЕНИЕ МЛЕКОПИТАЮЩИХ
Презентация на тему ВНУТРЕННЕЕ СТРОЕНИЕ МЛЕКОПИТАЮЩИХ  Структура нейрона. Нейроглия
Структура нейрона. Нейроглия Презентация на тему Природа вокруг нас
Презентация на тему Природа вокруг нас  Мышечная система
Мышечная система Презентация на тему Цветки и плоды
Презентация на тему Цветки и плоды  Агрессия — инстинктивное поведение животных
Агрессия — инстинктивное поведение животных Сможет ли двугорбый верблюд жить в Сахаре?
Сможет ли двугорбый верблюд жить в Сахаре? Праздник чая
Праздник чая Моделирование транспорта питательных веществ в живых организмах. 6 класс
Моделирование транспорта питательных веществ в живых организмах. 6 класс Вирусы. Классификация вирусов
Вирусы. Классификация вирусов Доказательства эволюции
Доказательства эволюции Класс двудольные, семейство крестоцветные
Класс двудольные, семейство крестоцветные Орешниковая соня
Орешниковая соня Агрохимия: влияние минеральных удобрений на рост и развитие культуры томатов
Агрохимия: влияние минеральных удобрений на рост и развитие культуры томатов ЦНС - центральная нервная система
ЦНС - центральная нервная система Тип кольчатые черви. Класс многощетинковые черви
Тип кольчатые черви. Класс многощетинковые черви Возникновение и развитие эволюционных представлений
Возникновение и развитие эволюционных представлений Основы психогенетики. Тема 2
Основы психогенетики. Тема 2 Ложные воспоминания
Ложные воспоминания