Слайд 2I. Аминокислотный состав белков. Классификация аминокислот
Для изучения аминокислотного состава белков используют сочетание

кислотного (НСl), щелочного [Ва(ОН)2]4 и ферментативного гидролиза или одним из этих способов. Таким образом из чистого белка (без примесей) освобождается 20 а-аминокислот (ак), которые являются производными карбоновых кислот, у которых один водородный атом у а-улерода замещен на аминогруппу (-NН2).
Слайд 3Классификация аминокислот основана на полярности радикалов (R), то есть способности к взаимодействию

с водой.
Слайд 4II. Общие свойства аминокислот
Аминокислоты легко растворимы в воде, криталлизуются из нейтральных водных

растворов в форме биполярных (амфотерных) ионов (цвиттерионов).
Имеют оптическую активность, то есть способны вращать плоскость поляризованного луча (исключение: глицин), что связано с наличием в а-положении асимметрического атома углерода, у которого все четыре валентные связи заняты.
Слайд 5III. Физико-химические свойства белков
Свойства белков это высокая вязкость растворов, незначительная диффузия, способность

к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, поглощение УФ-лучей при 280 нм, амфотерность из-за наличия СООН- и NН2- групп, что свидетельствует о наличии свойств кислот и оснований. Белки также обладают гидрофильностью.
Слайд 6А) Молекулярная масса белков
Молекулярная масса белков от 6000 (нижний предел) и более

1000000 в зависимости от количества отдельных полипептидных цепей (субъединиц) в составе единой молекулярной структуре белка.





 Грибы свежие
Грибы свежие Семейство Крестоцветные
Семейство Крестоцветные Органоиды цитоплазмы
Органоиды цитоплазмы Фізічныя ўласцівасці вадкасцей
Фізічныя ўласцівасці вадкасцей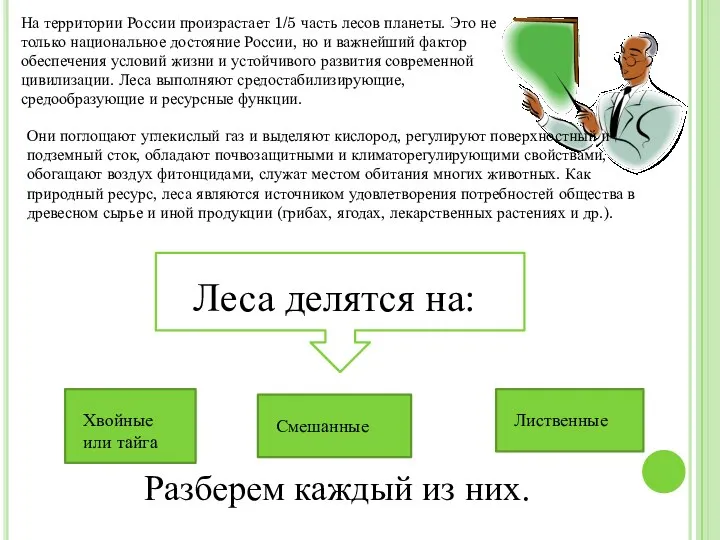 Виды леса
Виды леса Диффузная нервная система. Стрекающие, или книдарии
Диффузная нервная система. Стрекающие, или книдарии Рівні організації
Рівні організації Тип Apicomplexa, класс Sporozoa, подкласс Coccidiomorpha, подкласс Gregarinina
Тип Apicomplexa, класс Sporozoa, подкласс Coccidiomorpha, подкласс Gregarinina Органы растений, участвующие в транспорте веществ Корни и стебель. Ксилема и флоэма
Органы растений, участвующие в транспорте веществ Корни и стебель. Ксилема и флоэма Зимующие птицы
Зимующие птицы 5_lektsia_Obmen_veschestv_i_energii
5_lektsia_Obmen_veschestv_i_energii Урок – игра Семейства класса двудольных
Урок – игра Семейства класса двудольных Структурно-функциональная организация коры большого мозга
Структурно-функциональная организация коры большого мозга Кишечнополостные
Кишечнополостные Плоскости тела человека
Плоскости тела человека Строение нервоной системы
Строение нервоной системы Закономерности наследования признаков
Закономерности наследования признаков Доказательства эволюции органического мира
Доказательства эволюции органического мира Этиология и патогенез. Стресс. Общий адаптационный синдром. Лекция №2
Этиология и патогенез. Стресс. Общий адаптационный синдром. Лекция №2 Рубежка ауылының маңындағы ақселеулі қауымдастықтарының кеңістіктік құрылымы
Рубежка ауылының маңындағы ақселеулі қауымдастықтарының кеңістіктік құрылымы Изучение биологии колониальных птиц на примере береговых ласточек
Изучение биологии колониальных птиц на примере береговых ласточек Презентация на тему Ящерицы
Презентация на тему Ящерицы  Пища. Органы пищеварительной системы
Пища. Органы пищеварительной системы Терек табигать торлелеге. Патшалыклар
Терек табигать торлелеге. Патшалыклар Тюлень Уэдделла
Тюлень Уэдделла 728643
728643 Фибриллярные белки
Фибриллярные белки Углеводы и правильное питание
Углеводы и правильное питание