Содержание
- 2. 2. Определение безвредности и биологической активности на тест-культуре Paramecium caudatum (Патент РФ № 2125261). Данный способ
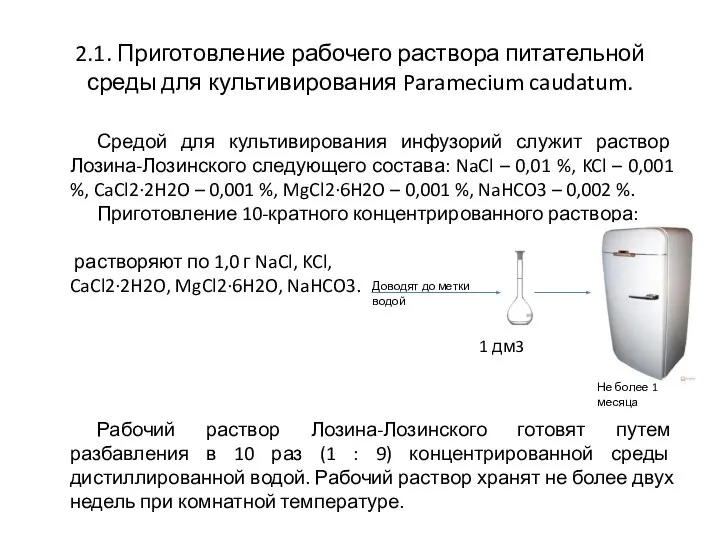
- 3. 2.1. Приготовление рабочего раствора питательной среды для культивирования Paramecium caudatum. Средой для культивирования инфузорий служит раствор
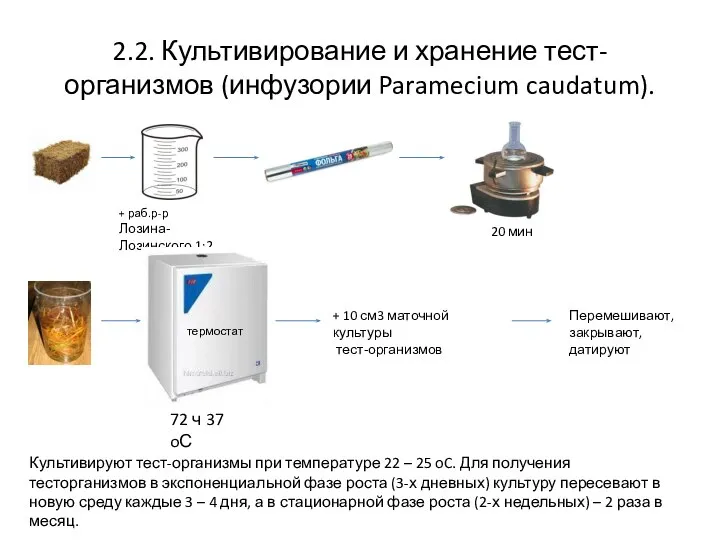
- 4. 2.2. Культивирование и хранение тест-организмов (инфузории Paramecium caudatum). + раб.р-р Лозина- Лозинского 1:2 20 мин термостат
- 5. 2.3. Подготовка пробы проверяемого объекта к исследованию. подсушивают 30 оС 10 г измельчают, просеивают По 0,1
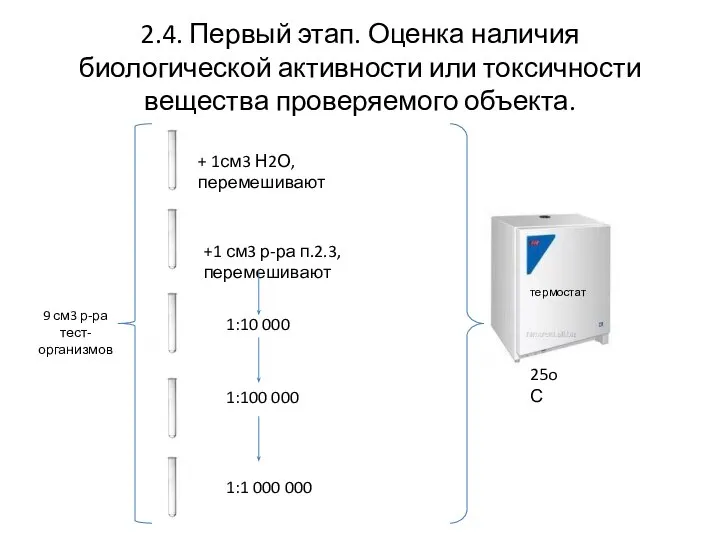
- 6. 2.4. Первый этап. Оценка наличия биологической активности или токсичности вещества проверяемого объекта. 9 см3 р-ра тест-организмов
- 7. Через 0,5, 1,0, 3,0, 6,0 и 24 ч из каждой пробирки берут по 0,1 см3 раствора
- 8. 2.5. Второй этап. Оценка биологической активности вещества проверяемого объекта методом разрешающего воздействия. Сущность метода заключается в
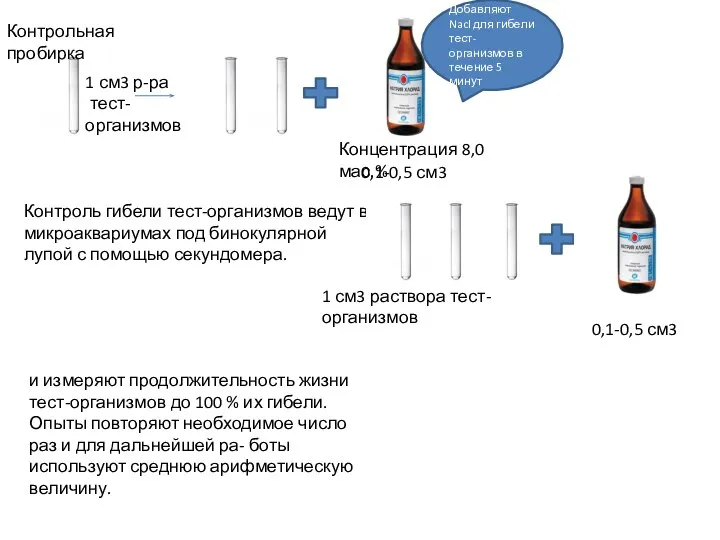
- 9. Контрольная пробирка 1 см3 р-ра тест-организмов Концентрация 8,0 мас.% Добавляют Nacl для гибели тест-организмов в течение
- 10. Индекс биологической активности вещества проверяемого объекта IБА определяют по формуле: Iба=То/Тк где То – продолжительность жизни
- 11. 2.6. Третий этап. Оценка биологической активности вещества проверяемого объекта по интенсивности размножения тест-организмов. Используют тест-организмы в
- 12. Определение плотности инокулята 1,0 см3 раствора 0,2 см3 тщательно перемешивают, заполняют полученным раствором камеру Фукса-Розенталя и
- 13. Предварительно камеру хорошо промывают и просушивают. На поверхность сеток наносят капилляром или пипеткой не- большую каплю
- 15. Скачать презентацию








 Жизненный цикл клетки. Митоз
Жизненный цикл клетки. Митоз Эндокринная система. Гуморальная регуляция
Эндокринная система. Гуморальная регуляция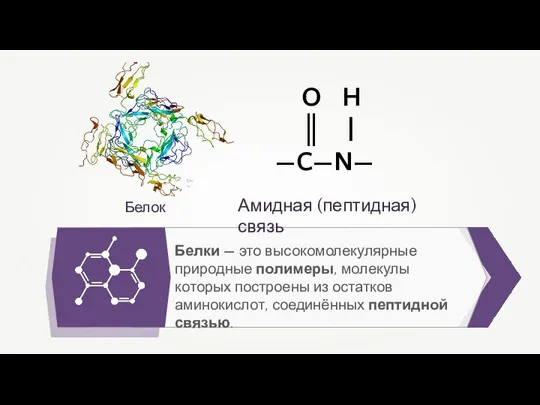 Белки
Белки Млекопитающие. Урок-экскурсия
Млекопитающие. Урок-экскурсия Деревоокрашивающие и плесневые грибы. (Лекция 14)
Деревоокрашивающие и плесневые грибы. (Лекция 14) Зоопсихолог. Зоопсихология
Зоопсихолог. Зоопсихология Ара және құмырсқа. Олардың табиғаттағы маңызы
Ара және құмырсқа. Олардың табиғаттағы маңызы Опорно-двигательная система. Кровеносная система. Дыхательная система. Своя игра
Опорно-двигательная система. Кровеносная система. Дыхательная система. Своя игра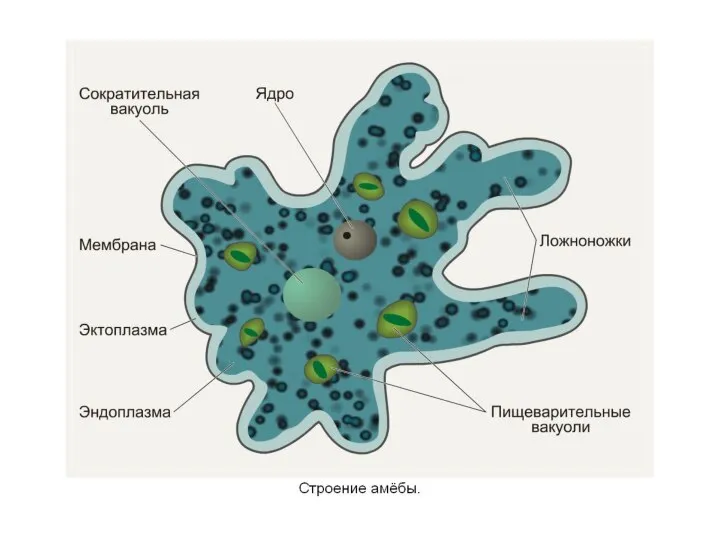 Покровы
Покровы Органы цветковых. Побег
Органы цветковых. Побег
 Класс Земноводные
Класс Земноводные Питание растений. Удобрения 6 класс
Питание растений. Удобрения 6 класс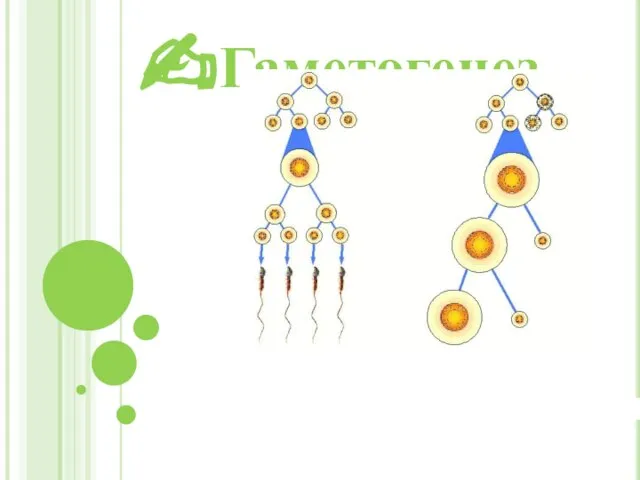 Гаметогенез
Гаметогенез Биохимическое исследование и доказательство наличия полезных химических веществ в ламинарии
Биохимическое исследование и доказательство наличия полезных химических веществ в ламинарии Обеспечение клеток энергией
Обеспечение клеток энергией Наследственная информация и генетический код. Передача генетической информации
Наследственная информация и генетический код. Передача генетической информации Эти удивительные черепахи
Эти удивительные черепахи Экспрессия генов
Экспрессия генов Презентация на тему Для чего свет нужен растениям (6 класс)
Презентация на тему Для чего свет нужен растениям (6 класс)  All truth about AIDS How does HIV drugs works
All truth about AIDS How does HIV drugs works Концепция А.В. Соколова
Концепция А.В. Соколова 11.7 Хромомная теория. Генетика пола. Наследование, сцепленное с полом
11.7 Хромомная теория. Генетика пола. Наследование, сцепленное с полом Как животные передвигаются
Как животные передвигаются Бүршікке,бұтаққа,қабыққа ұластыру жолдарымен вегетативті көбею
Бүршікке,бұтаққа,қабыққа ұластыру жолдарымен вегетативті көбею эволюция пищеварения животных
эволюция пищеварения животных Сонные артерии. Ветви дуги аорты
Сонные артерии. Ветви дуги аорты Селекция (часть 2)
Селекция (часть 2)