Содержание
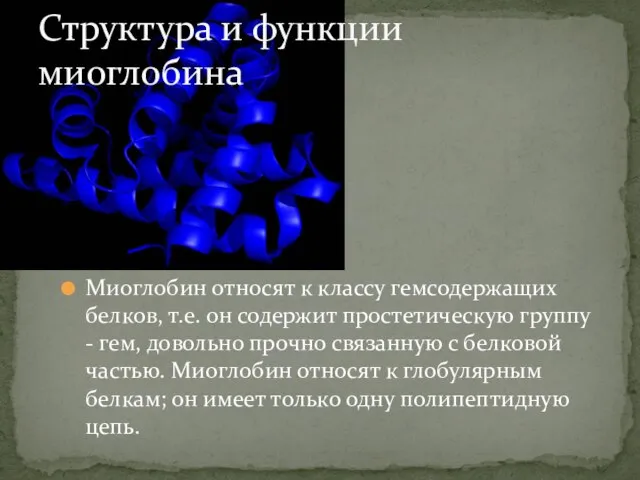
- 2. Миоглобин относят к классу гемсодержащих белков, т.е. он содержит простетическую группу - гем, довольно прочно связанную
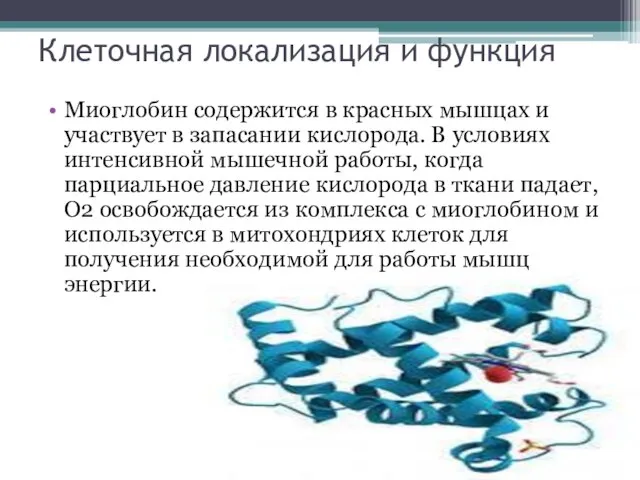
- 3. Клеточная локализация и функция Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях
- 4. Строение миоглобина Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин). Гем - молекула, имеющая структуру
- 5. Миоглобин
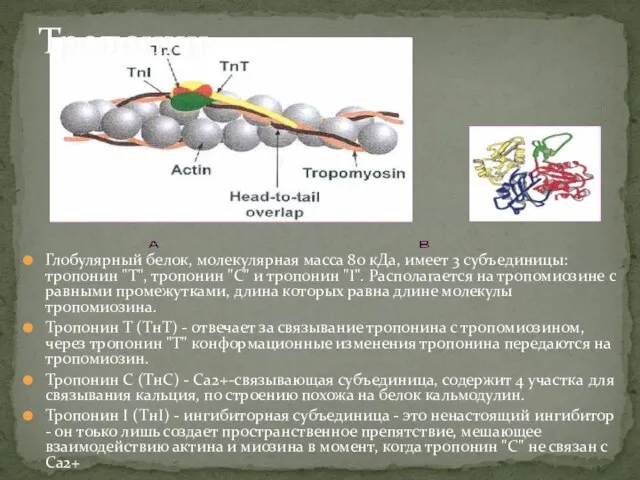
- 6. Глобулярный белок, молекулярная масса 80 кДа, имеет 3 субъединицы: тропонин "Т", тропонин "С" и тропонин "I".
- 7. Тропонин присоединен к белку тропомиозину и расположен в желобке между актиновыми нитями в мышечном волокне. В
- 8. Диагностическое использование Анализ крови на содержание тропонина может быть использован как тест на несколько различных сердечных
- 9. Церулоплазмин Церулоплазмин — медь-содержащий белок (гликопротеин), присутствующий в плазме крови. В церулоплазмине содержится около 95 %
- 10. Церулоплазмин обнаруживается не только в плазме человека и приматов, но и у свиньи, лошади, козы, оленя,
- 11. Клиническое значение Сниженные уровни церулоплазмина отмечаются при болезни Вильсона — Коновалова и болезни Менкеса. В первом
- 12. Гаптоглобин (англ. Haptoglobin, Hp) — белок плазмы крови, с высокой аффинностью связывающий гемоглобин, высвобождающийся из эритроцитов,
- 13. Гаптоглобин относится к белкам острой фазы – вырабатывается в ответ на инфекцию, повреждение, опухолевый процесс. Синтез
- 15. Скачать презентацию







 Красная книга Ростовской области
Красная книга Ростовской области Воробей
Воробей Презентация на тему ЛИЛЕЙНЫЕ И ЗЛАКОВЫЕ РАСТЕНИЯ
Презентация на тему ЛИЛЕЙНЫЕ И ЗЛАКОВЫЕ РАСТЕНИЯ  8- біологія Гуморальна регуляція
8- біологія Гуморальна регуляція Презентация на тему ОРГАНИЗМ ПОБЕЖДАЕТ БОЛЕЗНИ
Презентация на тему ОРГАНИЗМ ПОБЕЖДАЕТ БОЛЕЗНИ  Меласса из тростникового сахара-сырца. Кормовая патока
Меласса из тростникового сахара-сырца. Кормовая патока Биохимия мочеполовой системы
Биохимия мочеполовой системы Атмосферний тиск
Атмосферний тиск Нуклеиновые кислоты. Функции и состав
Нуклеиновые кислоты. Функции и состав Домашние питомцы: кошечки, собачки
Домашние питомцы: кошечки, собачки Мейоз. Сравнение митоза и мейоза
Мейоз. Сравнение митоза и мейоза Фотосинтез
Фотосинтез Лишайники
Лишайники Крабы. Тип Членистоногие, класс Ракообразные
Крабы. Тип Членистоногие, класс Ракообразные Төрт түліктің бірі – түйе және оның қасиеті
Төрт түліктің бірі – түйе және оның қасиеті Ткани. Животные ткани
Ткани. Животные ткани Железо в составе гемоглобина: особенности усвоения и обменные процессы в организме
Железо в составе гемоглобина: особенности усвоения и обменные процессы в организме Витамины в питании человека
Витамины в питании человека Красная книга России
Красная книга России Përçuarja e ujit nëpër bimë
Përçuarja e ujit nëpër bimë Zoo is the preservation of animal life or is it a prison for them
Zoo is the preservation of animal life or is it a prison for them Жизненный цикл растения, систематика
Жизненный цикл растения, систематика Видовое разнообразие птиц с позиции идиоадаптации
Видовое разнообразие птиц с позиции идиоадаптации Популяции. Генофонд
Популяции. Генофонд Анатомия сердца
Анатомия сердца Разнообразие растительного и животного мира России
Разнообразие растительного и животного мира России Видоизменения листьев
Видоизменения листьев Такие удивительные пауки
Такие удивительные пауки