Содержание
- 2. Молекулярная биология – цель, задачи и связь с другими отраслями биологии, химии, физики. МБ - отрасль
- 3. Истоками молекулярной биологии являются: органическая химия, занимающаяся изучением химической структуры макромолекул; биохимия, целью которой является изучение
- 4. Исключит-ное внимание привлекают в наст. время 2 осн. класса макромолекул - белки и нуклеиновые кислоты: Белкам
- 5. 2.Доказательства генетической функции ДНК и РНК. Структура нуклеотидов. Принцип комплементарности. История изучения нуклеиновых кислот начинается с
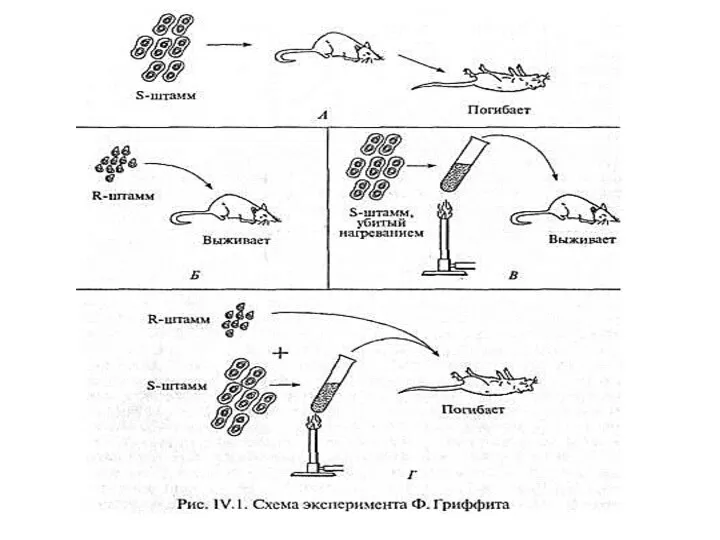
- 6. 1. Английский. бактериолог Ф.Гриффит (1928) продемонстрировал следующий опыт: способность пневмококков к трансформации. Было выдвинуто предполож. о
- 7. Гриффит заключил, что живые микробы непатогенного штамма в присутствии клеток штамма патогенного приобретают наследственно закрепленные св-ва
- 9. О. Звери, К. Мак-Леод и М. Мак-Карти, в 1944 г. точно определили химич. природу «транс-формирующего агента»
- 10. 3. В 1950 г. американский биохимик Э.Чаргафф установил важнейшую закономерность химич. строения ДНК, согласно кот. сумма
- 11. В 1953 г. Дж. Уотсон и Ф. Крик на основании результатов рентгеноструктурного анализа и биохимич. данных
- 12. К настоящему времени : обнаружено, что ДНК мож. повреждаться и мож. восстанавливаться, молекулы ДНК мог. обменив.
- 13. Структура нуклеотидов. Нуклеиновые кислоты – это биологич. высокомолекуляр. полимерн. соединения, мономерами кот. явл. нуклеотиды. Нуклеотиды –
- 14. В нуклеиновых кислотах сахар представлен пентозой. В РНК пентоза является рибозой, а в ДНК – дезоксирибозой.
- 15. Изучая нуклеотидный состав ДНК различ. видов орг-мов, сделали след. выводы: 1. нуклеотидный состав ДНК разн. тканей
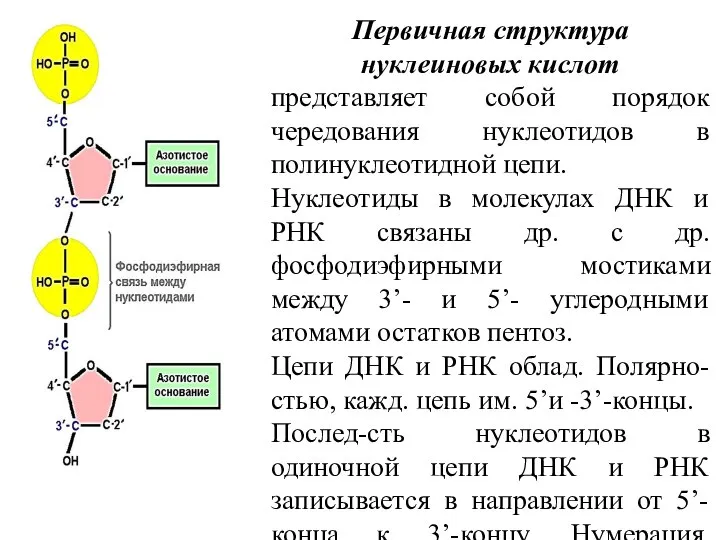
- 16. Первичная структура нуклеиновых кислот представляет собой порядок чередования нуклеотидов в полинуклеотидной цепи. Нуклеотиды в молекулах ДНК
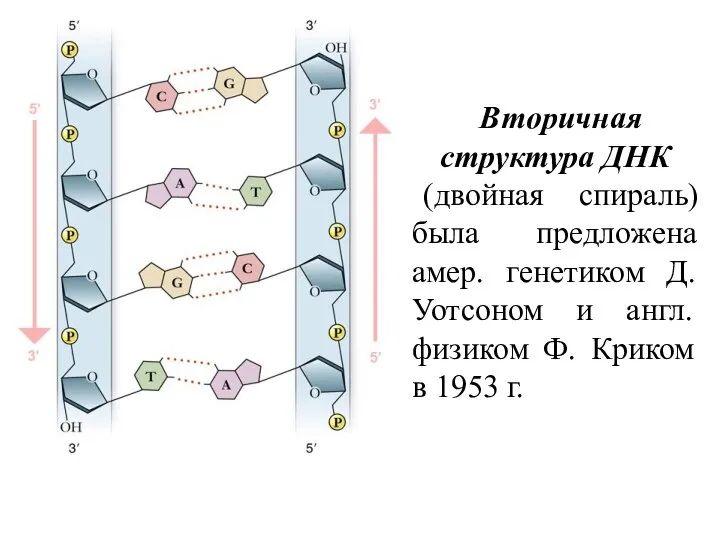
- 17. Вторичная структура ДНК (двойная спираль) была предложена амер. генетиком Д. Уотсоном и англ. физиком Ф. Криком
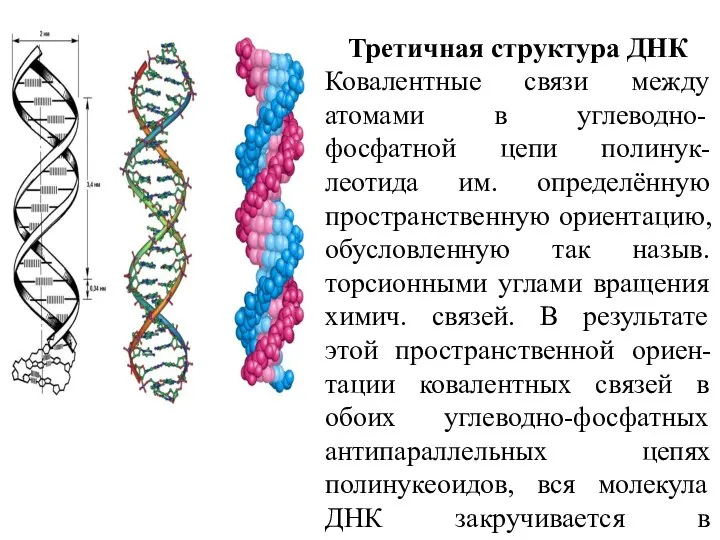
- 18. Третичная структура ДНК Ковалентные связи между атомами в углеводно-фосфатной цепи полинук-леотида им. определённую пространственную ориентацию, обусловленную
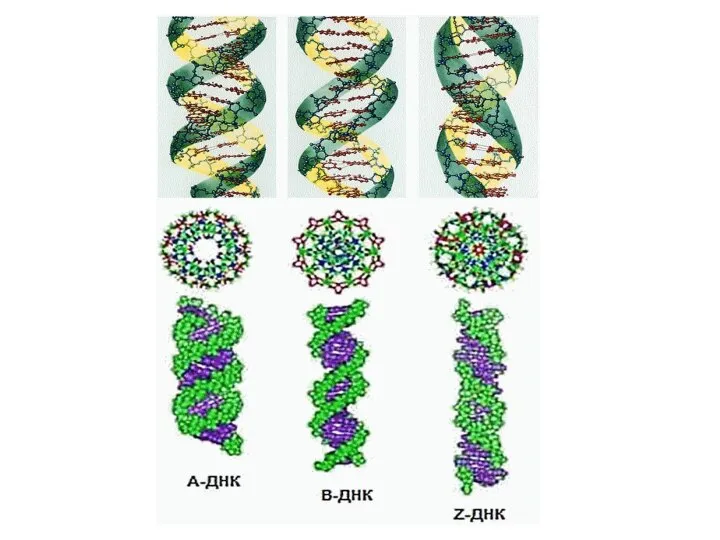
- 19. Формы ДНК А-форма ДНК: двухспиральная ДНК, содержащая прим. 11 остатков на 1 оборот спирали. В этой
- 21. Комплементарность – это пространственная взаимодополняемость молекул или их частей, приводящая к образованию водородных связей. Комплементарность каждой
- 22. Водородные связи, возникающие между пуринами и пиримидинами, удерживают комплементарные полинуклеотидные цепи в системе единой молекулы. Поскольку
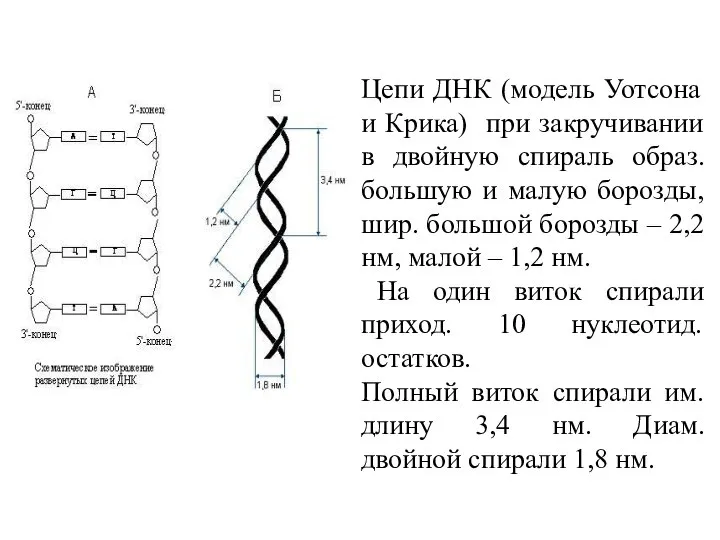
- 23. Цепи ДНК (модель Уотсона и Крика) при закручивании в двойную спираль образ. большую и малую борозды,
- 24. 3. Коды ДНК. Гибкость двойной спирали. В 1954 г. амер. физик-теоретик Г.А. Гамов предпол., что кодирование
- 25. Генетич. код не содержит знаков препинания, и кодирующие триплеты следуют один за другим. Генетич. код явл.
- 26. Характеристика кода: 1. вырожденность (избыточность) - аминок-ты шифруются неск. триплетами. Вырожденность генетич. кода позволяет при мутационной
- 27. однонаправленность считывания (5′→3′), т.е. считывание информации с мРНК при синтезе белка происходит с её 5′-конца в
- 28. 4. Ассоциации ДНК с олигонуклетидами Олигонуклеотид - короткая однонитевая молекула ДНК и РНК (16-30 пар нуклеотидов).
- 29. Триплексы: специфичность образования Часто для прикладных задач необходимо, чтобы олигонуклеотид связался с ДНК в одном или
- 30. Выделяют 3 основных типа ошибок в узнавании олигонуклеотидом двухцепочечной ДНК.: неправильное спаривание в середине сайта, при
- 31. Существует неск. подходов к проблеме неспецифичности связывания олигонуклеотидов. скорость образования специфич. комплексов больше, чем неспецифич., а
- 32. специфичный комплекс еще достаточно стабилен, а неспецифич. уже нет. Напр. при температурах, близких к темпер. плавления,
- 33. Антисмысловой олигонуклеотид (antisense oligonucleotide) - олигонуклеотид, кот. комплементарен фрагменту мРНК, благодаря чему способен образовывать с ней
- 34. Хугстиновское спаривание оснований (Hoogsteen base pairing) (по им. К. Хугстина) - вариация спаривания нуклеотидов в нуклеиновых
- 35. В двуспиральных структурах таких пар не обнаружено, однако не исключается возможность образования тройных спиралей, в кот.
- 36. ДНК: H-форма H-форма ДНК – неканонич. структура в гомопурин- гомопиримидиновых участках ДНК. В нач. 80-х годов
- 37. Кроме того используют методы: Двумерный электрофорез H-формы ДНК H-форма ДНК модели с помощью зондирования различными химическими
- 38. 5. Ассоциация ДНК с белками Транскрипционные факторы: Принципы классификации Специфич-сть взаимодействия транскрип-ционных факторов с распознаваемыми ими
- 39. ДНК-связывающих доменов разделены на 4 суперкласса: Суперкласс 1. Факторы, ДНК-связывающий домен кот. обогащен положит-но заряженными аминок-тными
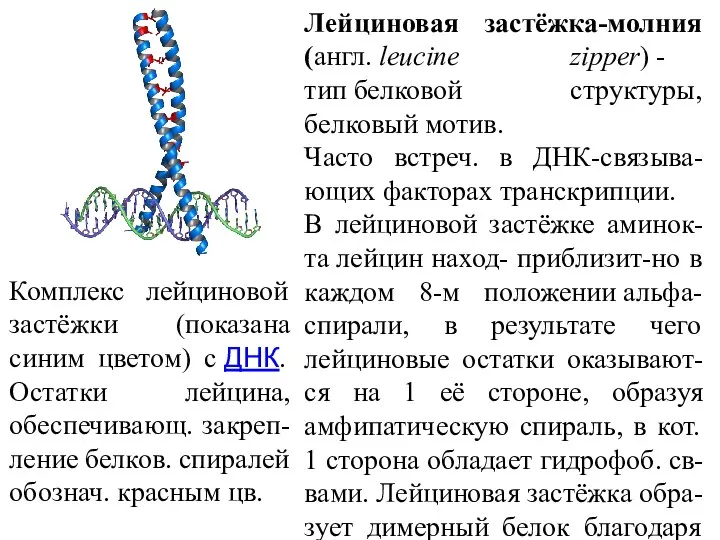
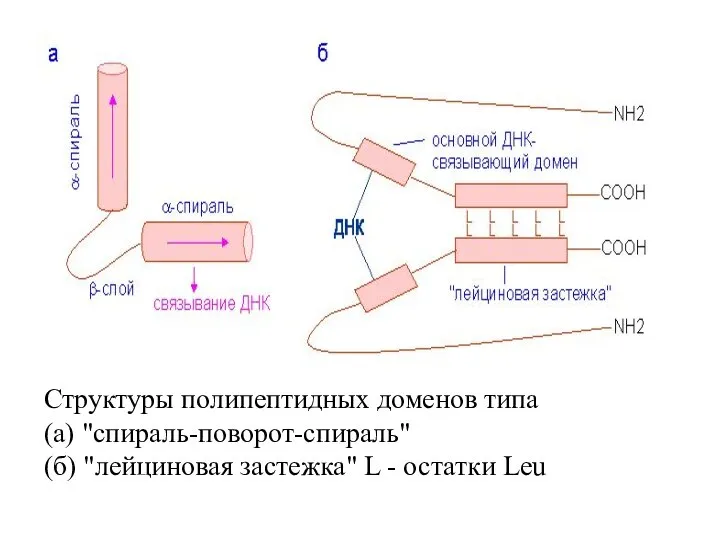
- 40. Комплекс лейциновой застёжки (показана синим цветом) с ДНК. Остатки лейцина, обеспечивающ. закреп-ление белков. спиралей обознач. красным
- 41. Цинковый палец (от. англ. цинк. палец) - тип белковой структуры, небольш. белковый мотив, или одним стабилизированный
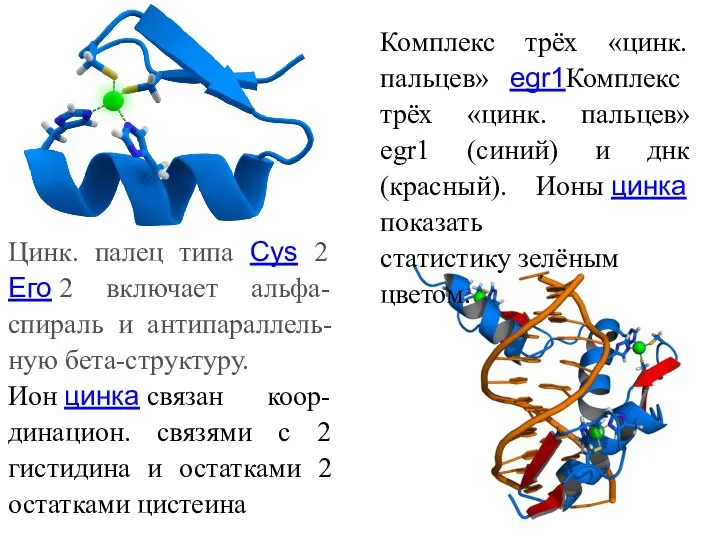
- 42. Цинк. палец типа Cys 2 Его 2 включает альфа-спираль и антипараллель-ную бета-структуру. Ион цинка связан коор-динацион.
- 43. Факторы транскрипции с доменом "спираль-поворот-спираль» Тип пептидных доменов, специфически распознающих регуляторные послед-сти на ДНК, характерен для
- 44. Структуры полипептидных доменов типа (а) "спираль-поворот-спираль" (б) "лейциновая застежка" L - остатки Leu
- 45. Транскрипционные факторы: краткое определение Факторы транскрипции (transcription factors) - белки или белковые комплексы, непосредственно не участвующие
- 46. По функциональному признаку различают три класса транскрипционных факторов: а) основные, обеспечивающие нерегулируемый базальный уровень транскрипции и
- 47. Транскрипционный фактор – это белок, кот. после его перемещения в ядро клетки регулирует транскрипцию, специфически взаимодействуя
- 48. Антигены: силы взаимодействия с антителами (электростатическое притяжение) В основе взаимодействия антиген - антитело лежат те же
- 49. 3. Гидрофобные взаимодействия между неполярными гидрофобными группами, обеспечивающие по некоторым оценкам до 50% сродства между антителом
- 50. Организация хроматина эукариот. Вопрос о структурной организации хроматина в интерфазных ядрах далек от своего разрешения. Это
- 51. ХРОМАТИН, нуклеопротеид клеточ. ядра, составл. основу хромосом. В состав X. входят: ДНК (30-40% по массе), гистоны
- 52. Согласно пространств. модели А. Клуга кор-частица выглядит как плоский диск диам. 11 нм, толщ. 5,7 нм,
- 53. Гистоны составляют больш. осн. белков хроматина и находятся примерно в том же кол-ве, что и ДНК.
- 54. Гистоны первых четырех классов им. значит-ное кол-во как кислых, так и основных аминок-т. Поэтому эти белки
- 55. Пятый класс представлен гистонами, оч. богатыми лизином; он сост. из неск. достаточно близко-родственных белков с перекрывающимися
- 56. негистоны - это все др. белки хроматина. Предполагается поэтому, что они облад. большими видовыми и тканевыми
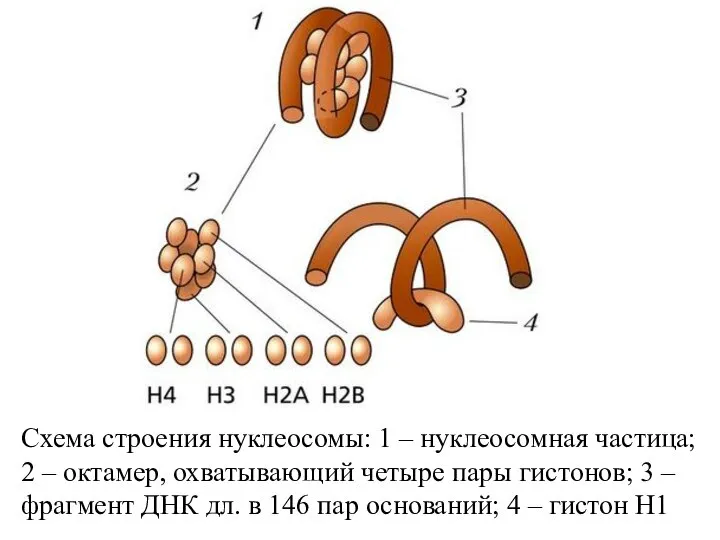
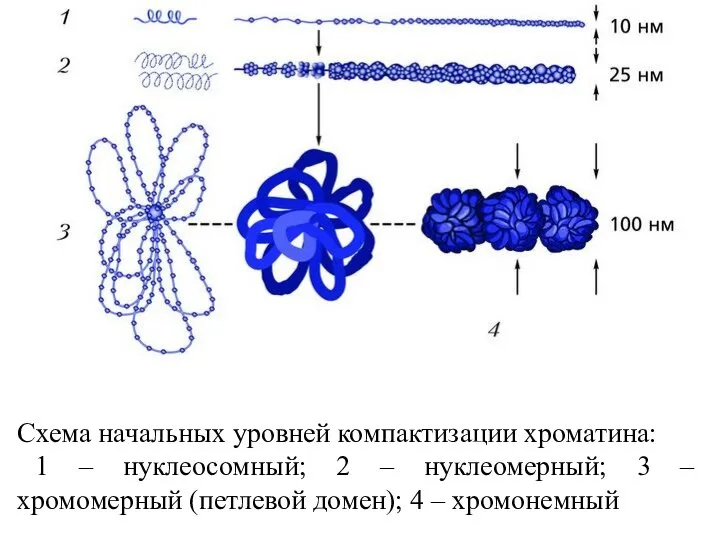
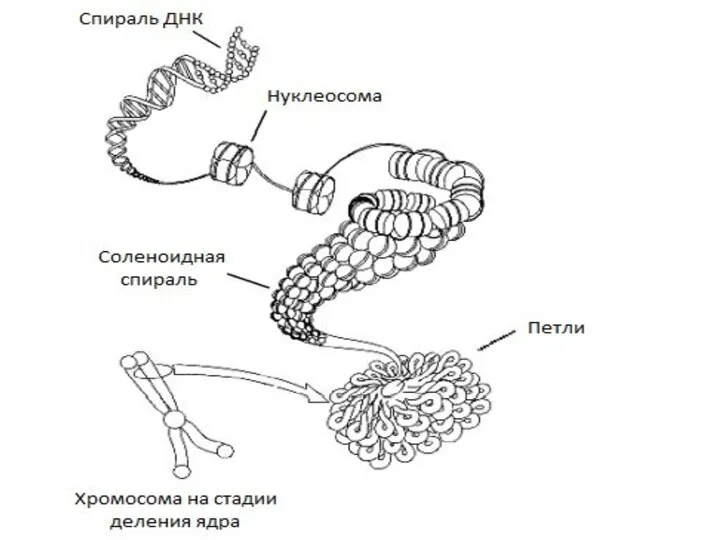
- 57. Упаковка генетич. материала достигается путем спирализации (конденсации) Первый уровень упаковки ДНК - нуклеосомный. Нуклеосома предст. собой
- 58. Третий уровень упаковки - хроматидный (петлевой). Супернуклеосомная нить спирализуется с образованием петель и изгибов. Она составляет
- 59. Схема строения нуклеосомы: 1 – нуклеосомная частица; 2 – октамер, охватывающий четыре пары гистонов; 3 –
- 60. Схема начальных уровней компактизации хроматина: 1 – нуклеосомный; 2 – нуклеомерный; 3 – хромомерный (петлевой домен);
- 62. Сборка нуклеосом 1 способ. обусловлен способностью тетрамера Н32Н42 организовывать ДНК в частицы, которые несколько напоминают минимальную
- 63. Антитела, полученные против этого белка, реагируют с белками нуклеоплазмы многих эукариот. След-но, можно предположить, что этот
- 64. Фейзинг. Терм. "фазирование" обознач. неслучайное располож. нуклеосом относит-но конкретной послед-сти нуклеотидов ДНК в определенных участках генома.
- 65. Во время транскрипции часть нуклеосомных белков остается связанной с ДНК. Нуклеосомы как частицы видны на хроматиновых
- 66. Предлагаются 2 варианта изменения структуры нуклеосом при синтезе РНК: нуклеосома «расщепляется» на 2 полунуклеосомы, а ДНК
- 67. НЕКОДИРУЮЩИЕ РЕГУЛЯТОРНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ Геном животных и человека - сложнейшая система с многоуровневой системой регуляции. Важную роль
- 68. Энхансеры высших эукариот высших эукариот способны активировать гены на больших расст. (до десятков тыс. пар нуклеотидов).
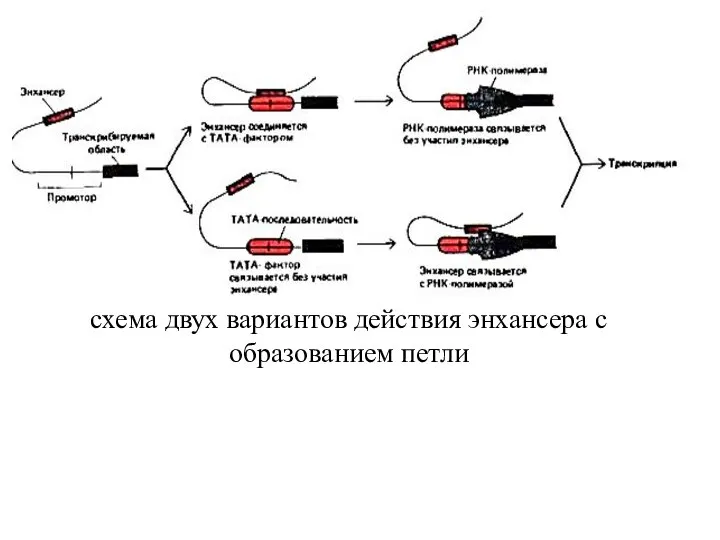
- 69. схема двух вариантов действия энхансера с образованием петли
- 70. Активаторы (Activators) - белки, кот. связываются с энхансерами, кот. помогают РНК-полимеразе правильно начать транскрипцию. Репрессоры (Repressor)
- 71. Транскрипцию нужно не только активировать, но и подавлять. Для этого существуют сайленсеры. Сайленсеры репрессируют активность генов,
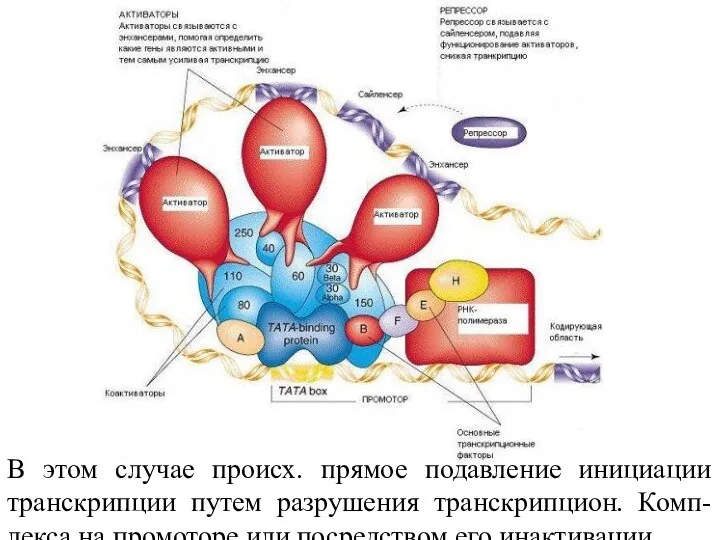
- 72. В этом случае происх. прямое подавление инициации транскрипции путем разрушения транскрипцион. Комп-лекса на промоторе или посредством
- 73. Инсуляторы (англ. insulate - изолировать) - послед-сти ДНК, особ. регуляторные элементы, кот. облад. способ-стью блокир. сигналы,
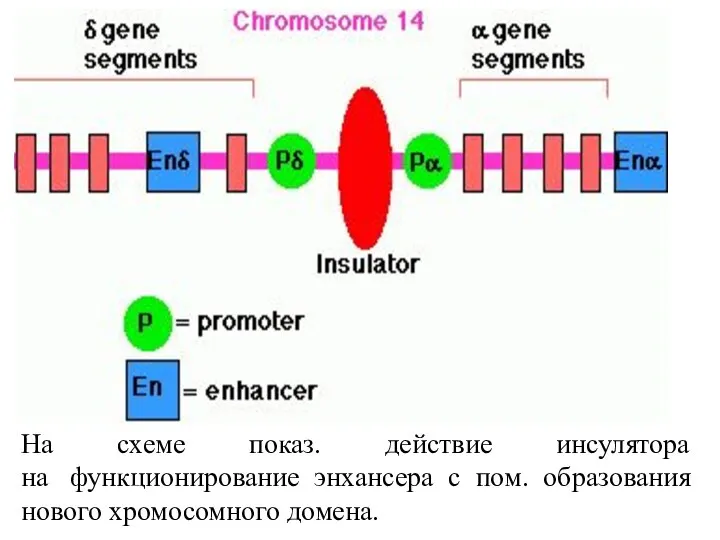
- 74. На схеме показ. действие инсулятора на функционирование энхансера с пом. образования нового хромосомного домена.
- 75. Внутриядерная архитектура хромосом. Явление трансвекции Клетки тела многоклеточ. эукариот им. Диплоид. (двойной) набор хромосом, складывающийся из
- 78. Скачать презентацию



























































 9791 (1)
9791 (1) Виявлення наявності маркерів вірусного гепатиту В у плазмі крові донорів
Виявлення наявності маркерів вірусного гепатиту В у плазмі крові донорів Звери
Звери Вид. Критерии вида
Вид. Критерии вида Зрение. Открытый классный час
Зрение. Открытый классный час Строение мха
Строение мха Синтез систем лабораторного типа
Синтез систем лабораторного типа Флоридская пума
Флоридская пума Основы эндокринологии. Анатомия и физиология человека
Основы эндокринологии. Анатомия и физиология человека Контрастная чувствительность
Контрастная чувствительность Нервная система
Нервная система Общая характеристика типа Кольчатые черви на примере дождевого червя
Общая характеристика типа Кольчатые черви на примере дождевого червя Зрительный анализатор. Урок 13
Зрительный анализатор. Урок 13 Задачи селекции. Методы селекции растений
Задачи селекции. Методы селекции растений БИО КВН: Надкласс рыбы
БИО КВН: Надкласс рыбы Перспективы биотехнологий
Перспективы биотехнологий Головной мозг
Головной мозг Царства живой природы
Царства живой природы Род пихта (abies)
Род пихта (abies) Исследователи природы
Исследователи природы Игра Угадай-ка
Игра Угадай-ка Два типа организмов
Два типа организмов Кошки - наши друзья
Кошки - наши друзья Классификация моллюсков
Классификация моллюсков Анатомо-физиологические особенности органов пищеварения
Анатомо-физиологические особенности органов пищеварения Царство Растения
Царство Растения Растения хлебные и огородные, ягоды и плоды
Растения хлебные и огородные, ягоды и плоды Метаболизм и питание микроорганизмов
Метаболизм и питание микроорганизмов