Содержание
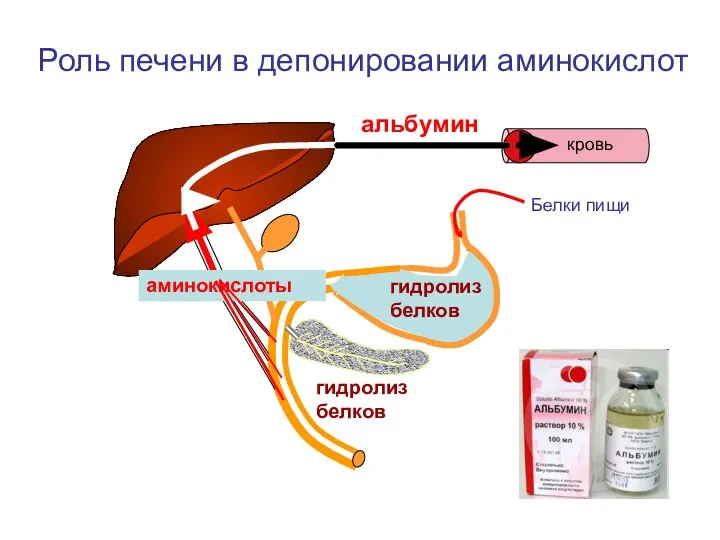
- 2. аминокислоты альбумин Роль печени в депонировании аминокислот гидролиз белков Белки пищи кровь гидролиз белков
- 3. Превращения аминокислот в клетке
- 4. Реакции поликонденсации (биосинтез белков) Реакции трансаминирования Реакции декарбоксилирования Реакции окислительного дезаминирования Все превращения аминокислот можно суммировать
- 5. Биосинтез белка
- 6. Стадии синтеза белка Образование инициирующего комплекса; Элонгация (удлинение полипептидной цепи); Терминация (завершение синтеза); Процессинг (окончательное достраивание
- 7. Для синтеза белка нужна и-РНК кодон кодон кодон кодон кодон -А-Ц-Г-А-У-Г-А-У-Ц-Г-А-У-А-Ц-Г - и-РНК
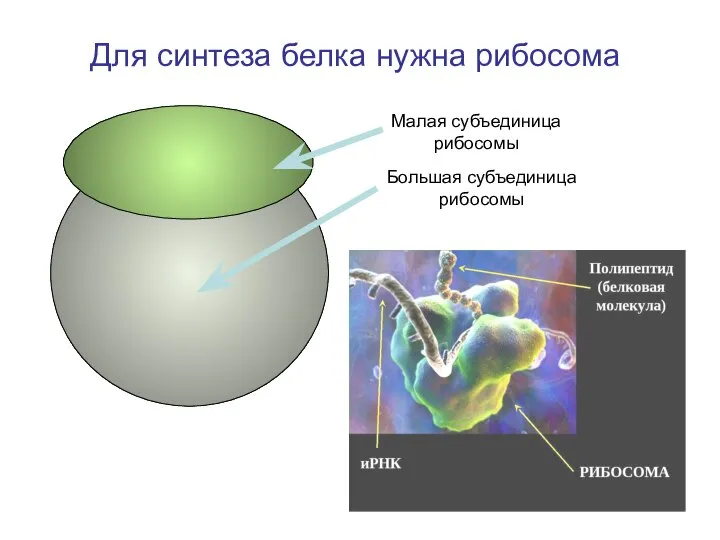
- 8. Для синтеза белка нужна рибосома Большая субъединица рибосомы Малая субъединица рибосомы
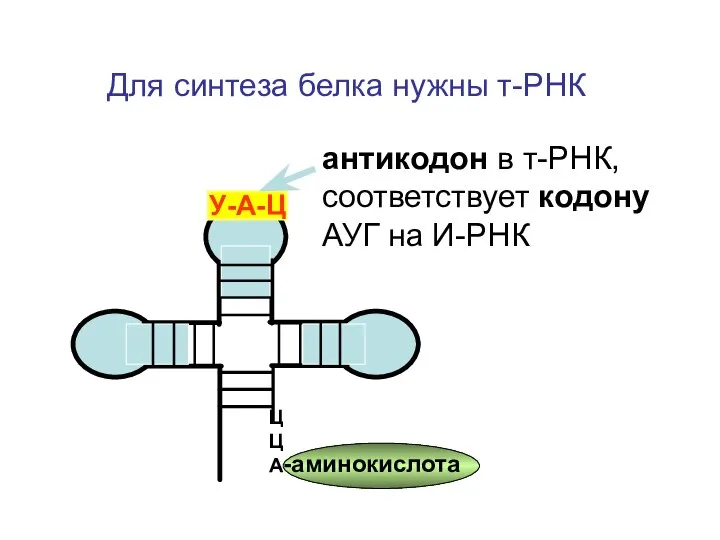
- 9. Для синтеза белка нужны т-РНК ЦЦА -аминокислота У-А-Ц антикодон в т-РНК, соответствует кодону АУГ на И-РНК
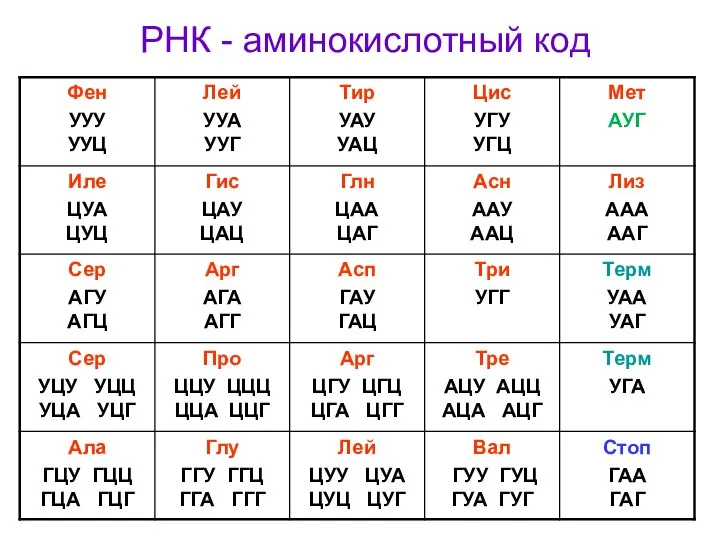
- 10. Все аминокислоты кодируются в виде троек нуклеотидов (кодонов или триплетов). Одна аминокислота может кодироваться одним триплетом
- 11. РНК - аминокислотный код
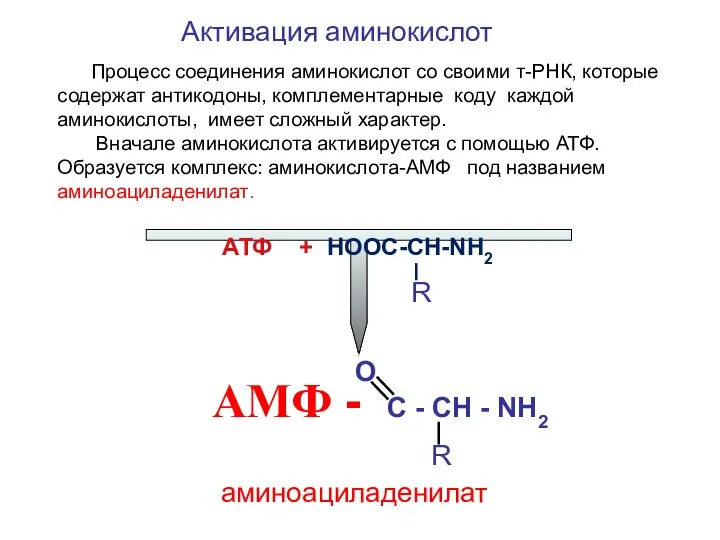
- 12. Активация аминокислот АТФ + НООС-СН-NН2 R O АМФ - C - CH - NH2 R аминоациладенилат
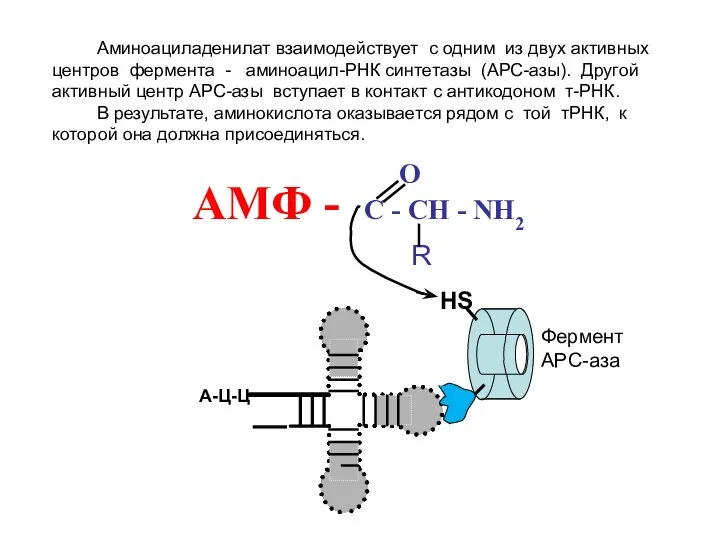
- 13. НS O АМФ - C - CH - NH2 R А-Ц-Ц Фермент АРС-аза Аминоациладенилат взаимодействует с
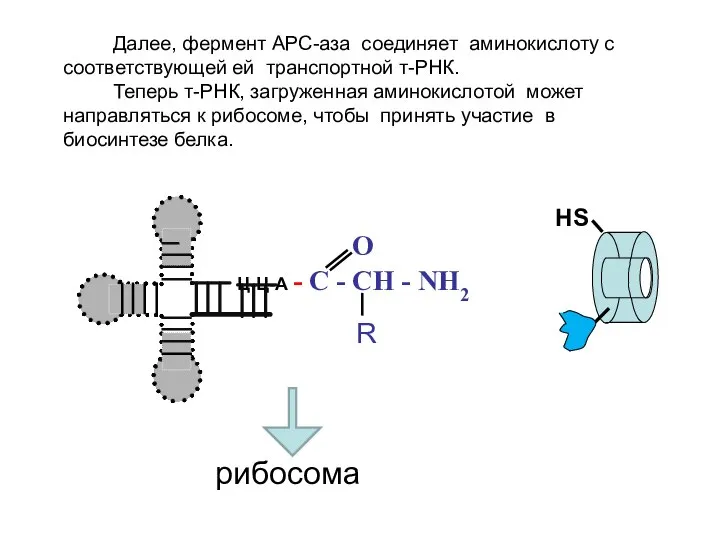
- 14. НS Ц-Ц-А O - C - CH - NH2 R Далее, фермент АРС-аза соединяет аминокислоту с
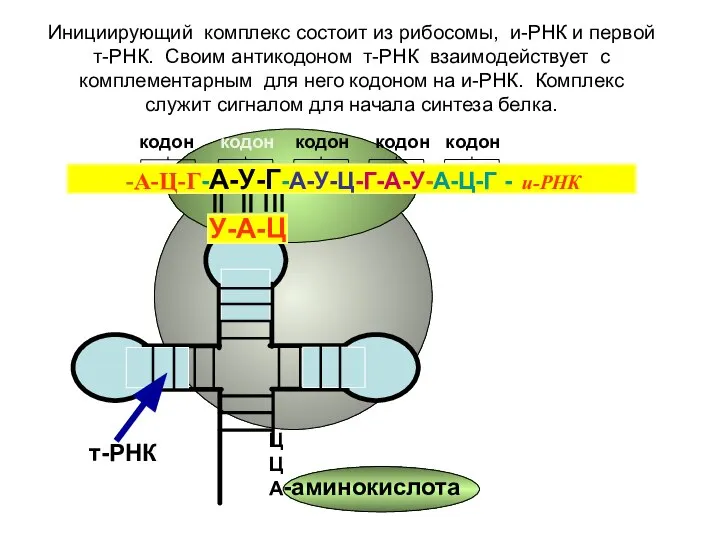
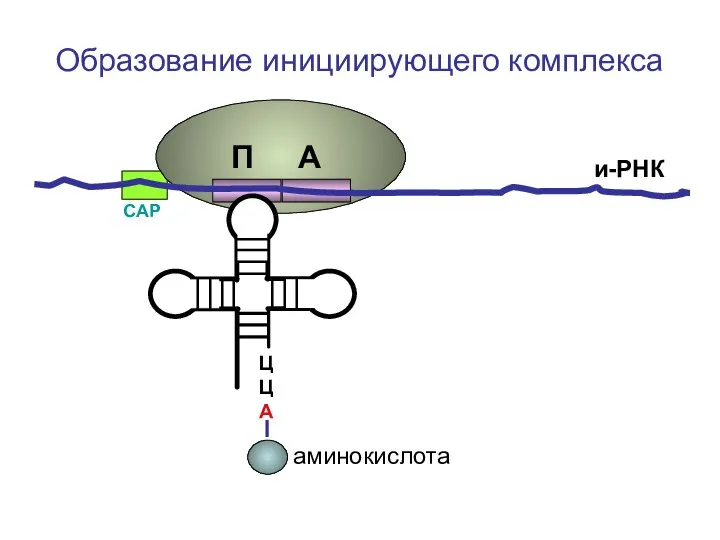
- 15. Образование инициирующего комплекса.
- 16. кодон кодон кодон кодон кодон ЦЦА -аминокислота т-РНК -А-Ц-Г-А-У-Г-А-У-Ц-Г-А-У-А-Ц-Г - и-РНК У-А-Ц Инициирующий комплекс состоит из
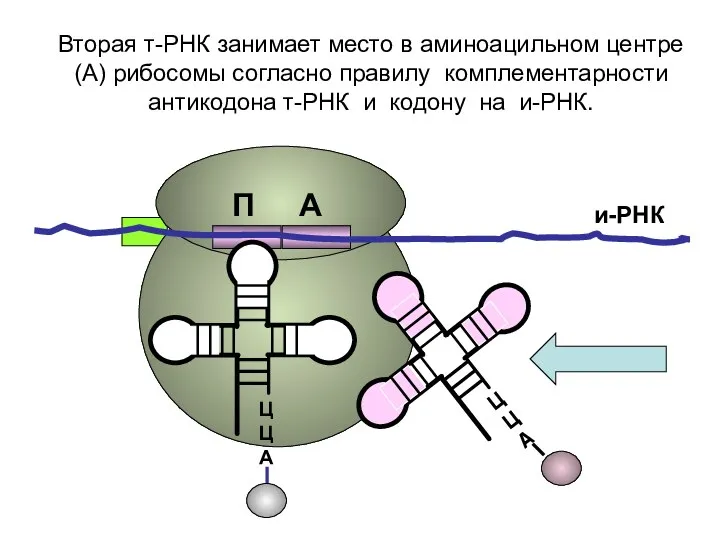
- 17. ЦЦА ЦЦА и-РНК Вторая т-РНК занимает место в аминоацильном центре (А) рибосомы согласно правилу комплементарности антикодона
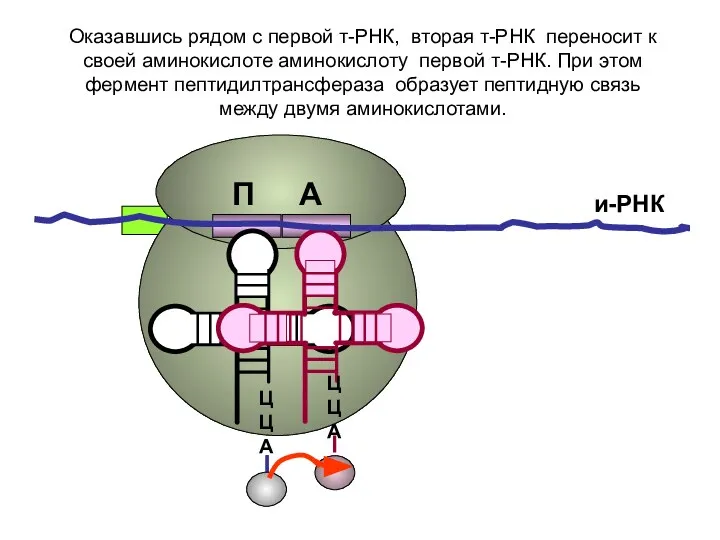
- 18. ЦЦА ЦЦА и-РНК Оказавшись рядом с первой т-РНК, вторая т-РНК переносит к своей аминокислоте аминокислоту первой
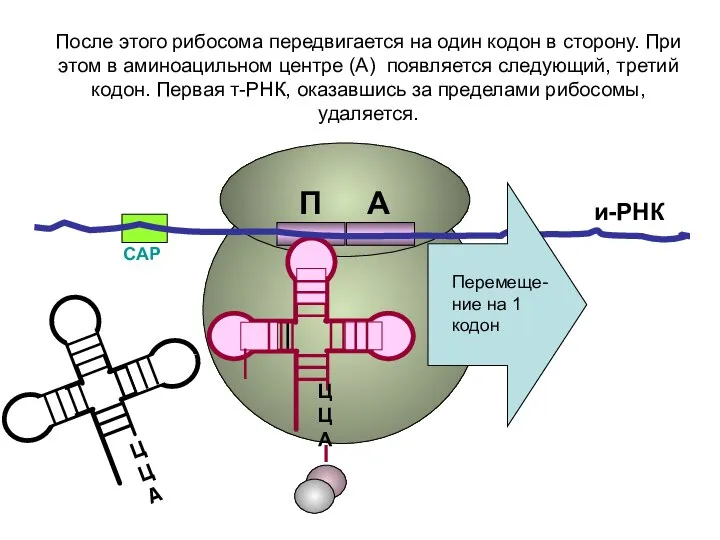
- 19. СAP и-РНК ЦЦА ЦЦА После этого рибосома передвигается на один кодон в сторону. При этом в
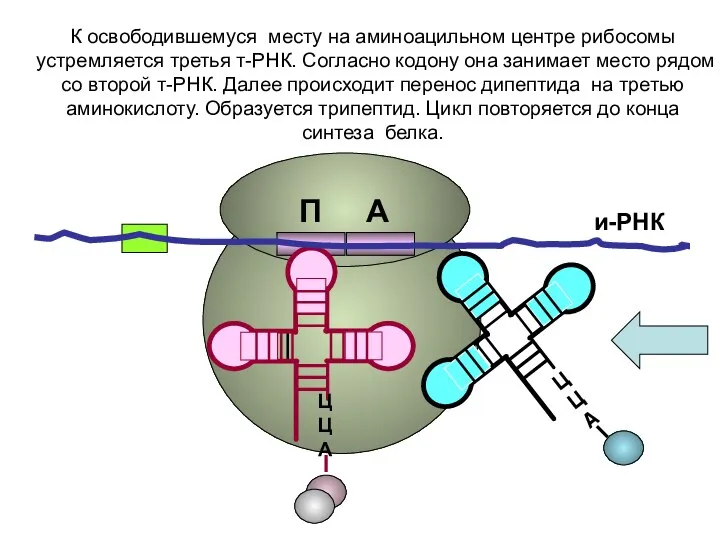
- 20. и-РНК ЦЦА ЦЦА К освободившемуся месту на аминоацильном центре рибосомы устремляется третья т-РНК. Согласно кодону она
- 21. Синтез белка продолжается до тех пор, пока в аминоацильный центр не заходит особый кодон и-РНК, сигнализирующий
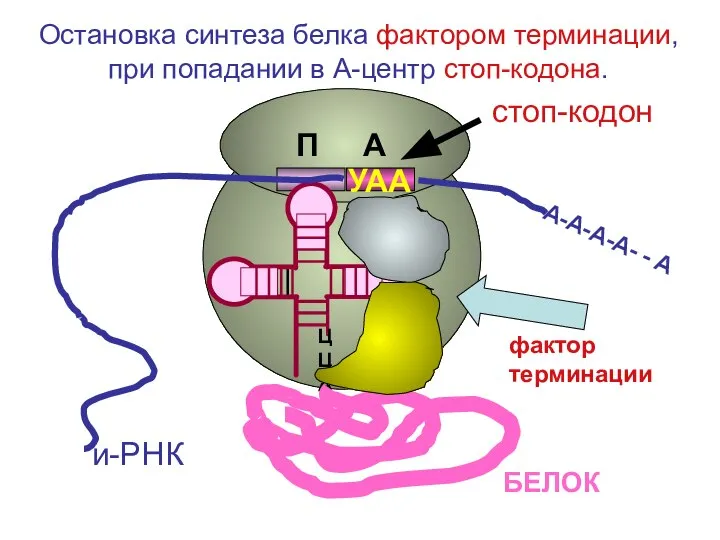
- 22. ЦЦА УАА А-А-А-А- - А и-РНК фактор терминации БЕЛОК стоп-кодон Остановка синтеза белка фактором терминации, при
- 23. Биосинтез белка (мультик)
- 24. ЦЦА Образование инициирующего комплекса и-РНК СAP П А аминокислота
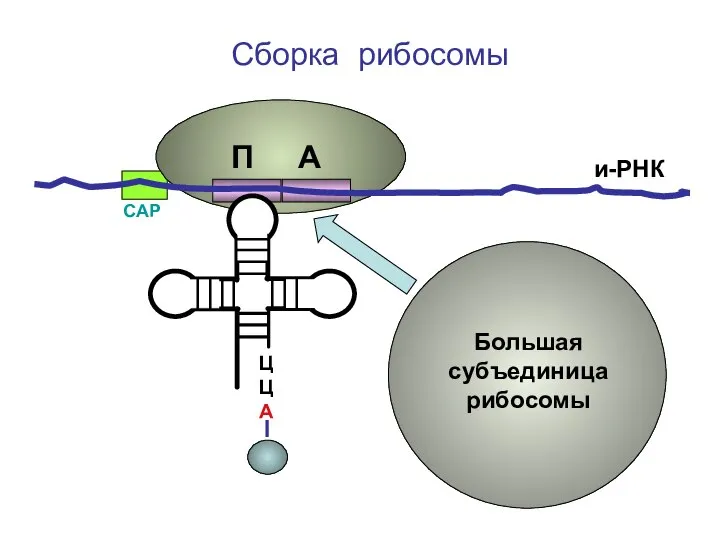
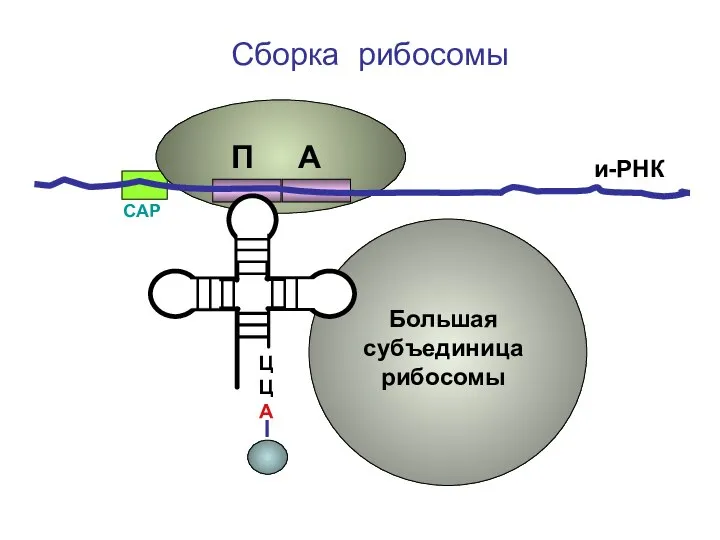
- 25. ЦЦА Сборка рибосомы и-РНК СAP Большая субъединица рибосомы П А
- 26. ЦЦА Сборка рибосомы и-РНК СAP П А
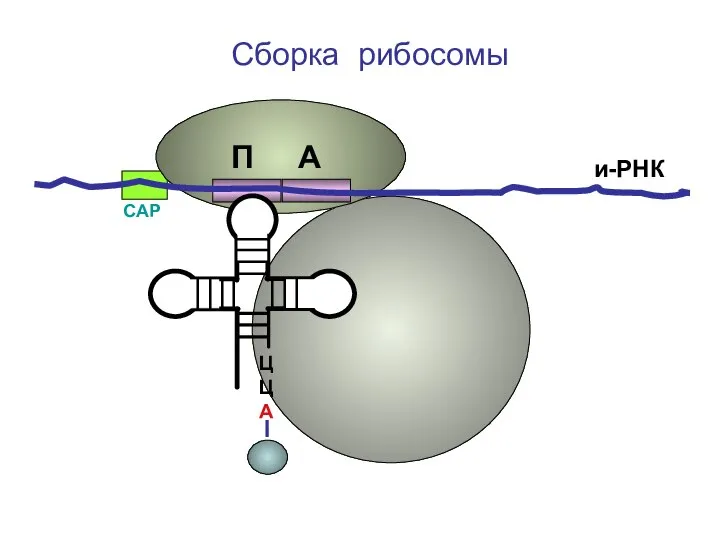
- 27. ЦЦА Сборка рибосомы и-РНК СAP П А
- 28. ЦЦА Сборка рибосомы и-РНК СAP П А
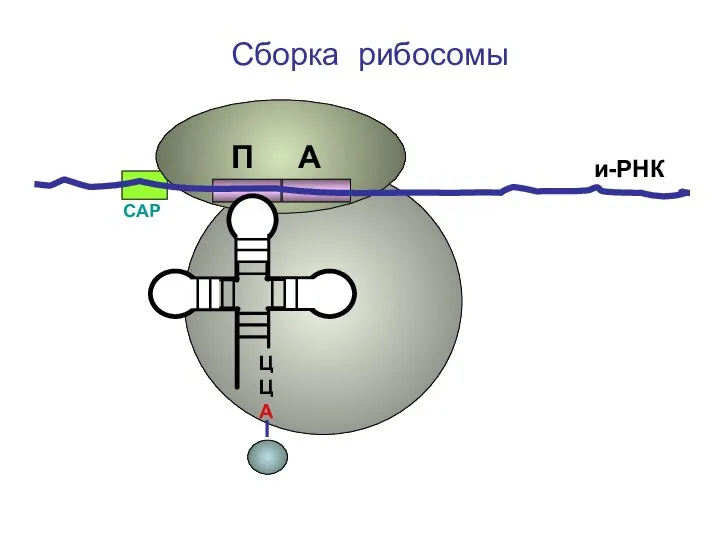
- 29. ЦЦА Сборка рибосомы и-РНК СAP П А
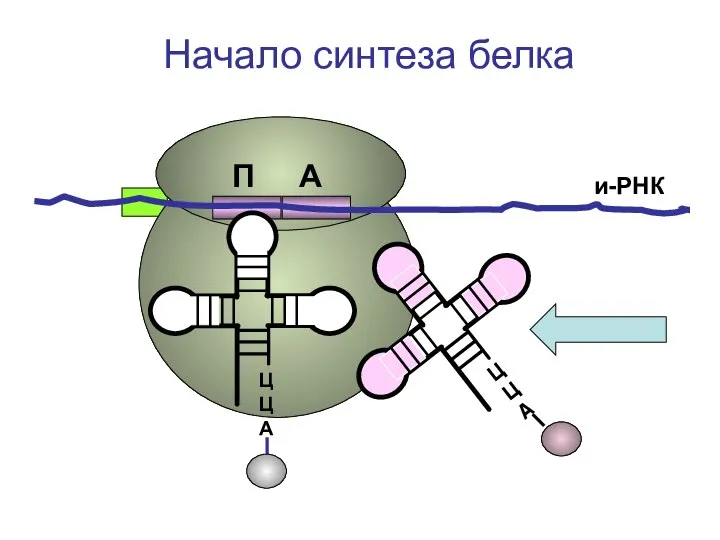
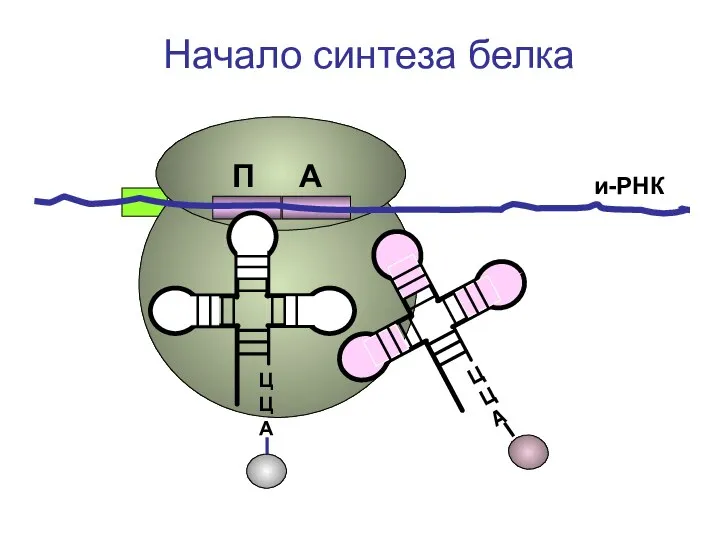
- 30. ЦЦА ЦЦА и-РНК Начало синтеза белка П А
- 31. ЦЦА и-РНК Начало синтеза белка П А
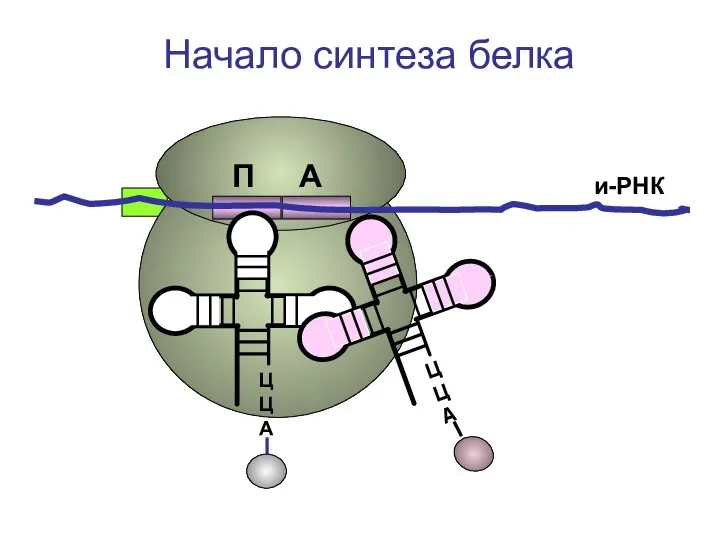
- 32. ЦЦА и-РНК Начало синтеза белка П А
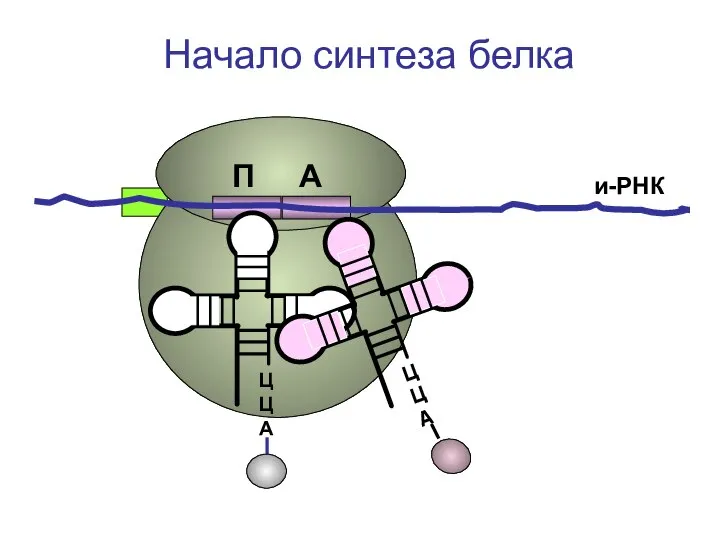
- 33. ЦЦА и-РНК Начало синтеза белка П А
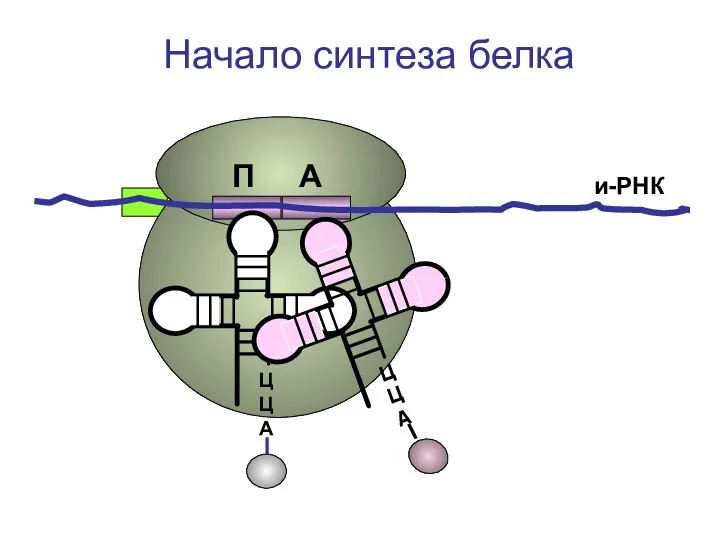
- 34. ЦЦА и-РНК Начало синтеза белка П А
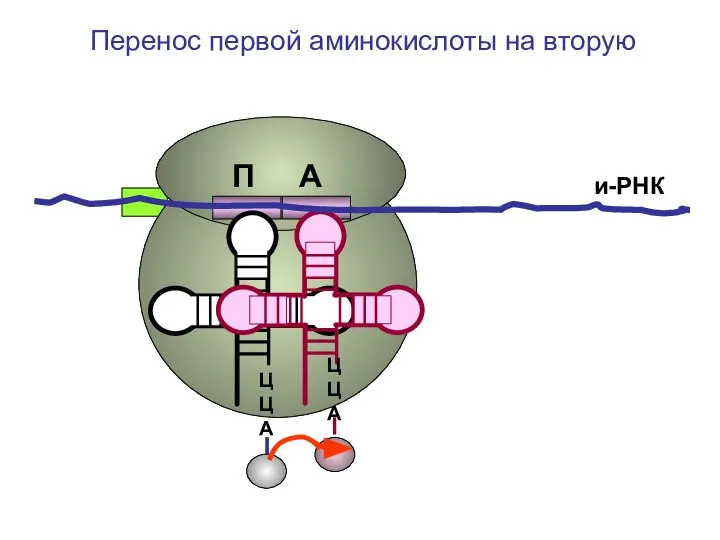
- 35. ЦЦА ЦЦА и-РНК Перенос первой аминокислоты на вторую П А
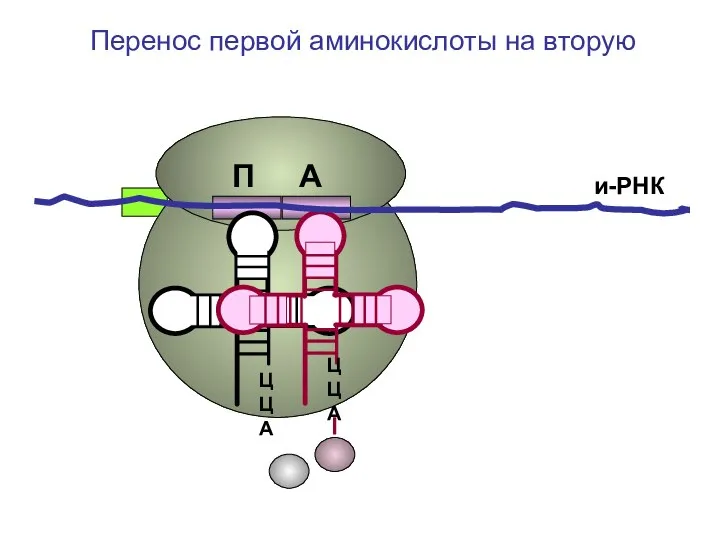
- 36. ЦЦА ЦЦА и-РНК Перенос первой аминокислоты на вторую П А
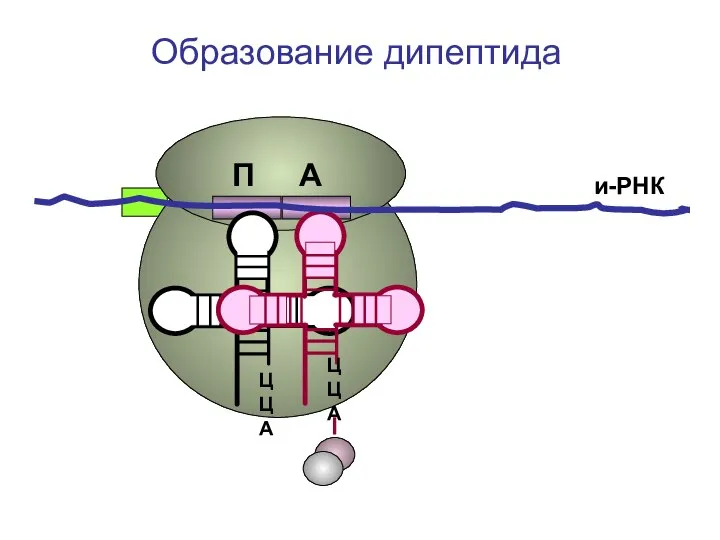
- 37. ЦЦА ЦЦА и-РНК Образование дипептида П А
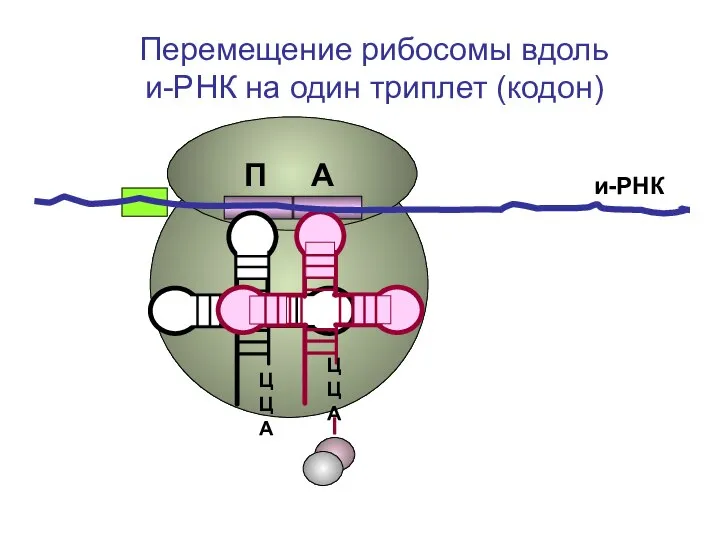
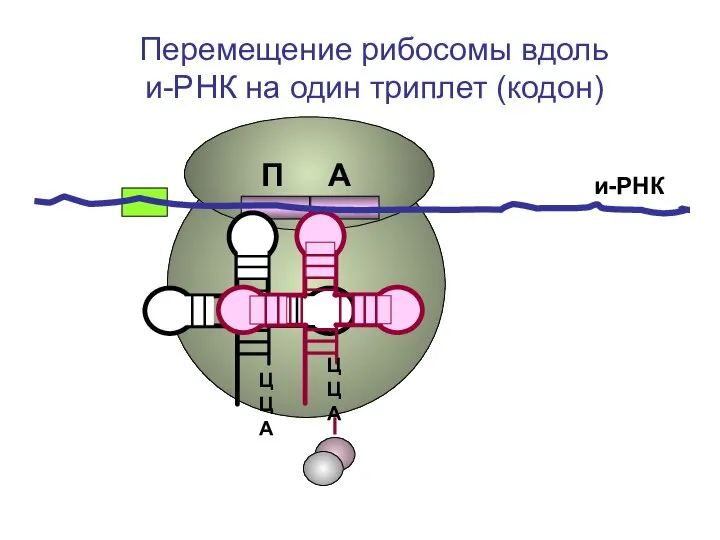
- 38. ЦЦА ЦЦА и-РНК П А Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
- 39. ЦЦА ЦЦА и-РНК П А Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
- 40. и-РНК П А Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
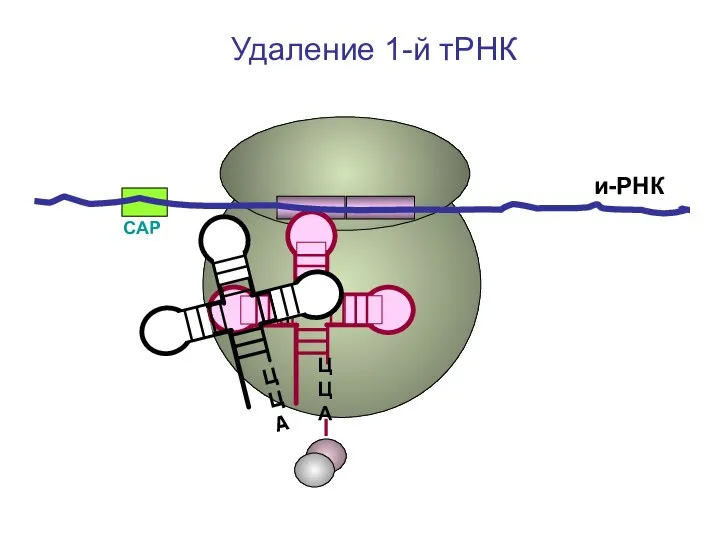
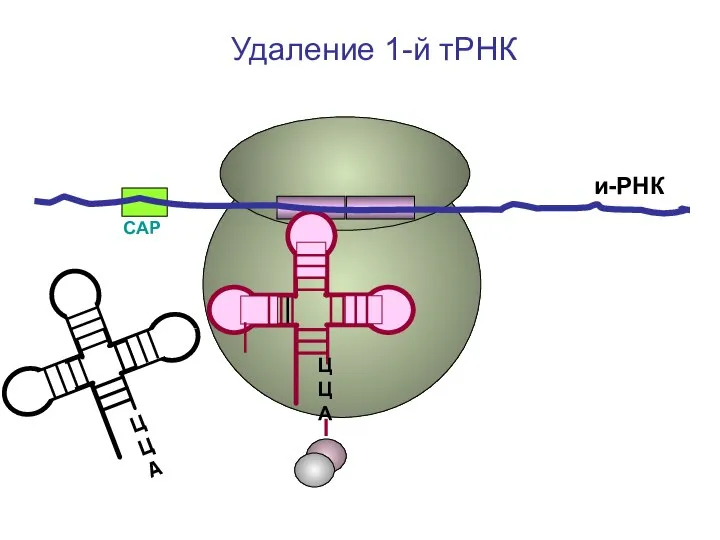
- 41. СAP и-РНК ЦЦА Удаление 1-й тРНК
- 42. СAP и-РНК ЦЦА Удаление 1-й тРНК
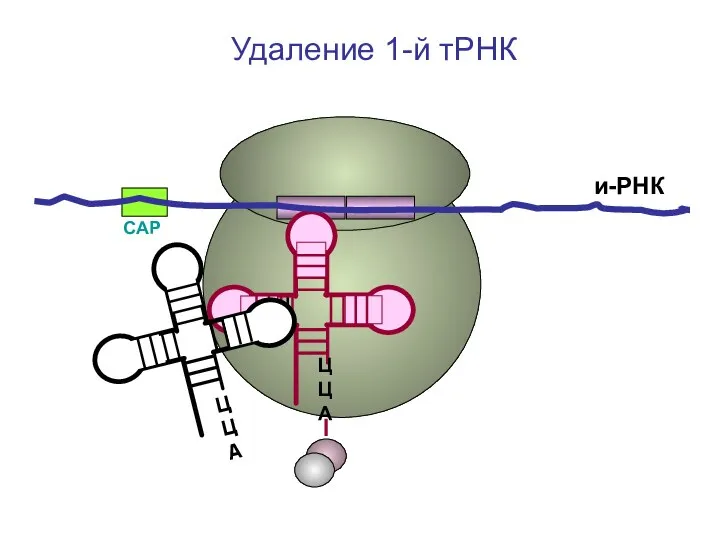
- 43. СAP и-РНК ЦЦА ЦЦА Удаление 1-й тРНК
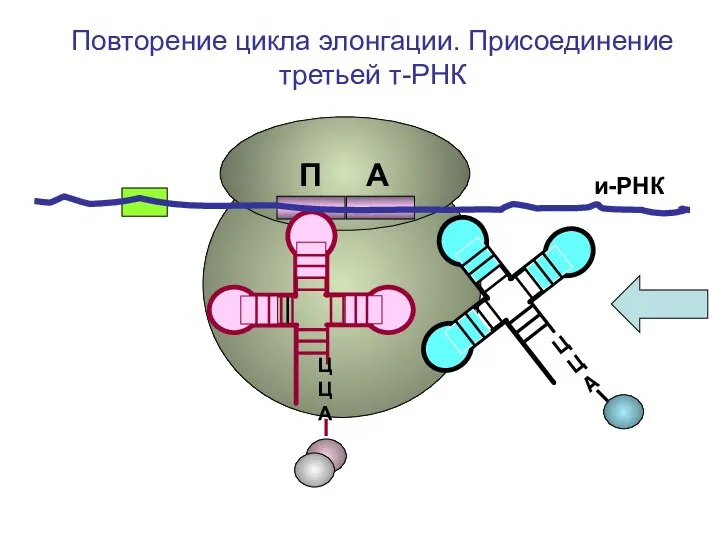
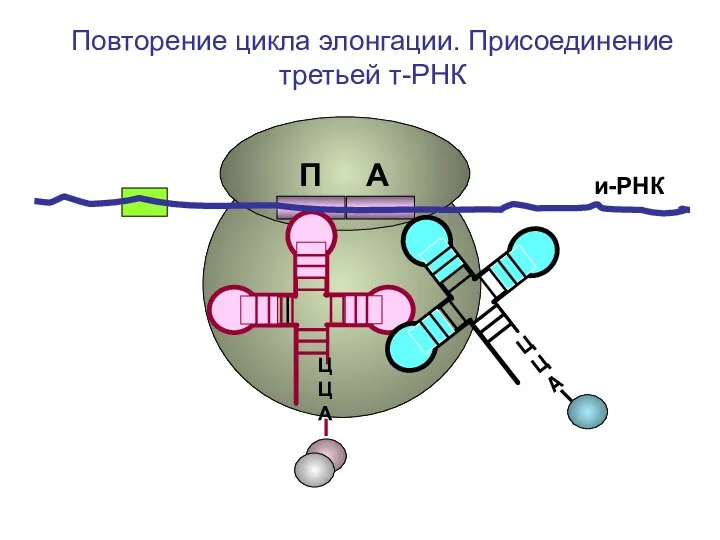
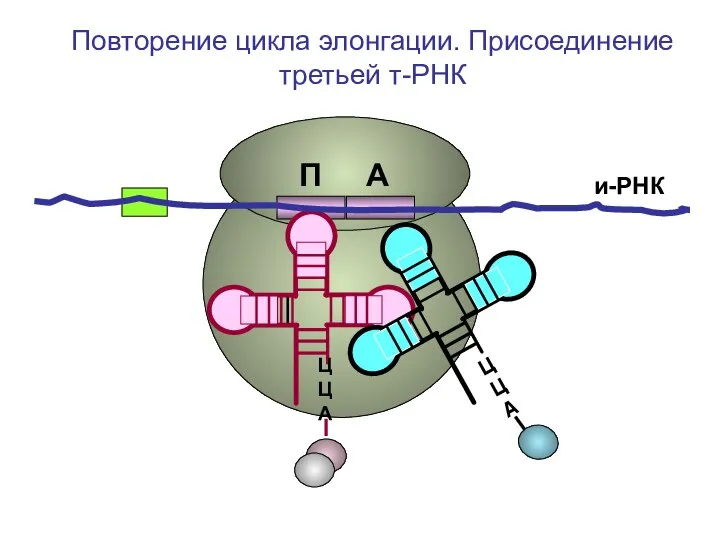
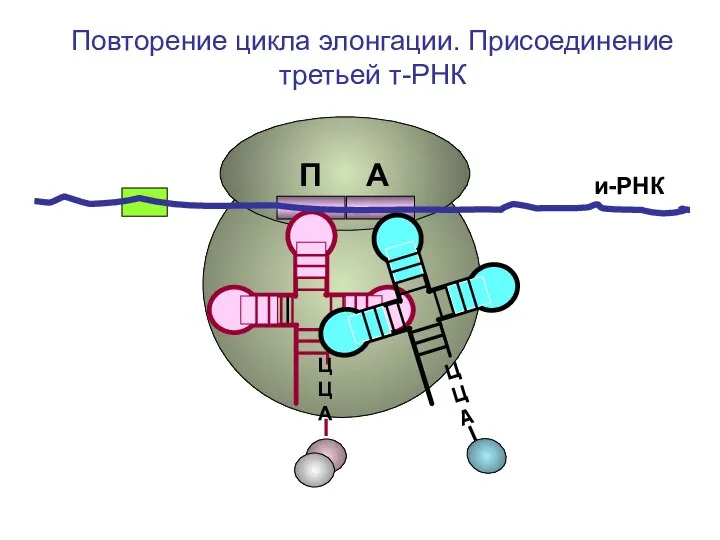
- 44. и-РНК ЦЦА ЦЦА Повторение цикла элонгации. Присоединение третьей т-РНК П А
- 45. и-РНК ЦЦА Повторение цикла элонгации. Присоединение третьей т-РНК П А
- 46. и-РНК ЦЦА Повторение цикла элонгации. Присоединение третьей т-РНК П А
- 47. и-РНК ЦЦА Повторение цикла элонгации. Присоединение третьей т-РНК П А
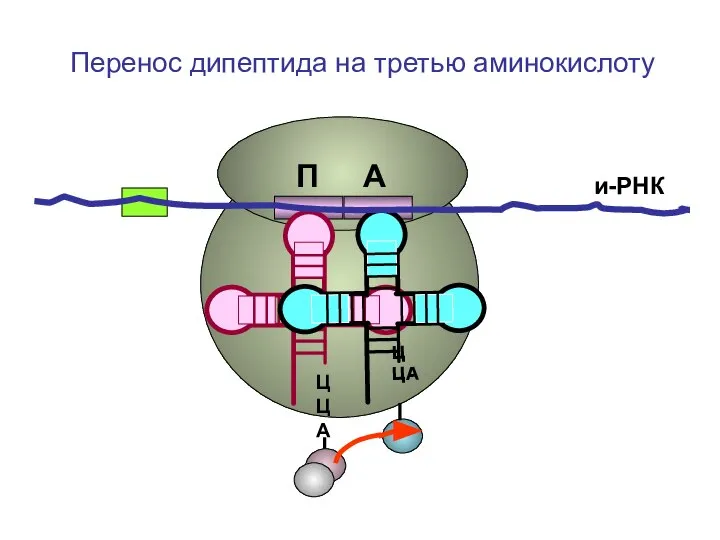
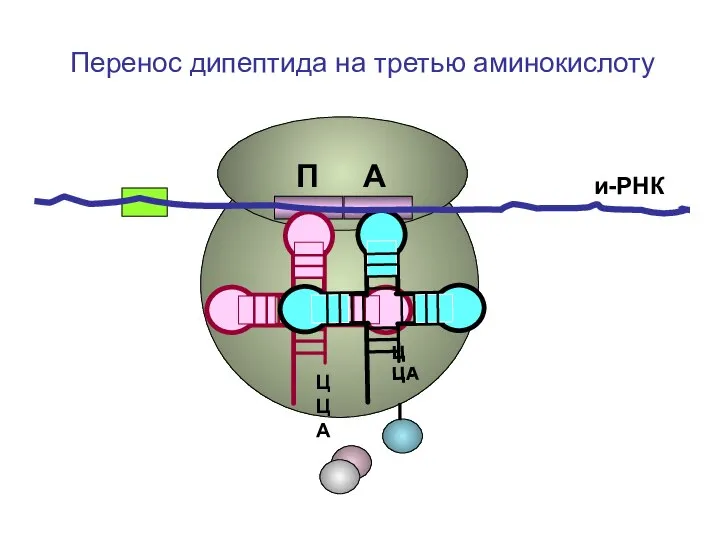
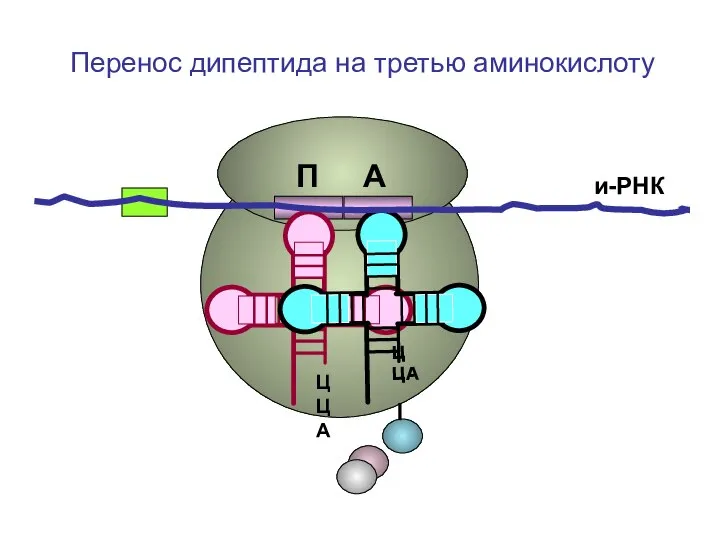
- 48. ЦЦА ЦЦА и-РНК П А Перенос дипептида на третью аминокислоту
- 49. ЦЦА ЦЦА и-РНК П А Перенос дипептида на третью аминокислоту
- 50. ЦЦА ЦЦА и-РНК П А Перенос дипептида на третью аминокислоту
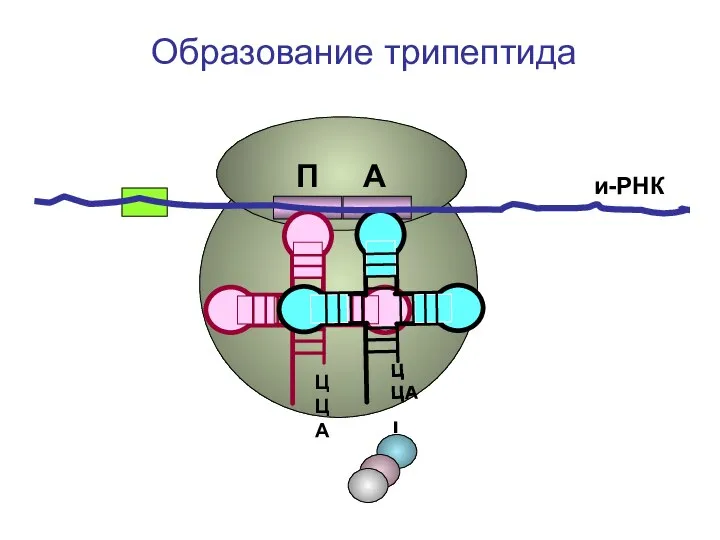
- 51. ЦЦА ЦЦА и-РНК П А Образование трипептида
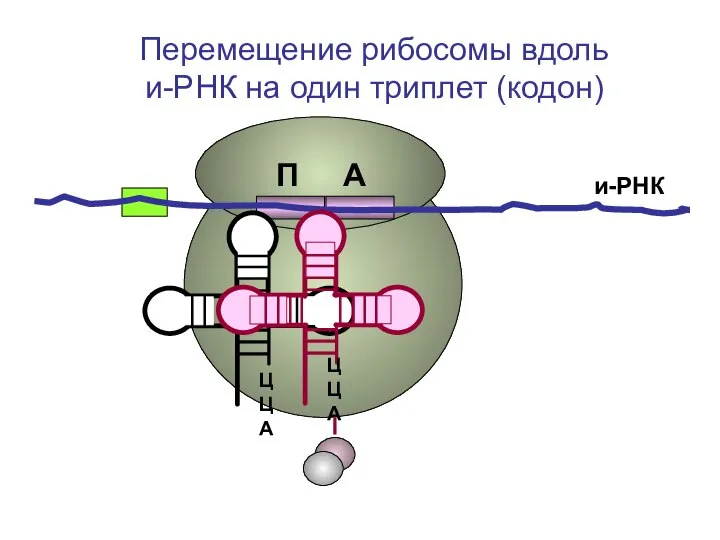
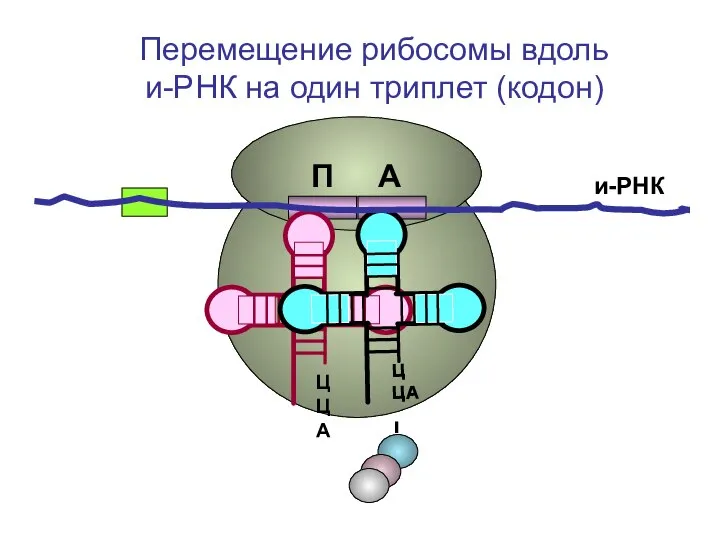
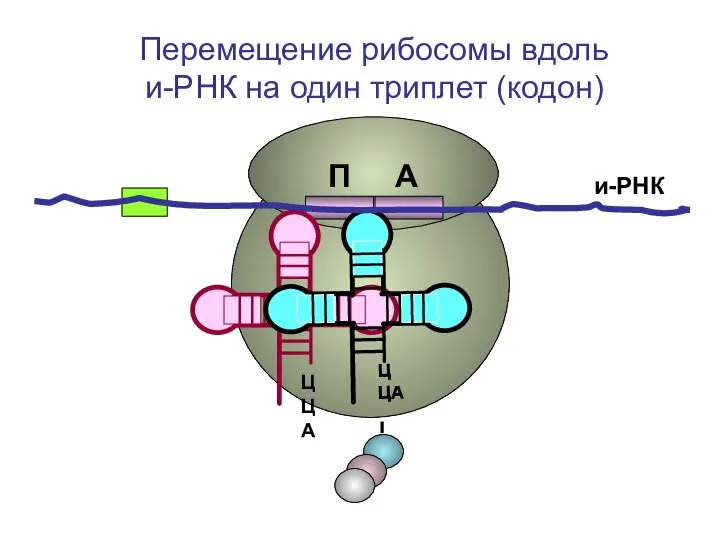
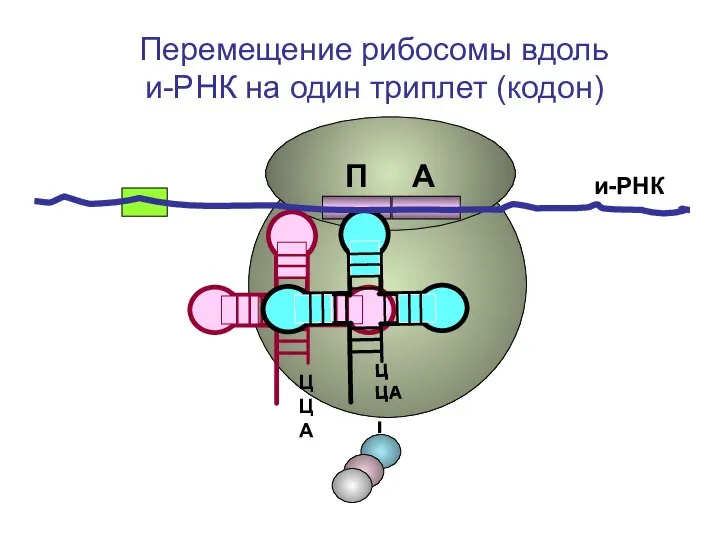
- 52. ЦЦА ЦЦА и-РНК П А Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
- 53. ЦЦА ЦЦА и-РНК П А Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
- 54. ЦЦА ЦЦА и-РНК П А Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
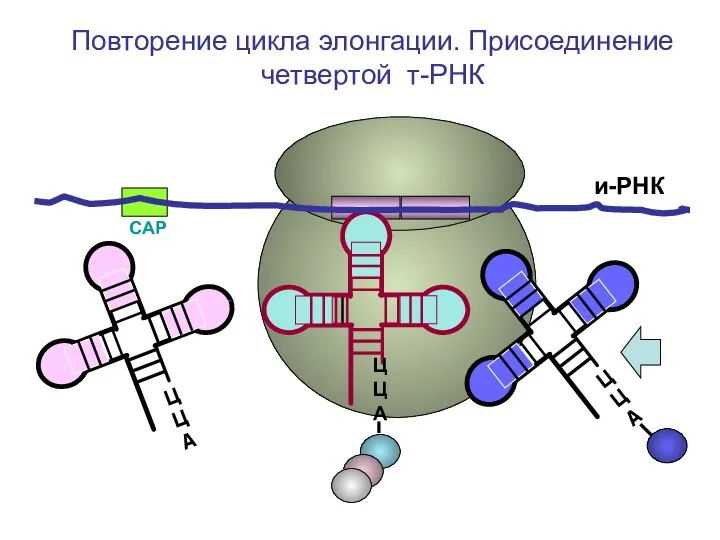
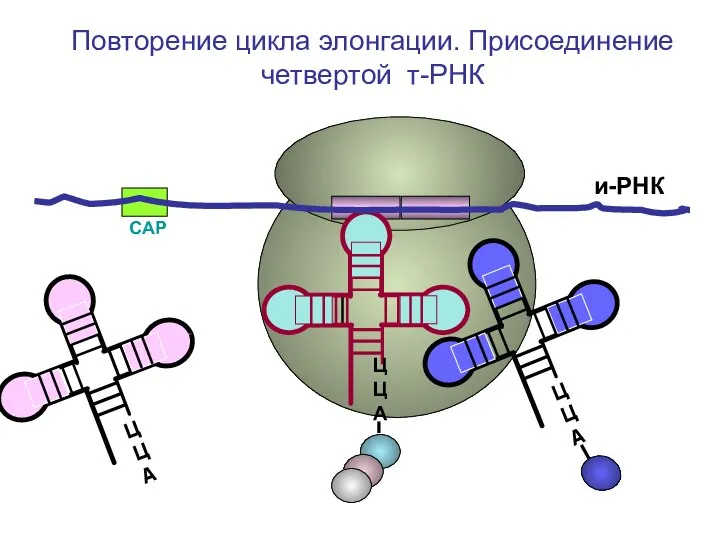
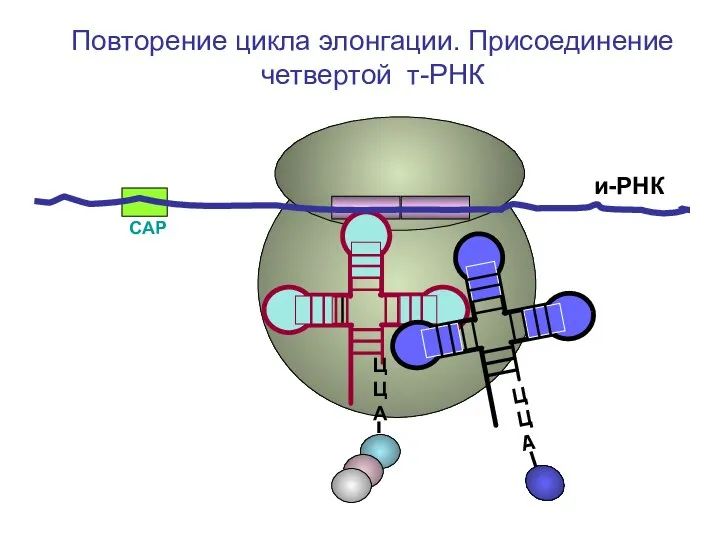
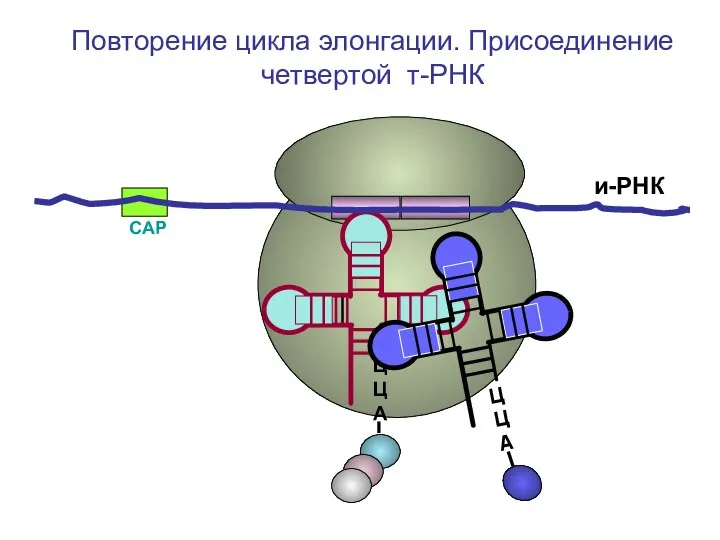
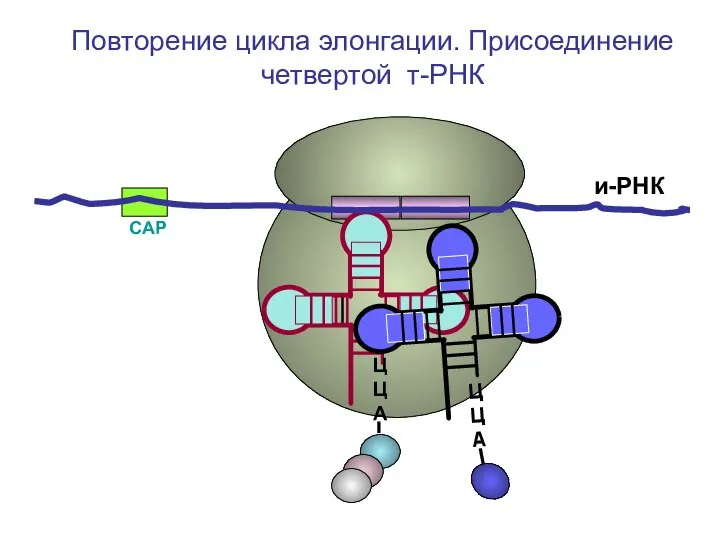
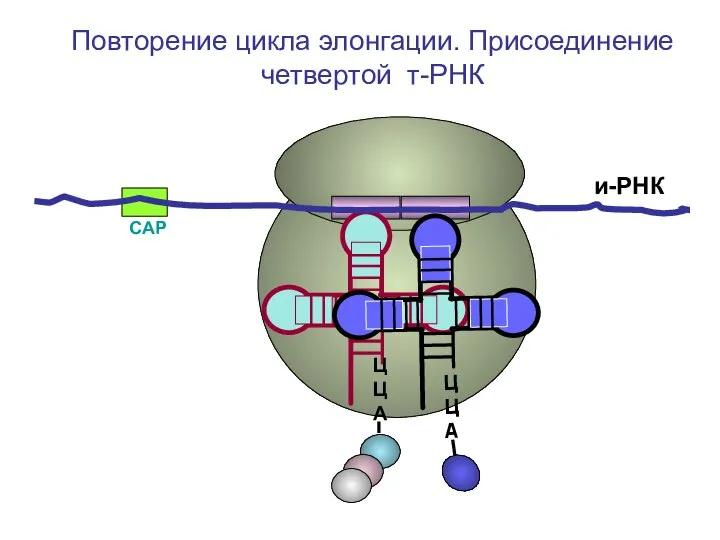
- 55. СAP и-РНК ЦЦА ЦЦА ЦЦА Повторение цикла элонгации. Присоединение четвертой т-РНК
- 56. СAP и-РНК ЦЦА ЦЦА Повторение цикла элонгации. Присоединение четвертой т-РНК
- 57. СAP и-РНК ЦЦА Повторение цикла элонгации. Присоединение четвертой т-РНК
- 58. СAP и-РНК ЦЦА Повторение цикла элонгации. Присоединение четвертой т-РНК
- 59. СAP и-РНК ЦЦА Повторение цикла элонгации. Присоединение четвертой т-РНК
- 60. СAP и-РНК ЦЦА Повторение цикла элонгации. Присоединение четвертой т-РНК
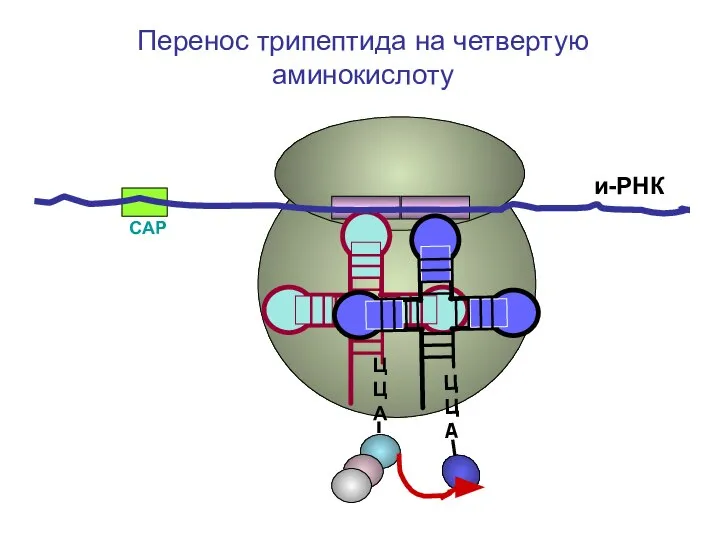
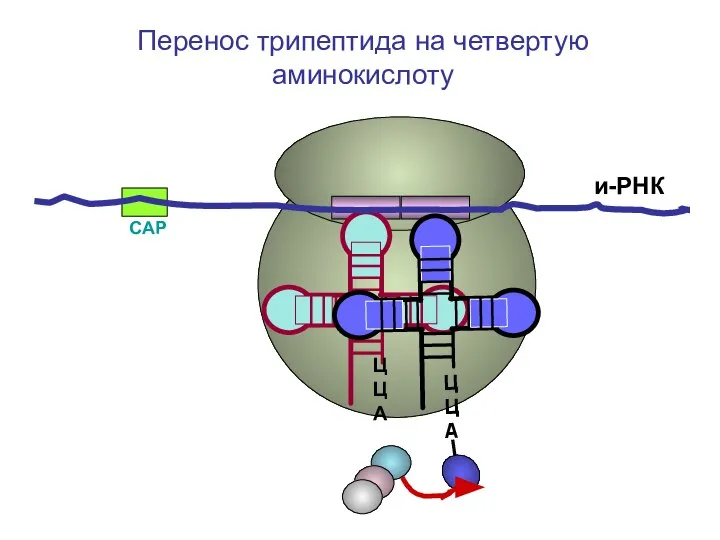
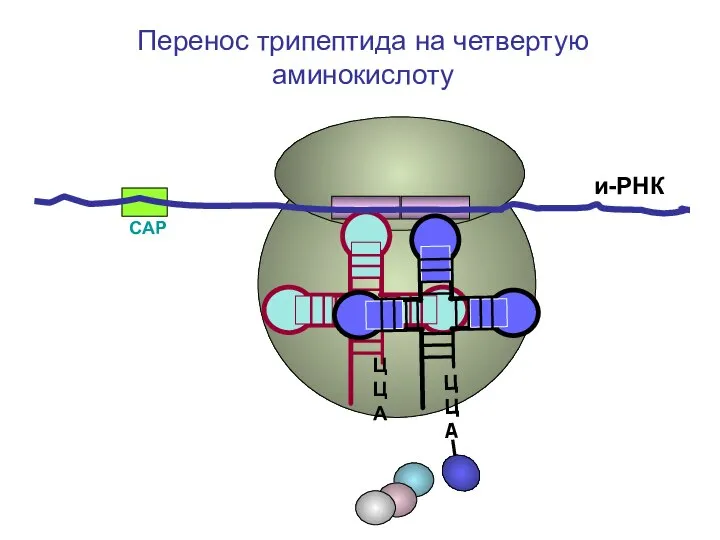
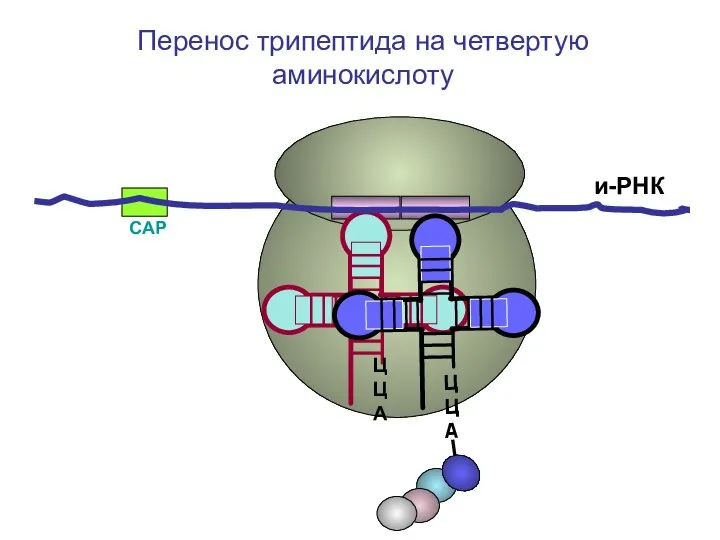
- 61. СAP и-РНК ЦЦА Перенос трипептида на четвертую аминокислоту
- 62. СAP и-РНК ЦЦА Перенос трипептида на четвертую аминокислоту
- 63. СAP и-РНК ЦЦА Перенос трипептида на четвертую аминокислоту
- 64. СAP и-РНК ЦЦА Перенос трипептида на четвертую аминокислоту
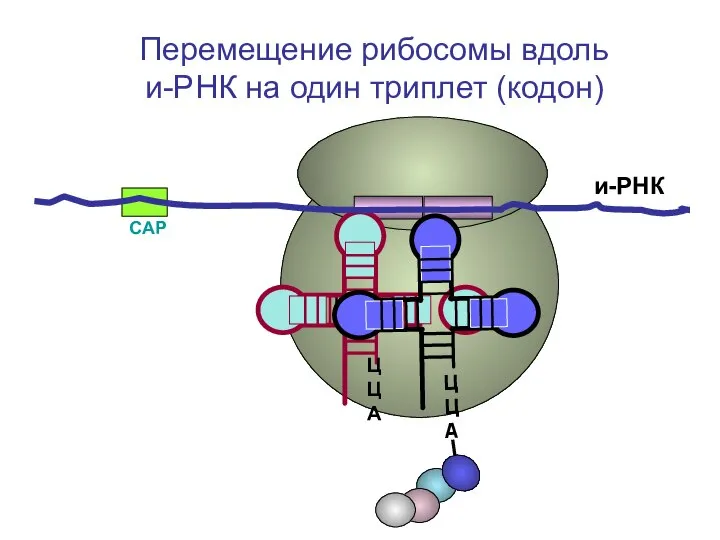
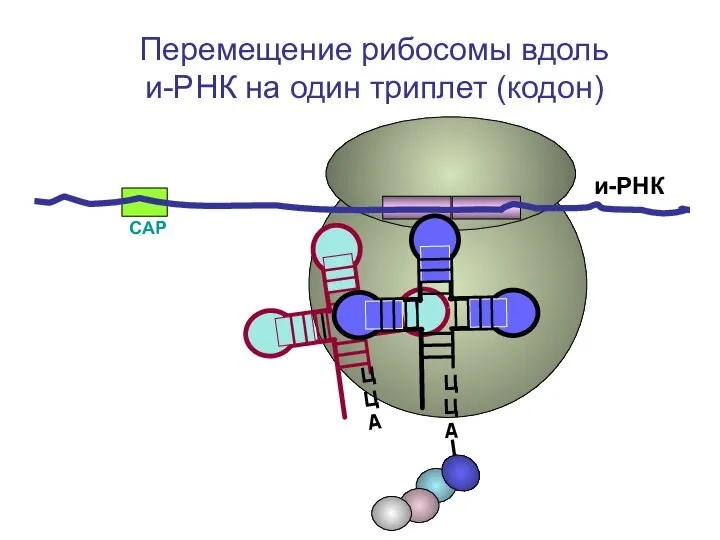
- 65. СAP и-РНК ЦЦА Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
- 66. СAP и-РНК Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
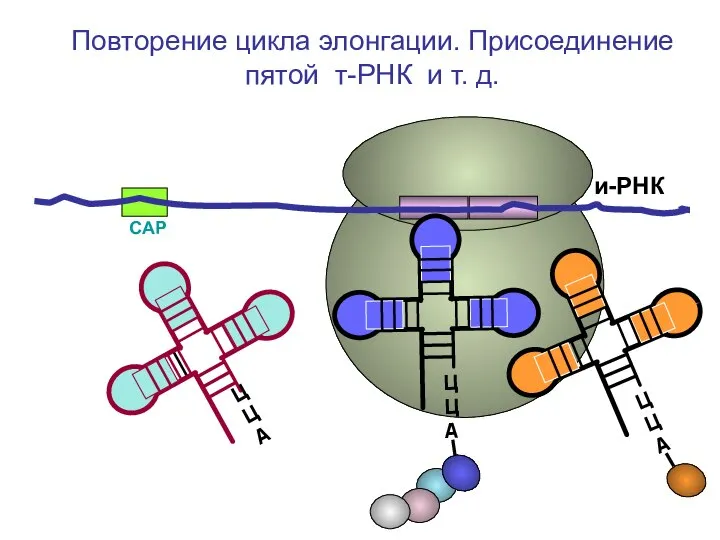
- 67. СAP и-РНК ЦЦА Повторение цикла элонгации. Присоединение пятой т-РНК и т. д.
- 68. Стадия терминации
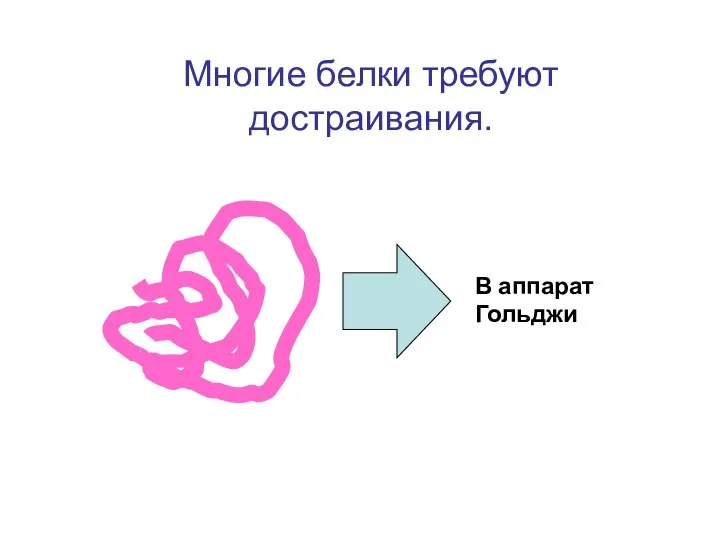
- 69. Образовавшийся белок, потоком жидкости в эндоплазматическом ретикулуме (состоящим из трубочек), направляется в Аппарат Гольджи. В этом
- 70. В аппарат Гольджи Многие белки требуют достраивания.
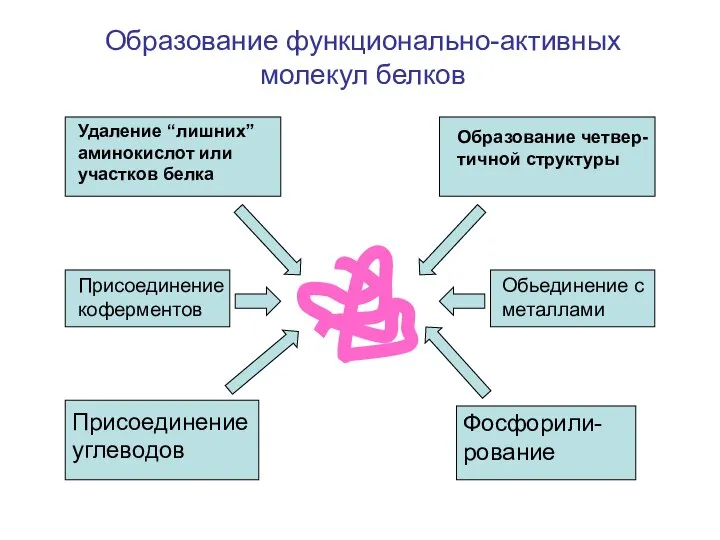
- 71. Присоединение коферментов Присоединение углеводов Обьединение с металлами Фосфорили-рование Удаление “лишних” аминокислот или участков белка Образование четвер-тичной
- 72. Регуляция обмена белков
- 73. Гормональная регуляция скорости синтеза белка Соматотропин, половые гормоны (индукторы транскрипции и биосинтеза белка); 2. Тироксин (активатор
- 74. Влияние некоторых факторов на концентрацию и состав белков организма Доступность в белковой диете; 2. Наличие полноценных
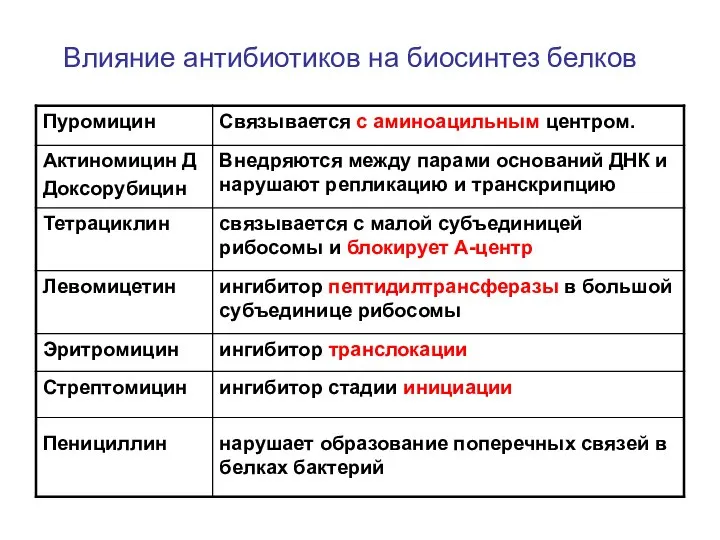
- 75. Влияние антибиотиков на биосинтез белков
- 76. Трансамини-рование аминокислот
- 77. Поступающий с пищей набор аминокислот, редко соответствует их требуемому соотношению для использования клетками. Часто одних аминокислот
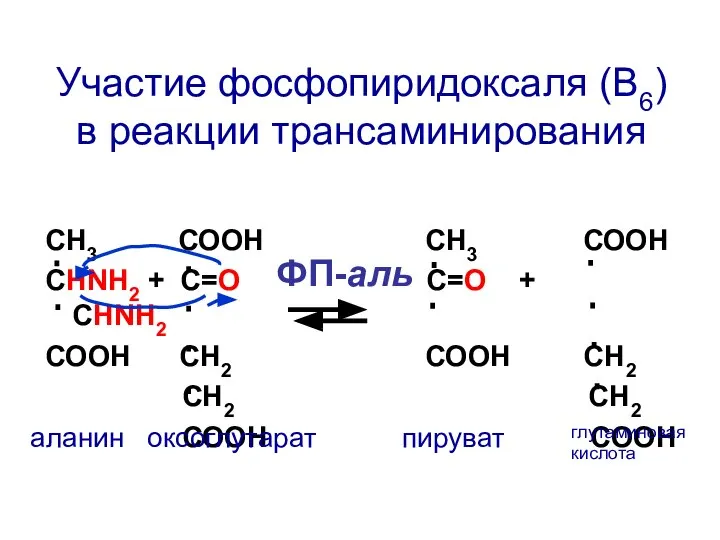
- 78. СН3 СООН СН3 СООН СНNH2 + C=О С=О + СНNH2 СООН СН2 СООН СН2 СН2 СН2
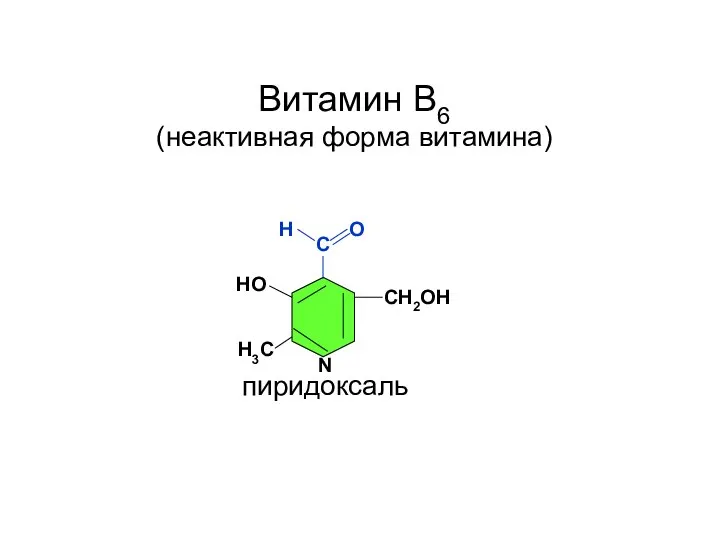
- 79. С СН2ОН НО Н3С N Н О пиридоксаль Витамин В6 (неактивная форма витамина)
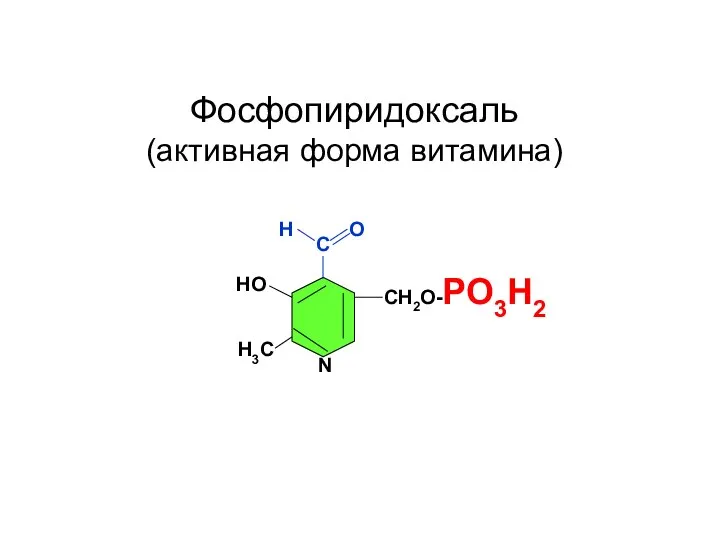
- 80. С СН2О-РО3Н2 НО Н3С N Н О Фосфопиридоксаль (активная форма витамина)
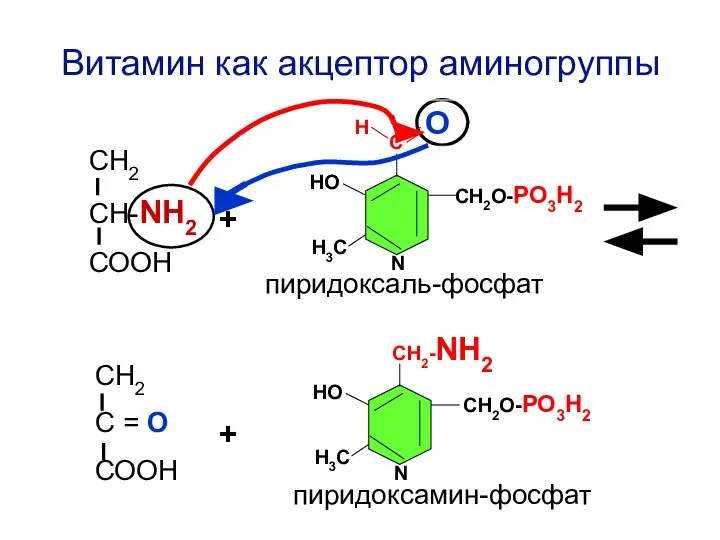
- 81. Н О С СН2О-РО3Н2 НО Н3С N СН2-NH2 СН2О-РО3Н2 НО Н3С N пиридоксамин-фосфат Витамин как акцептор
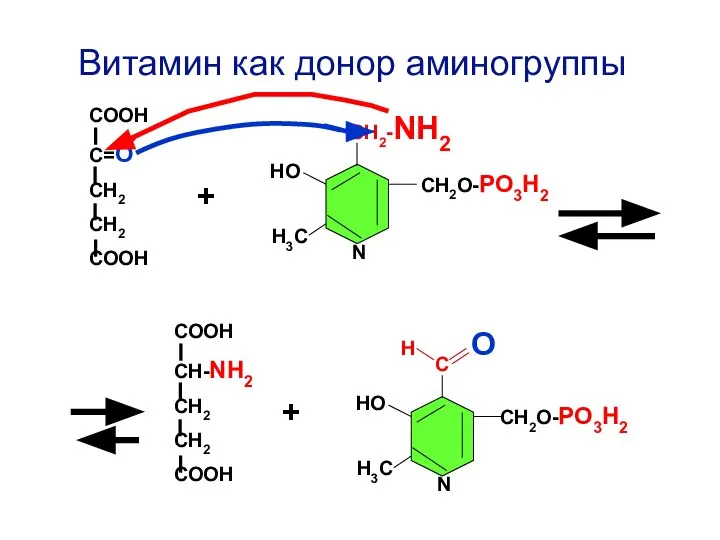
- 82. Н О С СН2О-РО3Н2 НО Н3С N СН2-NH2 СН2О-РО3Н2 НО Н3С N Витамин как донор аминогруппы
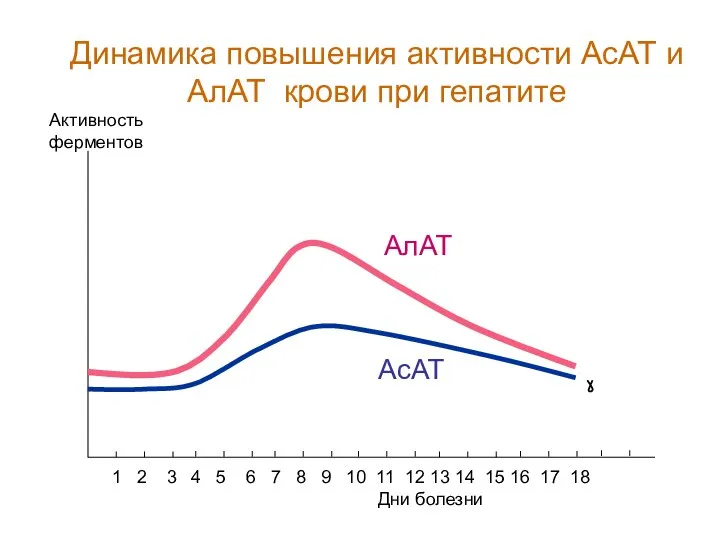
- 83. В клинической практике активность АлАТ или АсАТ часто измеряют в сыворотке крови для обнаружения цитолиза клеток
- 84. Дни болезни Активность ферментов 1 2 3 4 5 6 7 8 9 10 11 12
- 85. Декарбоксилирование аминокислот (образование биологически-активных аминов)
- 86. Часть аминокислот используется организмом для получения биологически активных молекул, которые участвуют в регуляции обменных процессов. Путем
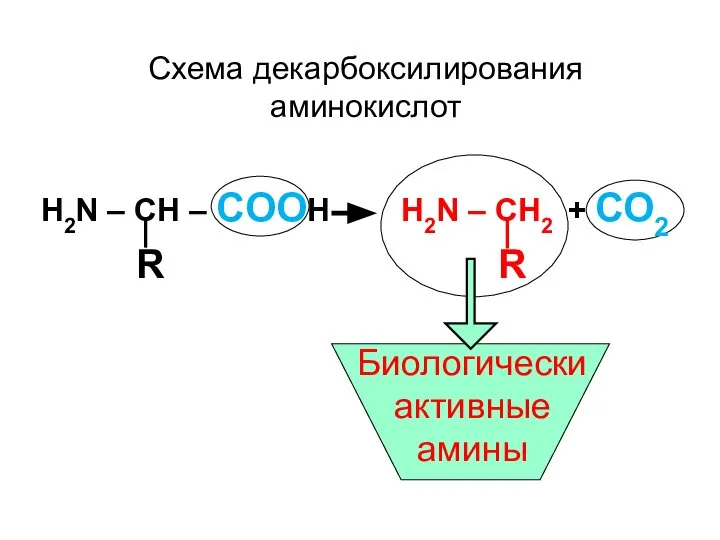
- 87. H2N – CН – CООН H2N – CН2 + СО2 R R Схема декарбоксилирования аминокислот Биологически
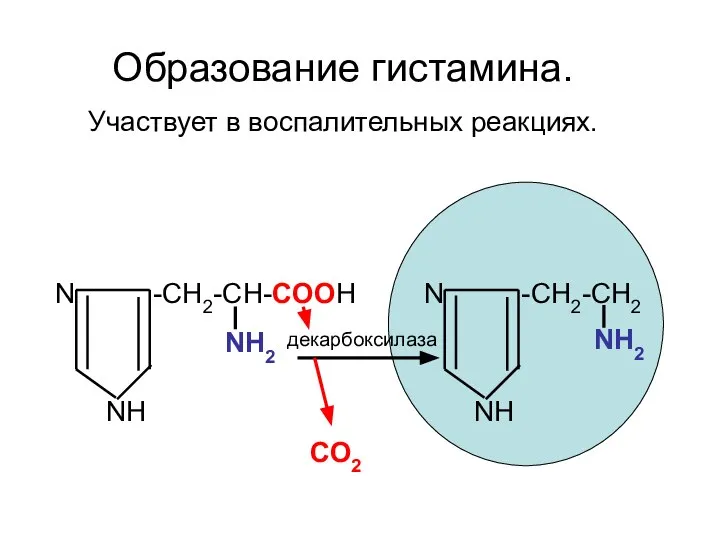
- 88. N -CH2-CH-COOH NH2 NH N -CH2-CH2 NH2 NH декарбоксилаза СО2 Образование гистамина. Участвует в воспалительных реакциях.
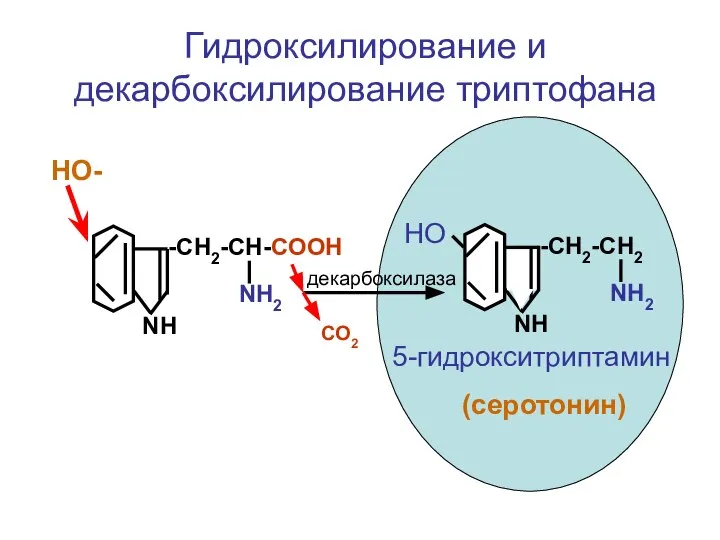
- 89. -CH2-CH-COOH NH2 NH НО- -CH2-CH2 NH2 NH НО 5-гидрокситриптамин (серотонин) декарбоксилаза СО2 Гидроксилирование и декарбоксилирование триптофана
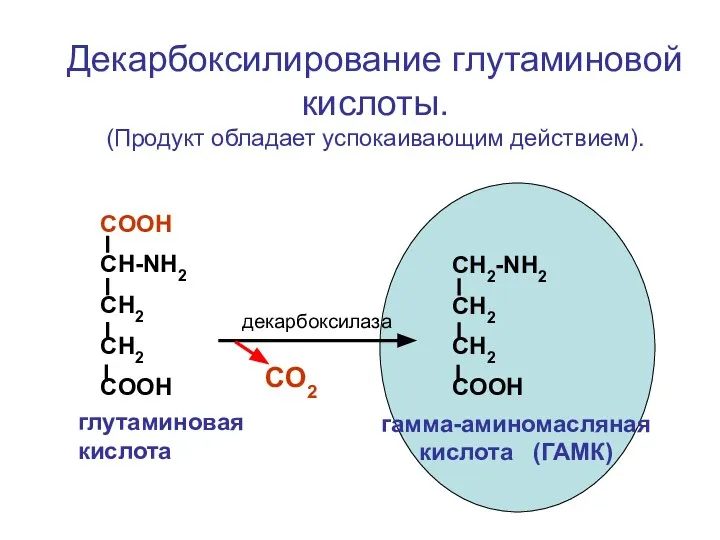
- 90. СOOH CH-NH2 CH2 CH2 COOH CH2-NH2 CH2 CH2 COOH декарбоксилаза CO2 глутаминовая кислота гамма-аминомасляная кислота (ГАМК)
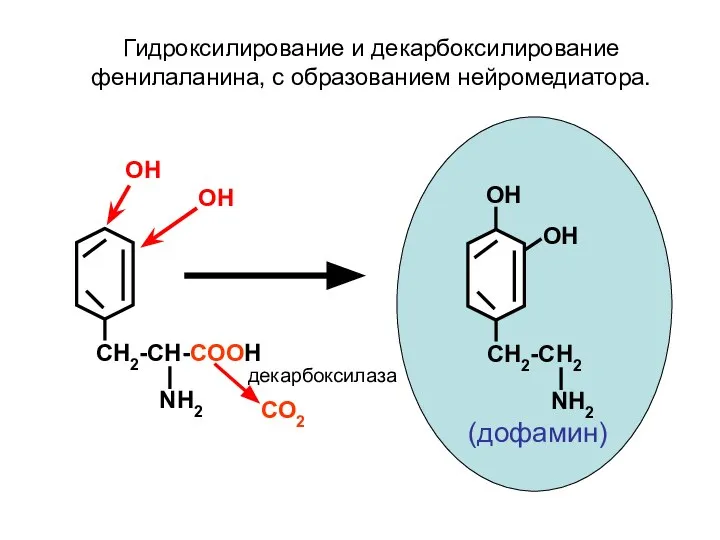
- 91. CH2-CH-COOH NH2 ОН ОН CH2-CH2 NH2 ОН ОН СО2 декарбоксилаза Гидроксилирование и декарбоксилирование фенилаланина, с образованием
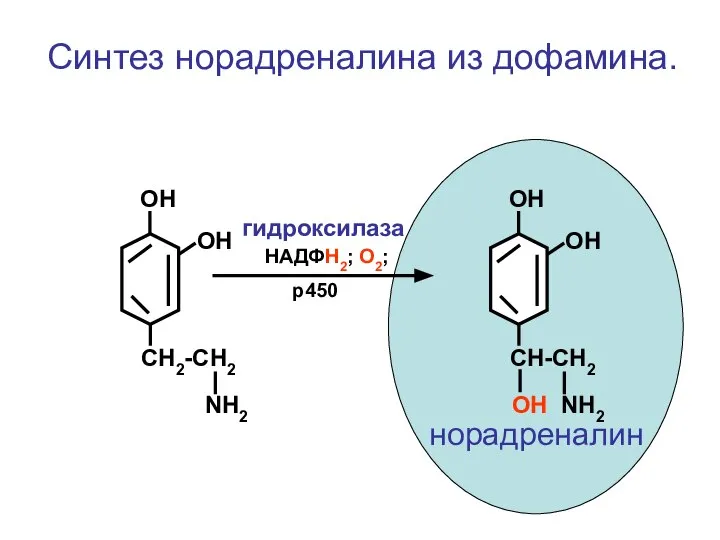
- 92. CH2-CH2 NH2 ОН ОН Синтез норадреналина из дофамина. CH-CH2 ОН NH2 ОН ОН НАДФН2; О2; р450
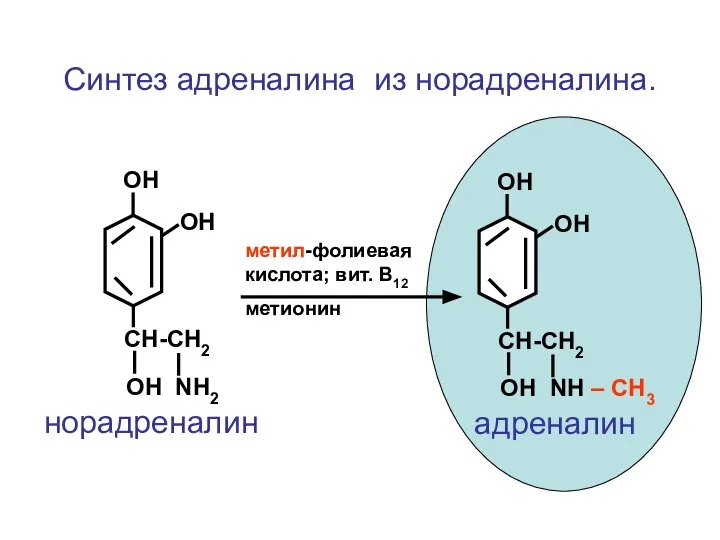
- 93. CH-CH2 ОН NH2 ОН ОН норадреналин CH-CH2 ОН NH – СН3 ОН ОН адреналин метил-фолиевая кислота;
- 94. Биологически активные амины, используемые как лекарственные средства. Гистамин Триптамин Серотонин Гамма-аминомасляная кислота (ГАМК) Дофамин Норадреналин Адреналин
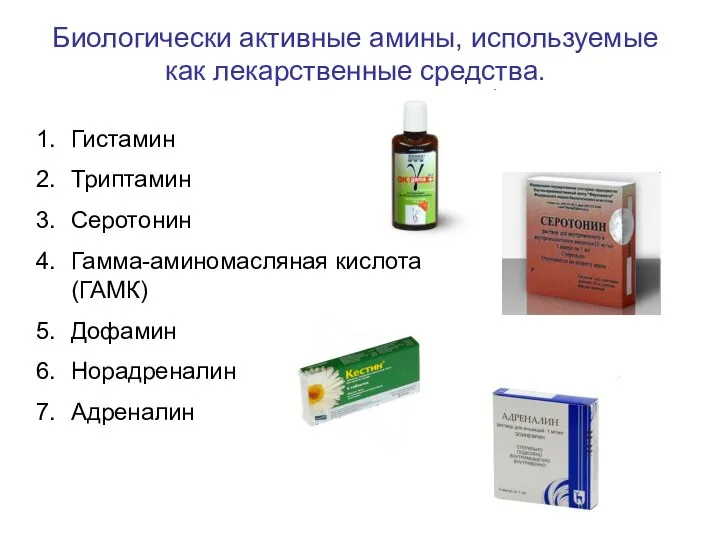
- 95. Использование аминокислот в качестве исходных субстратов для выработки энергии с помощью окислительного дезаминирования.
- 96. Иногда в клетках возникает необходимость в более интенсивном образовании энергии. При этом, кроме углеводов и липидов,
- 97. Реакция окислительного дезаминирования глутаминовой кислоты СООН СН2 СН2 CH-NH2 COOH HАД HАДН2 +Н2О СООН СН2 СН2
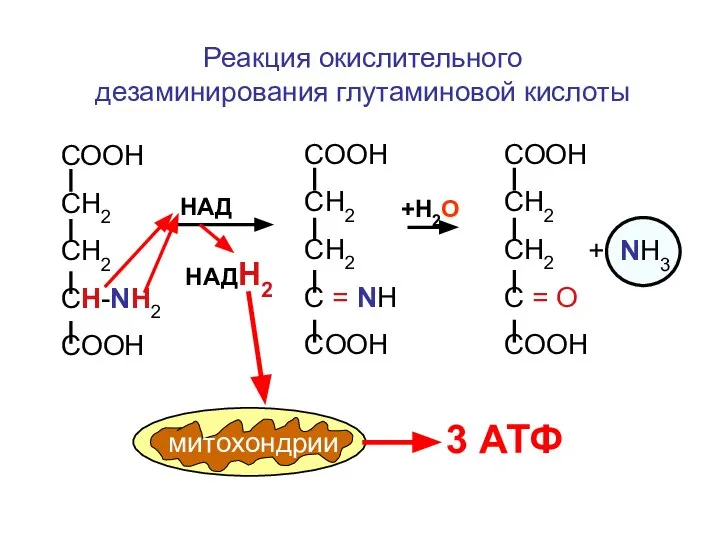
- 98. В результате окислительного дезаминирования глутаминовой, или аспарагиновой кислот образуется одна молекула НАДН2 , которая используется митохондриями
- 99. NH3 дезаминирова-ние аминокислот дезаминирова-ние нуклеотидов окисление аминов дезаминирование аминосахаров метаболические источники аммиака в организме
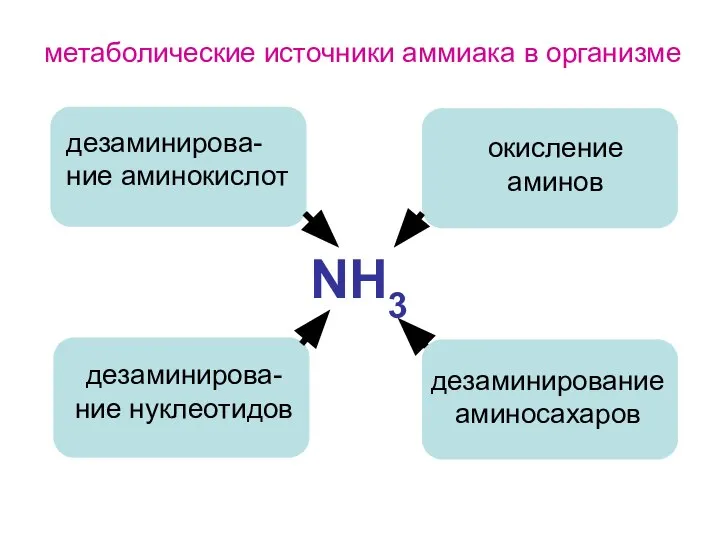
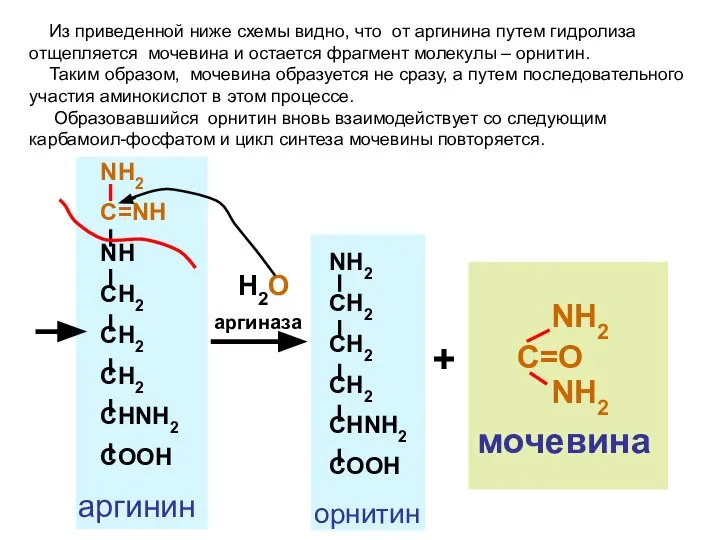
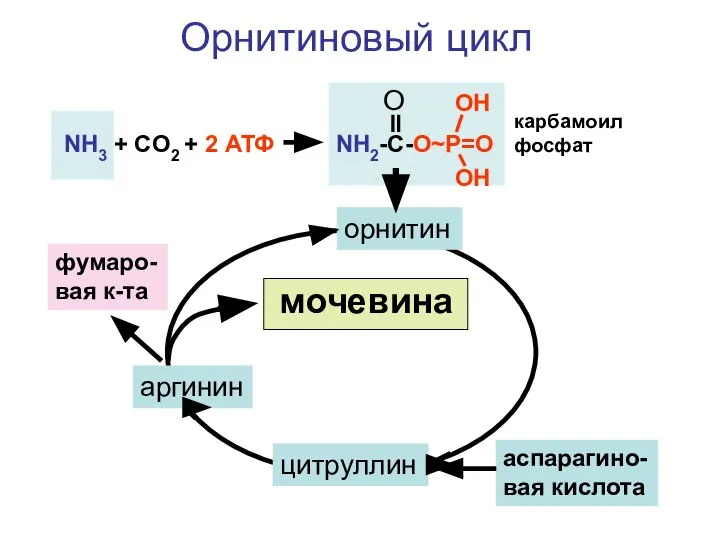
- 100. синтез мочевины
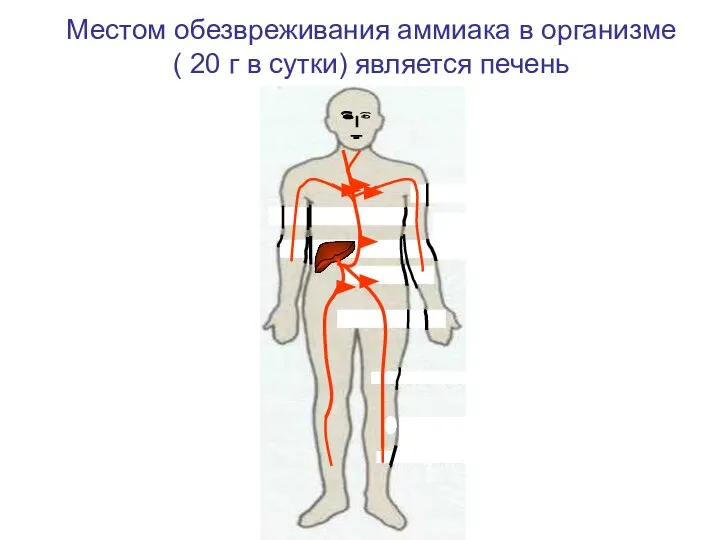
- 101. • • Местом обезвреживания аммиака в организме ( 20 г в сутки) является печень
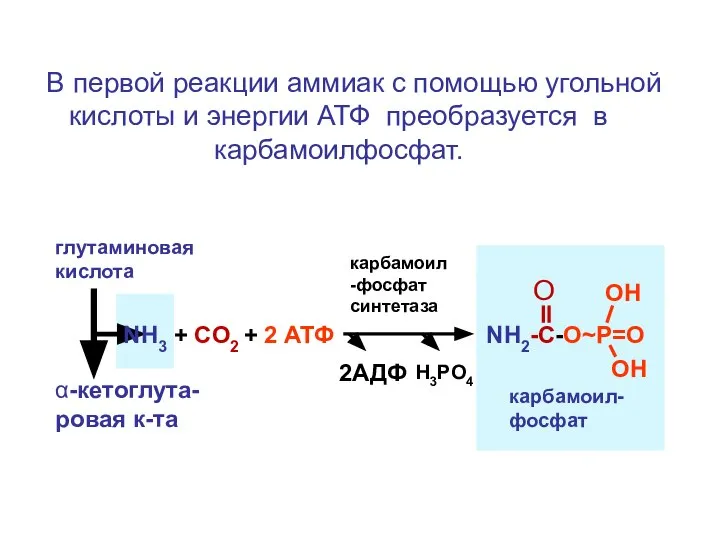
- 102. В первой реакции аммиак с помощью угольной кислоты и энергии АТФ преобразуется в карбамоилфосфат. глутаминовая кислота
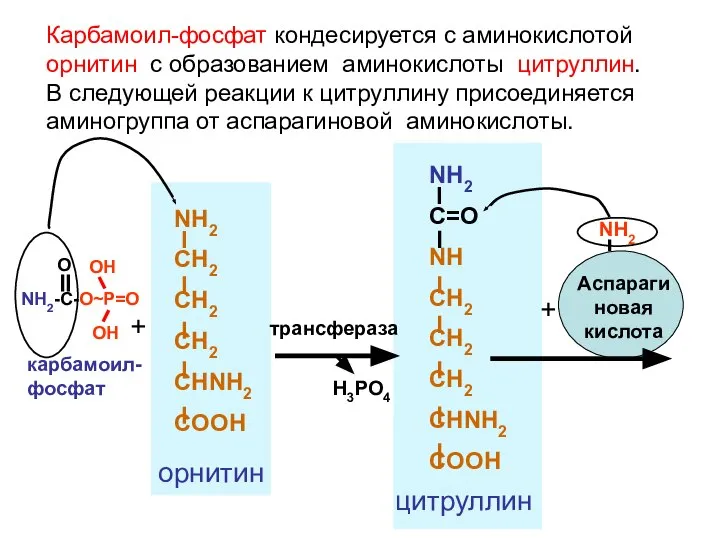
- 103. + NH2 CH2 CH2 CH2 CHNH2 COOH орнитин трансфераза H3PO4 NH2 C=O NH CH2 CH2 CH2
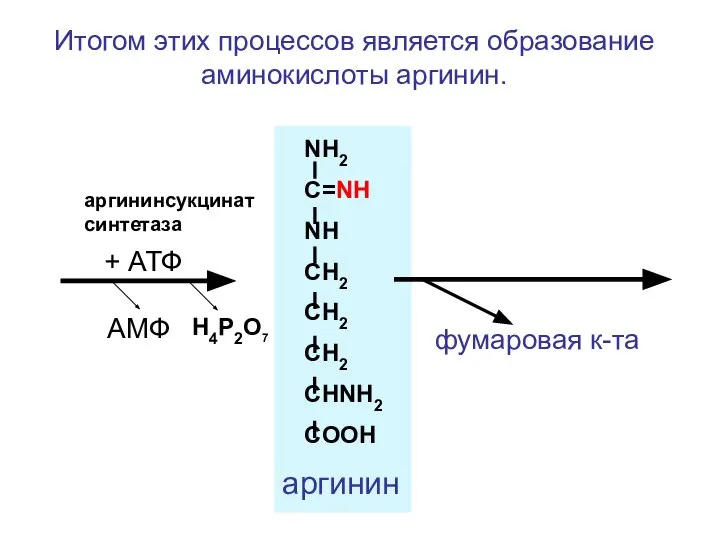
- 104. NH2 C=NH NH CH2 CH2 CH2 CHNH2 COOH фумаровая к-та + АТФ аргининсукцинатсинтетаза АМФ H4P2O7 аргинин
- 105. NH2 CH2 CH2 CH2 CHNH2 COOH C=O NH2 NH2 мочевина NH2 C=NH NH CH2 CH2 CH2
- 106. NH3 + CO2 + 2 АТФ NH2-C-O~P=O O OH OH орнитин цитруллин аспарагино-вая кислота аргинин фумаро-вая
- 107. Содержание мочевины в крови 2,5 – 8,3 ммоль/л сыворотки
- 108. Диагностическая значимость определения концентрации мочевины в крови. Понижение ниже нормы наблюдается при: тяжелом заболевании печени; длительном
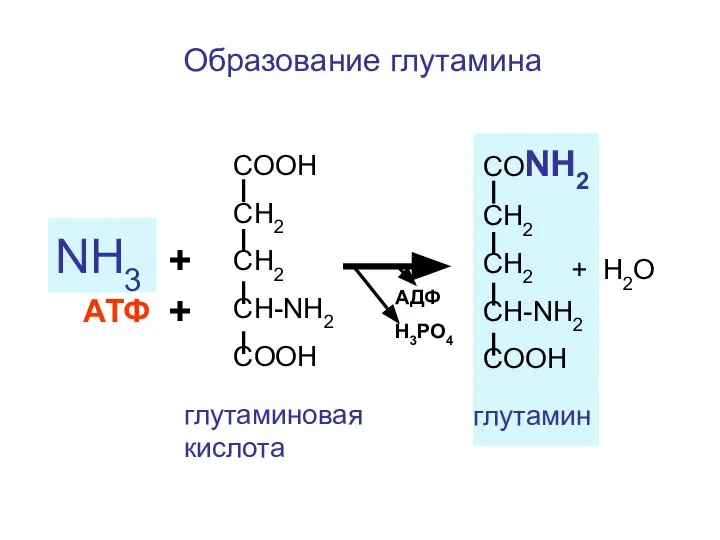
- 109. Вспомогательный, быстрый механизм связывания аммиака внутри клеток
- 110. Этот пример удаления аммиака в клетках происходит в тех органах, где мочевина не может синтезироваться. Например,
- 111. Образование глутамина СООН СН2 СН2 CH-NH2 COOH NH3 + СОNH2 СН2 СН2 CH-NH2 COOH АТФ +
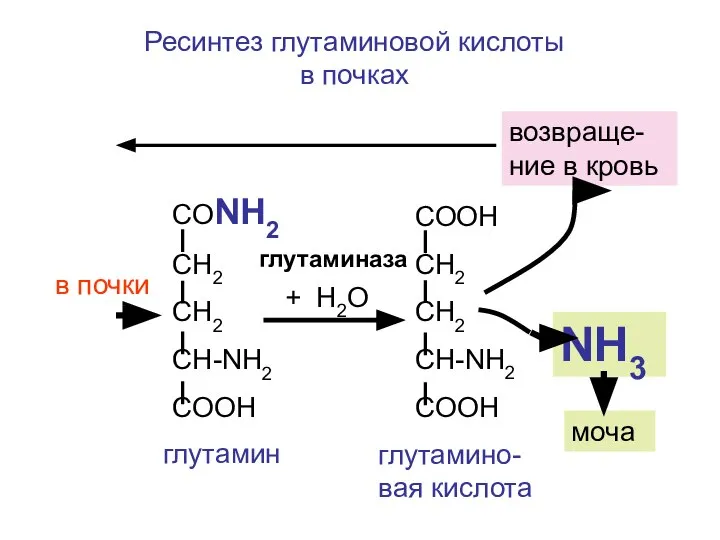
- 112. С током крови глутамин поступает в печень или в почки. В печени происходит гидролиз глутамина, образуется
- 113. СООН СН2 СН2 CH-NH2 COOH NH3 СОNH2 СН2 СН2 CH-NH2 COOH + H2O глутамино-вая кислота глутамин
- 115. Скачать презентацию




























 Строение клетки. 10 класс
Строение клетки. 10 класс Поток генов. Миграция
Поток генов. Миграция Внешнее и внутреннее строение листа растения. 7 класс
Внешнее и внутреннее строение листа растения. 7 класс Презентация на тему ОБМЕН ВЕЩЕСТВ
Презентация на тему ОБМЕН ВЕЩЕСТВ  Разнообразие животных
Разнообразие животных Органы нервной системы. Практикум
Органы нервной системы. Практикум Царство Животные
Царство Животные Этапы эволюции человека
Этапы эволюции человека Типы червей
Типы червей Инструменты груминга для собак
Инструменты груминга для собак § 47. Первые и современные люди 9 класс биология
§ 47. Первые и современные люди 9 класс биология Онтогенез – процесс индивидуального развития особи от момента образования зиготы до конца жизни организма
Онтогенез – процесс индивидуального развития особи от момента образования зиготы до конца жизни организма Семейства пасленовые, бобовые
Семейства пасленовые, бобовые Почему о грибах полезно знать всем?
Почему о грибах полезно знать всем? Нервная система
Нервная система Фенологиялық бақылау тікенекті шырша
Фенологиялық бақылау тікенекті шырша Ақмола облысы жағдайында bromopsis inermis (leyss) holub өсімдігінің морфобиологиялық ерекшеліктері
Ақмола облысы жағдайында bromopsis inermis (leyss) holub өсімдігінің морфобиологиялық ерекшеліктері Презентация на тему Сколиоз
Презентация на тему Сколиоз  Строение клетки. Занятие №3
Строение клетки. Занятие №3 Палеозойская эра
Палеозойская эра Вирус Марбург
Вирус Марбург Обобщающий урок Строение и многообразие покрытосеменных растений
Обобщающий урок Строение и многообразие покрытосеменных растений Дигибридное скрещивание
Дигибридное скрещивание Презентация на тему ВЛИЯНИЕ ШУМА НА ОРГАНИЗМ ЧЕЛОВЕКА
Презентация на тему ВЛИЯНИЕ ШУМА НА ОРГАНИЗМ ЧЕЛОВЕКА  787229
787229 Функциональная анатомия органов дыхания
Функциональная анатомия органов дыхания Вода в теле человека
Вода в теле человека Сибирский багульник
Сибирский багульник