Содержание
- 2. Белки́ (протеи́ны, полипепти́ды) (англ. Proteins) высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
- 3. Образование полипептидов и биосинтез белка В живых организмах полипептидные (белковые) цепи синтезируются специальными молекулярными комплексами –
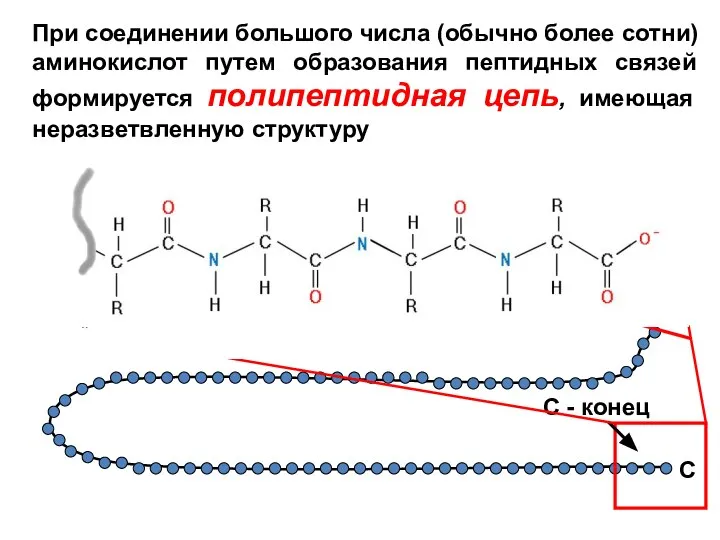
- 4. При соединении большого числа (обычно более сотни) аминокислот путем образования пептидных связей формируется полипептидная цепь, имеющая
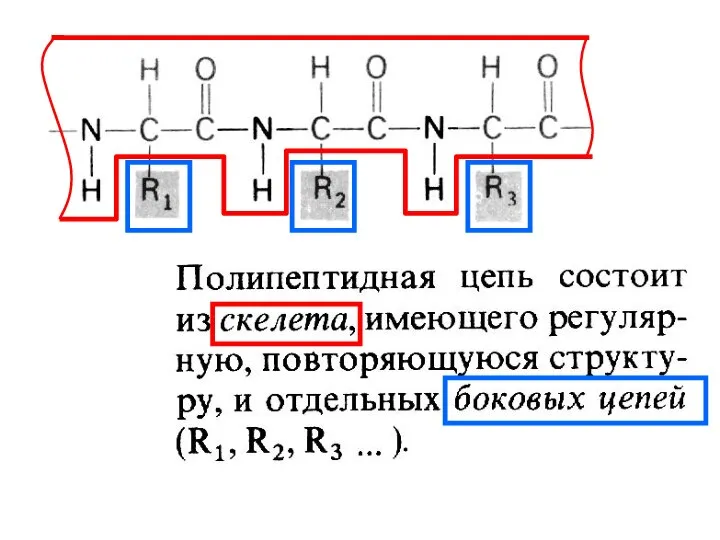
- 6. 1. Белки состоят из одной или нескольких полипептидных цепей 2. Последовательность аминокислот в полипептидных цепях белка
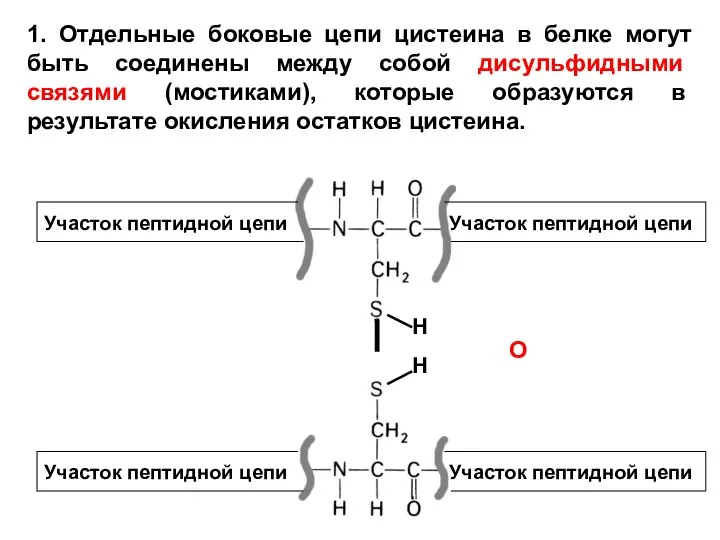
- 7. 1. Отдельные боковые цепи цистеина в белке могут быть соединены между собой дисульфидными связями (мостиками), которые
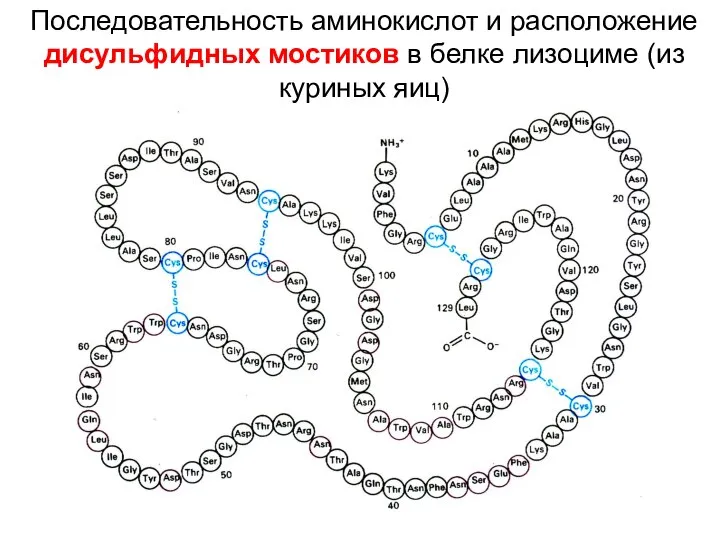
- 8. Последовательность аминокислот и расположение дисульфидных мостиков в белке лизоциме (из куриных яиц)
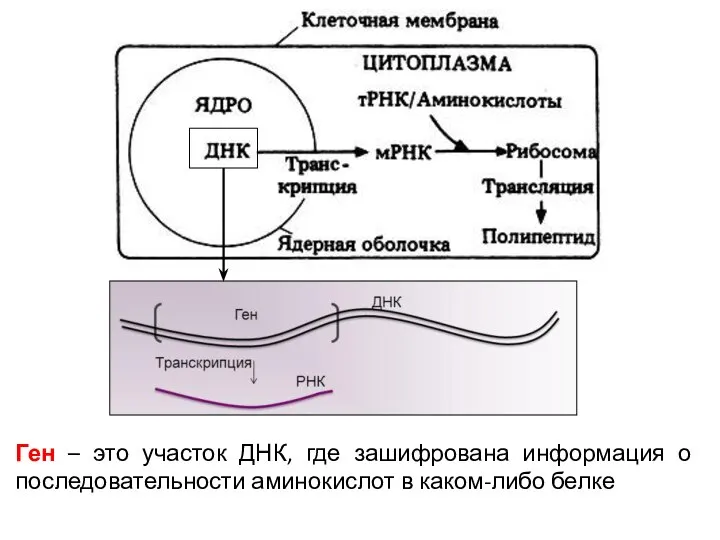
- 9. Ген – это участок ДНК, где зашифрована информация о последовательности аминокислот в каком-либо белке
- 10. 3. После синтеза белка некоторые аминокислотные остатки могут подвергаться специфической посттрансляционной модификации – к ним присоединяются
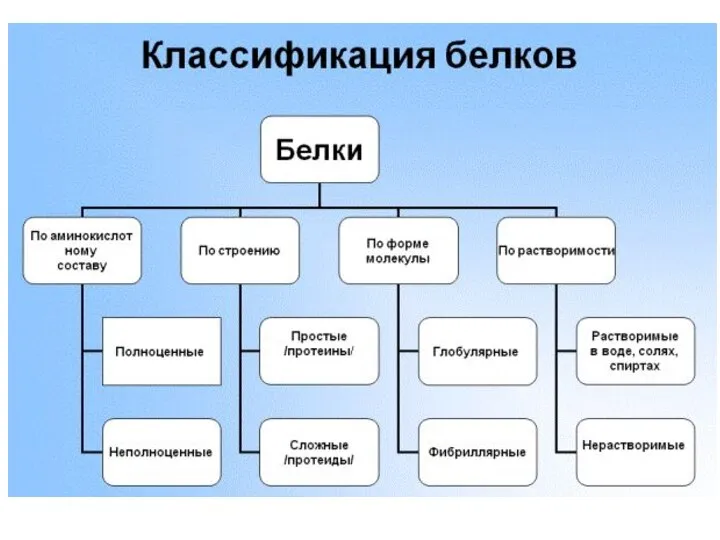
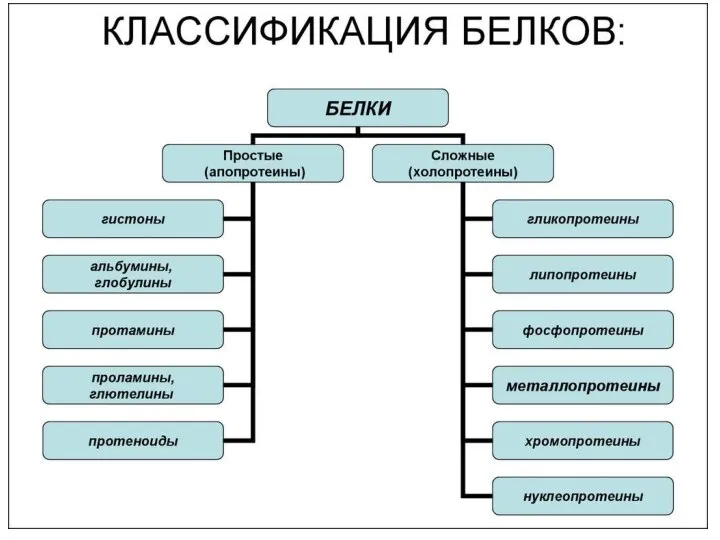
- 11. Простые и сложные белки Простые белки содержат только аминокислотные остатки Сложные белки содержат еще и неаминокислотные
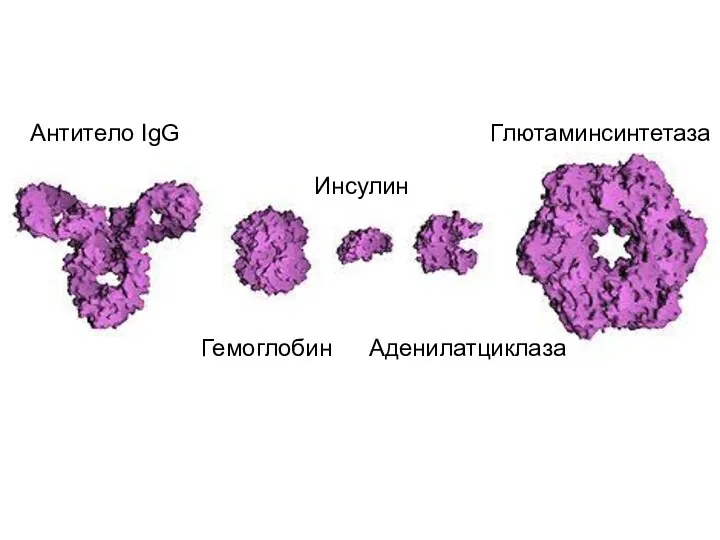
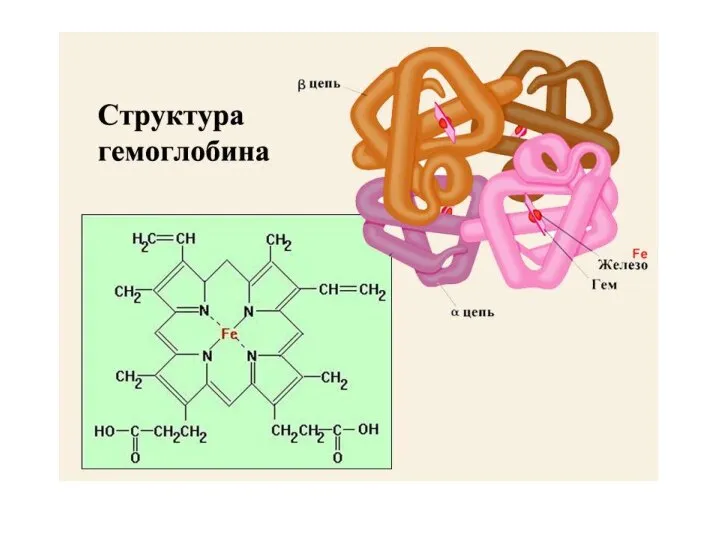
- 12. Антитело IgG Гемоглобин Инсулин Аденилатциклаза Глютаминсинтетаза
- 13. Все белки обязательно имеют две характеристики: Молекулярная масса Изоэлектрическая точка А́томная едини́ца ма́ссы (русское обозначение: а.
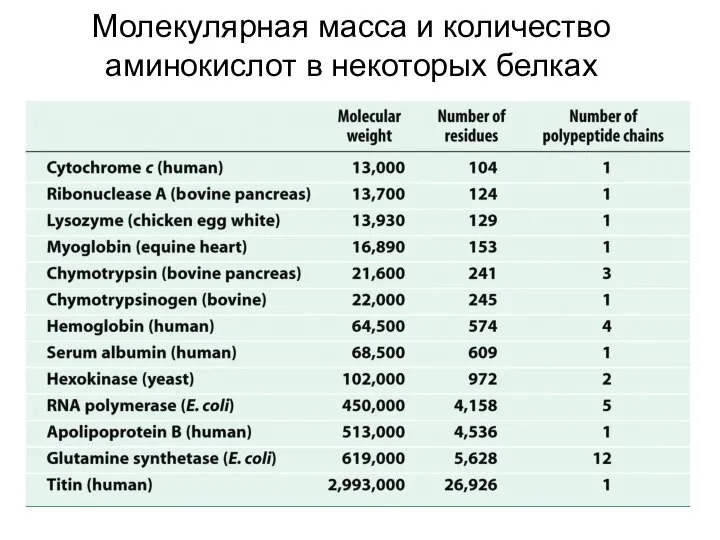
- 15. Молекулярная масса и количество аминокислот в некоторых белках
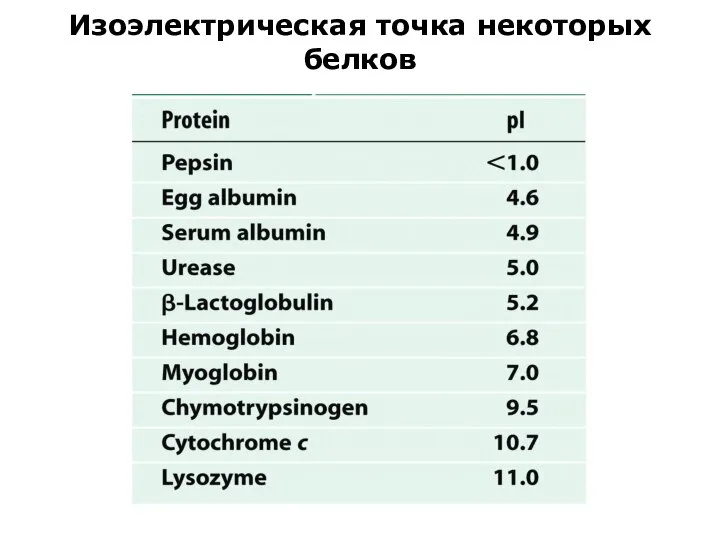
- 16. Изоэлектрическая точка некоторых белков
- 18. Пищевая ценность белков определяется способностью перевариваться в ЖКТ и содержанием незаменимых аминокислот Например, белки яиц, молока,
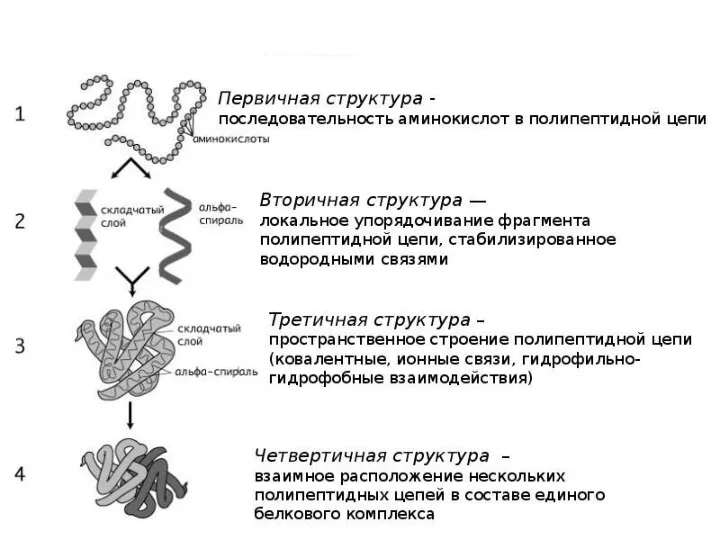
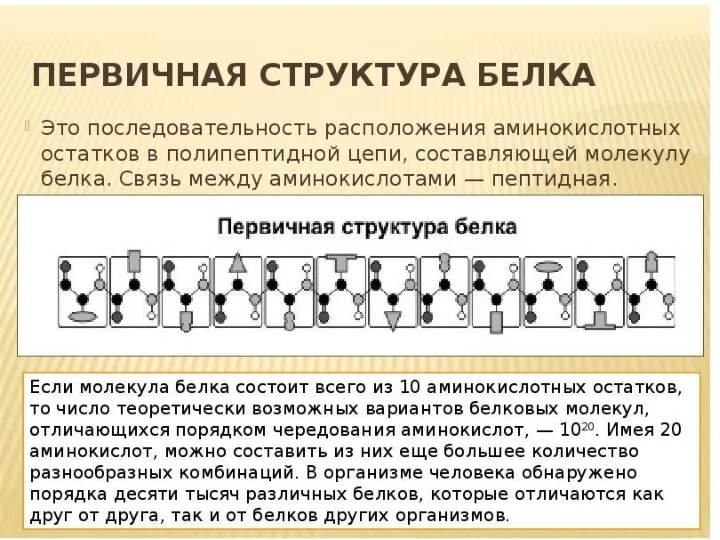
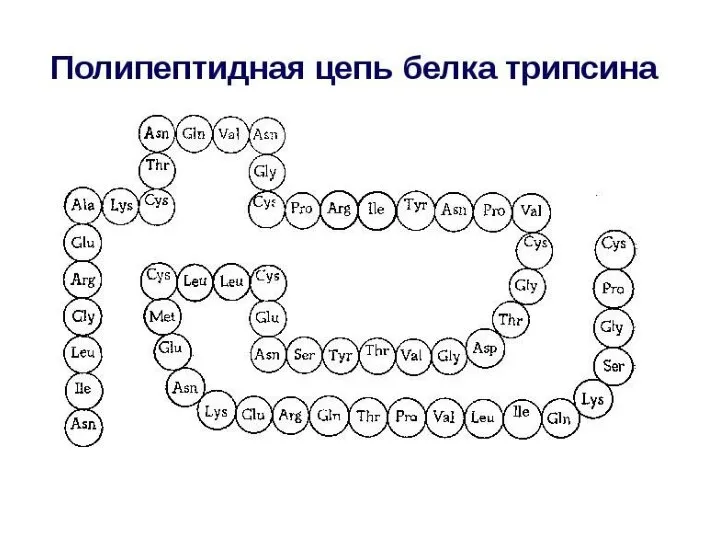
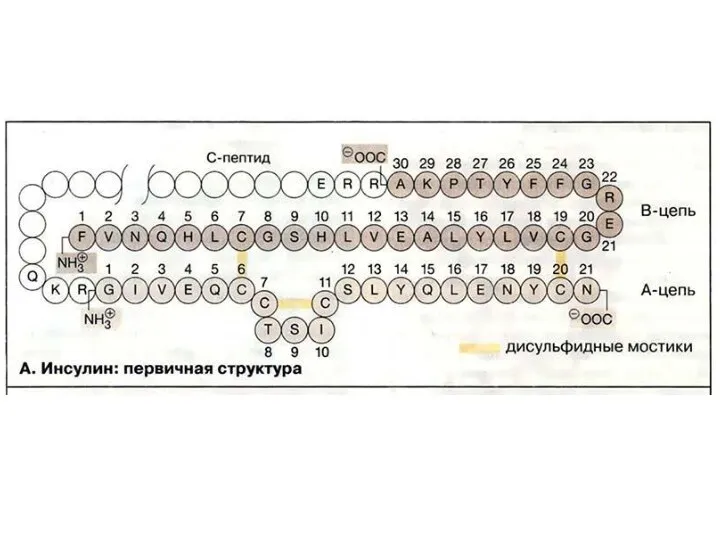
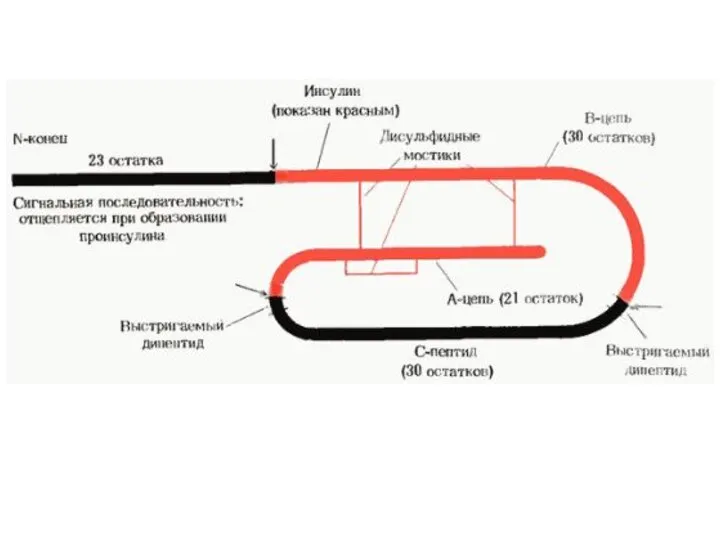
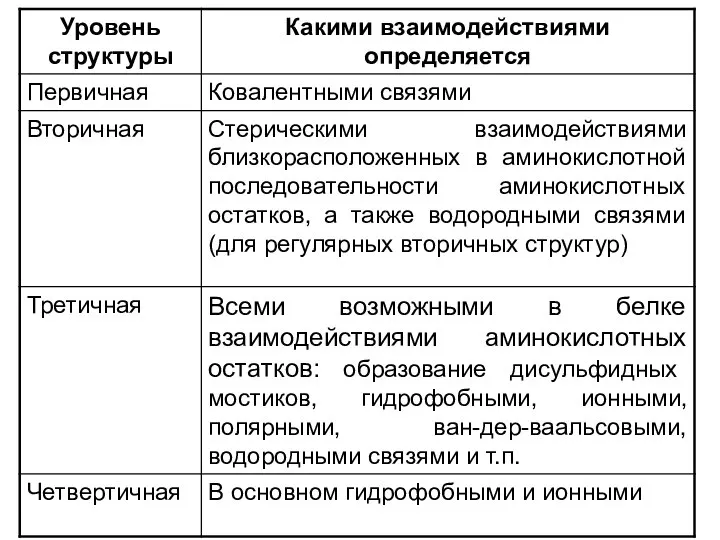
- 21. Уровни структуры белка Первичная структура – последовательность аминокислотных остатков в полипептидных цепях. Первичная структура полностью описывает
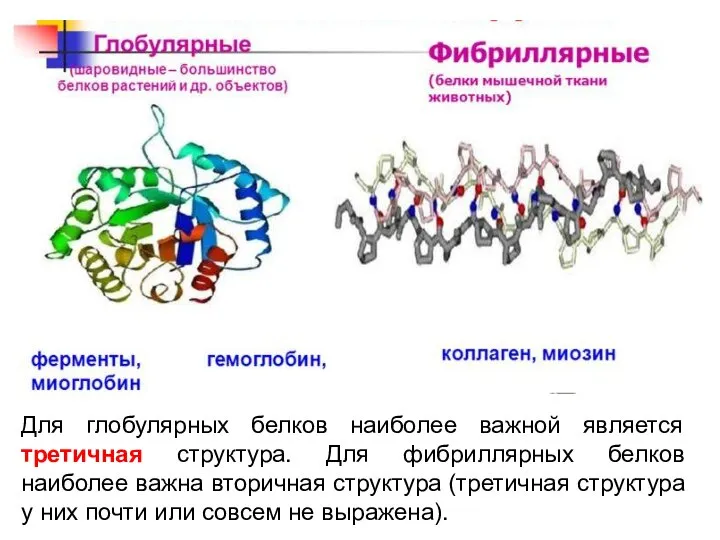
- 28. Для глобулярных белков наиболее важной является третичная структура. Для фибриллярных белков наиболее важна вторичная структура (третичная
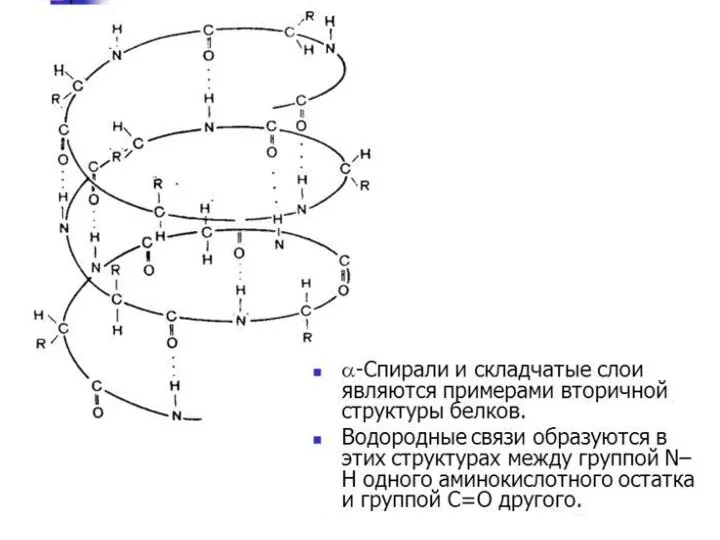
- 29. Вторичная структура
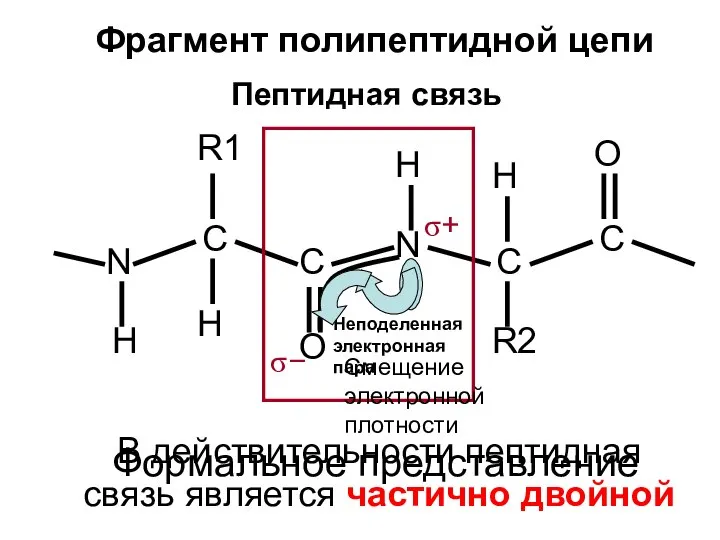
- 30. Пептидная связь N H C R1 H C O N H R2 C H C O
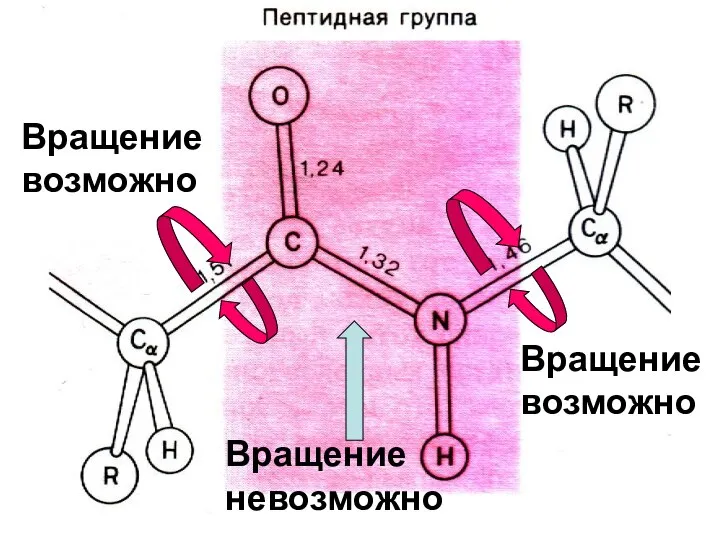
- 31. Вращение невозможно Вращение возможно Вращение возможно
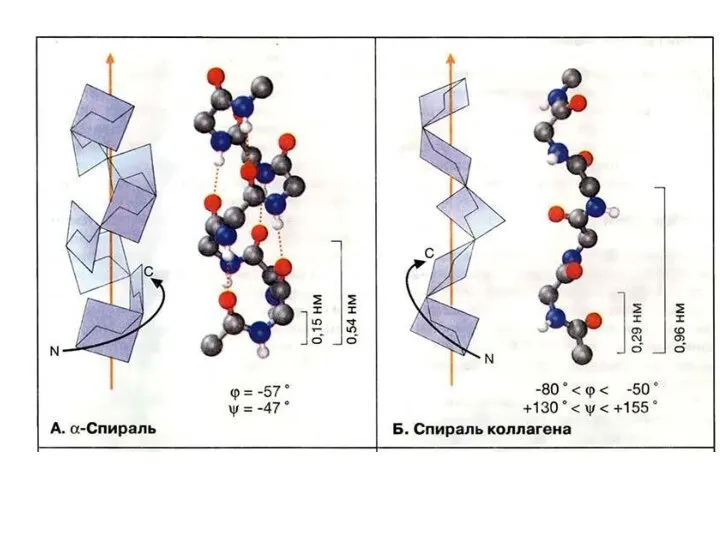
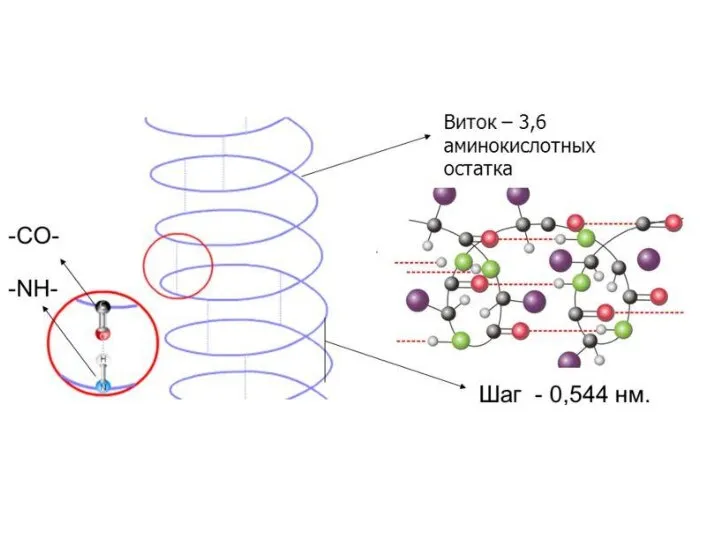
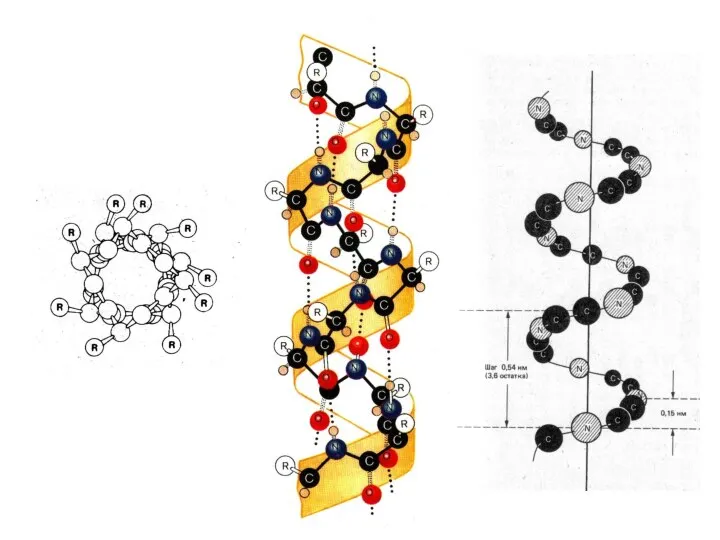
- 32. Типы регулярных вторичных структур α-спираль β-слой ! В белках обычно встречается правая альфа-спираль.
- 33. Свойства α-спирали Шаг правой α-спирали – 0,54 нанометра (3,6 аминокислотных остатка). Шаг левой α-спирали 0,96 нанометра
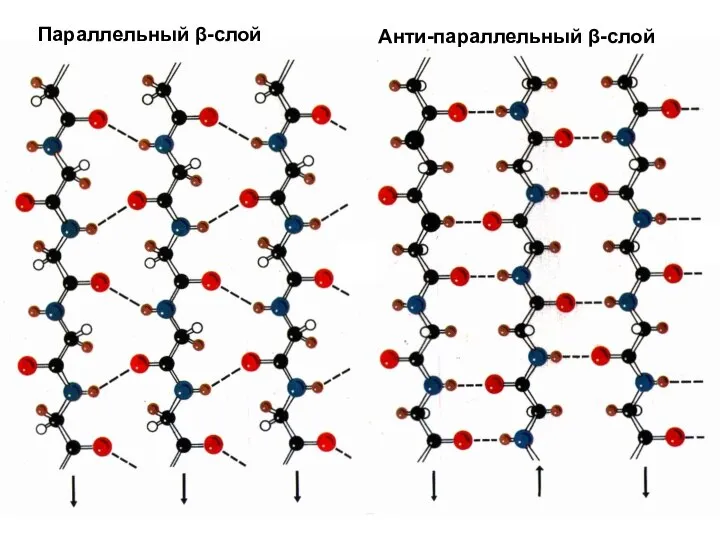
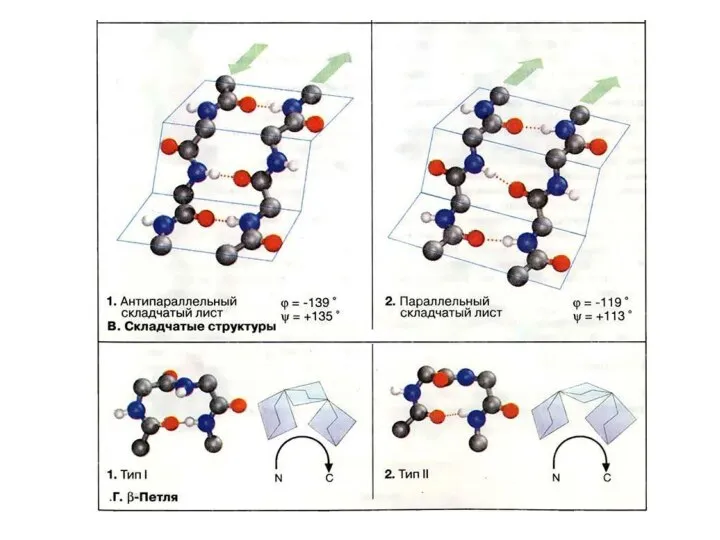
- 38. Типы β-слоев 1. Параллельный (соседние полипептидные цепи идут в одном направлении) 2. Антипараллельный (соседние цепи идут
- 39. Параллельный β-слой Анти-параллельный β-слой
- 41. В типичном белке около 60% аминокислотных остатков принимает участие в формировании регулярных вторичных структур.
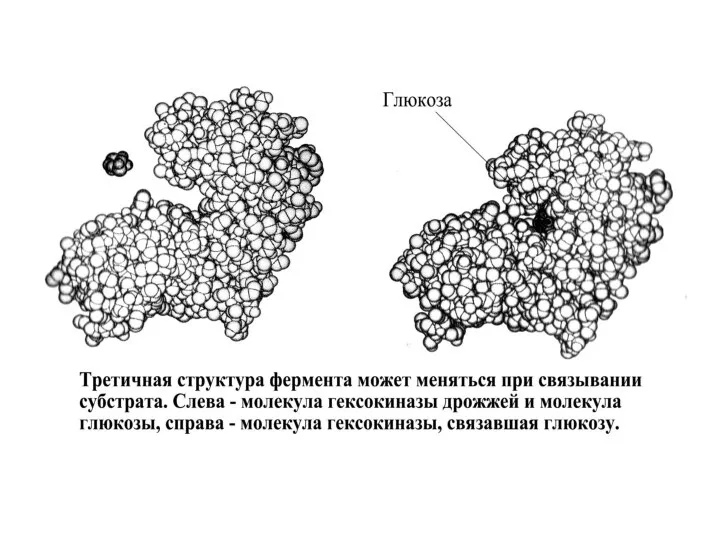
- 42. 1. Третичная структура белка – общая укладка полипептидной цепи. 2. Третичная структура каждого белка уникальна. Третичная
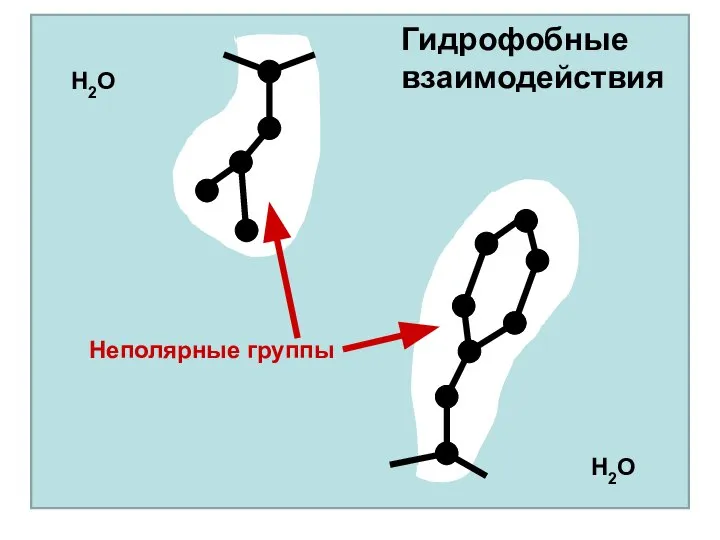
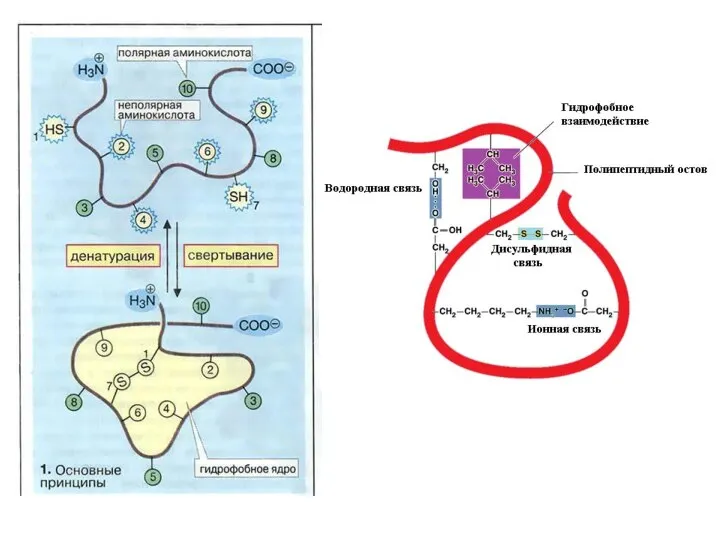
- 43. Взаимодействия, формирующие третичную структуру белка Гидрофобные Гидрофобные взаимодействия связаны с тем, что гидрофобные (неполярные и незаряженные)
- 44. Неполярные группы Гидрофобные взаимодействия H2O H2O
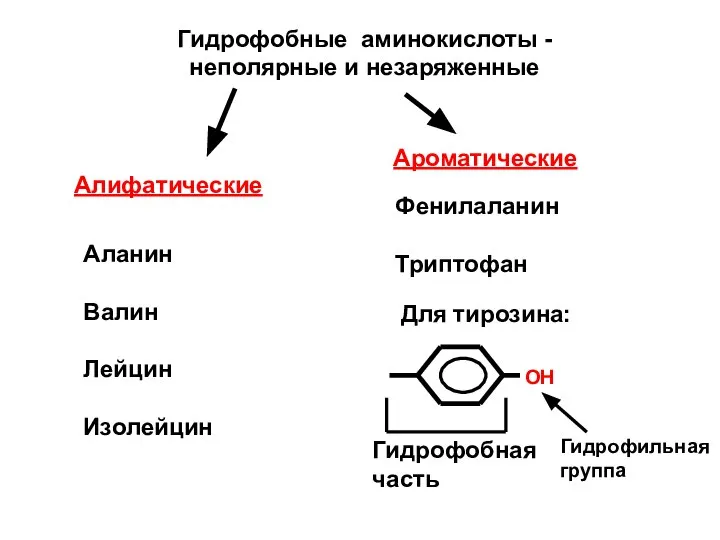
- 45. Гидрофобные аминокислоты - неполярные и незаряженные Алифатические Ароматические Аланин Валин Лейцин Изолейцин Фенилаланин Триптофан Для тирозина:
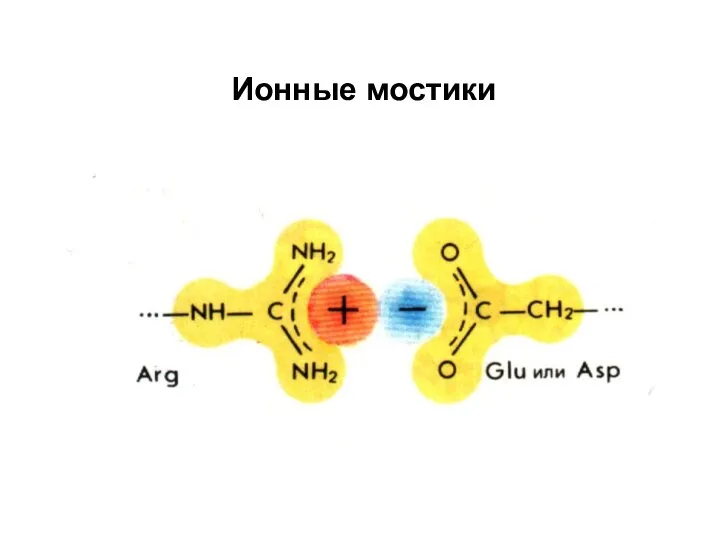
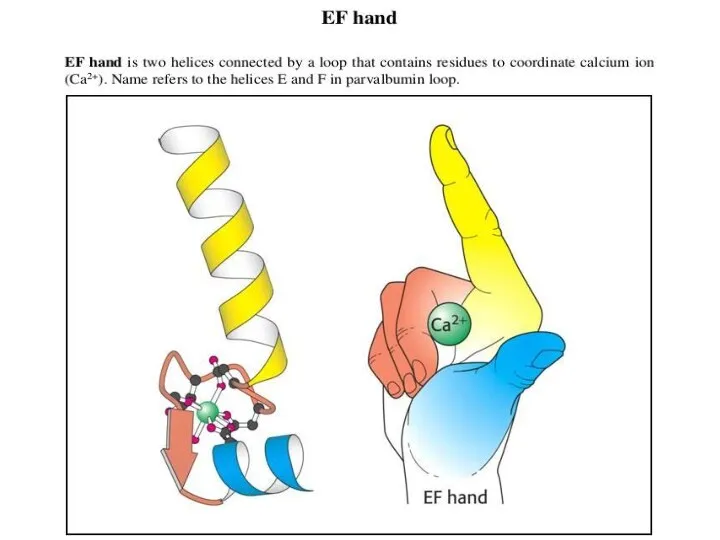
- 46. На поверхности белка располагаются аминокислотные остатки с ионогенными боковыми цепями, которые могут нести заряд. Будут ли
- 47. Ионные мостики
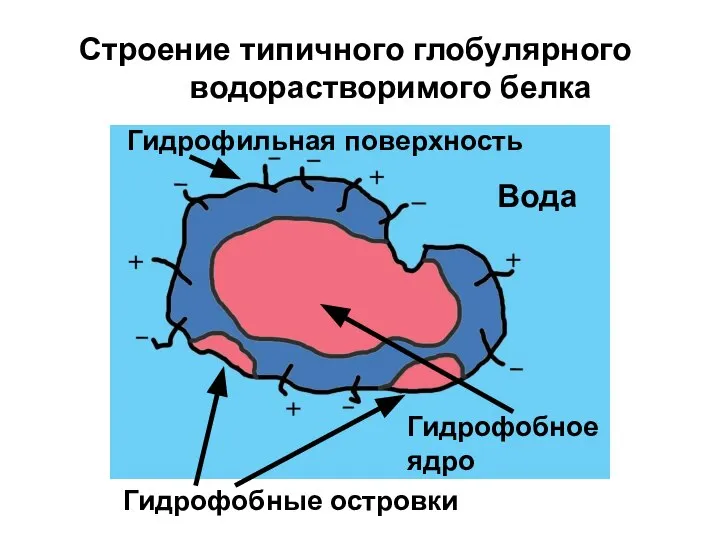
- 48. Строение типичного глобулярного водорастворимого белка Вода Гидрофобное ядро Гидрофильная поверхность Гидрофобные островки
- 49. Процесс формирования трехмерной структуры белка – сворачивание (фолдинг) белка. Фолдинг белка происходит, в нормальных условиях, самопроизвольно
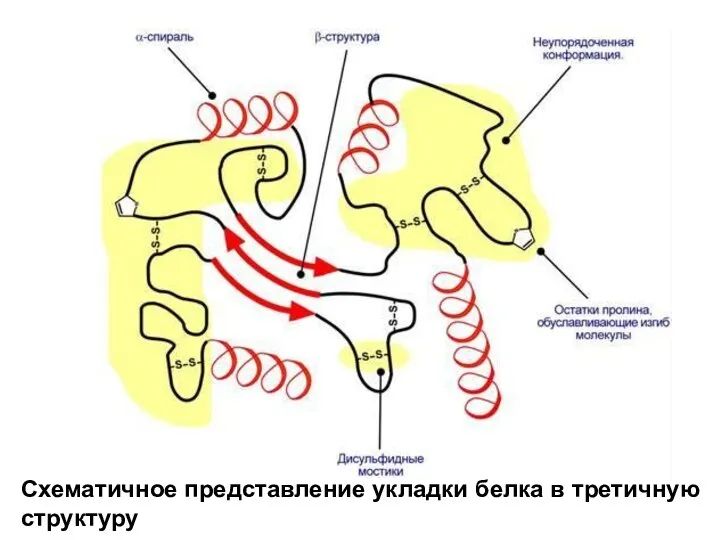
- 50. Схематичное представление укладки белка в третичную структуру
- 52. Отдельные аминокислотные остатки, удаленные в аминокислотной последовательности полипептида, сближены в третичной структуре белка. Так образуются активные
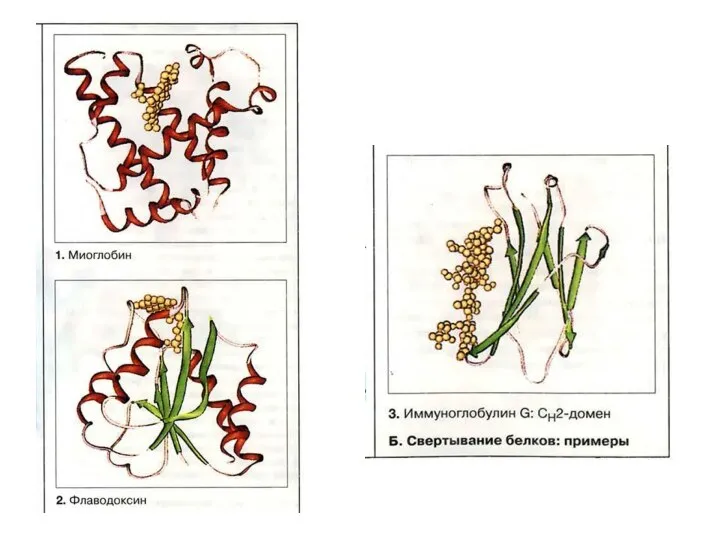
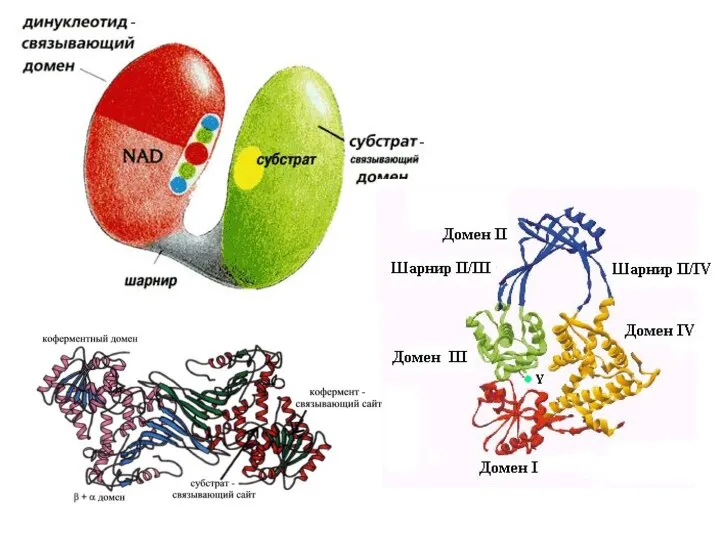
- 55. Домен белка — элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, фолдинг
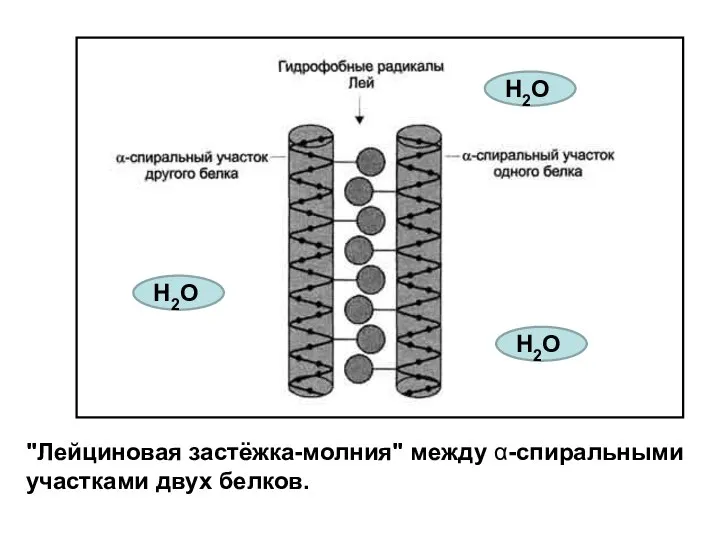
- 56. "Лейциновая застёжка-молния" между α-спиральными участками двух белков. Н2О Н2О Н2О
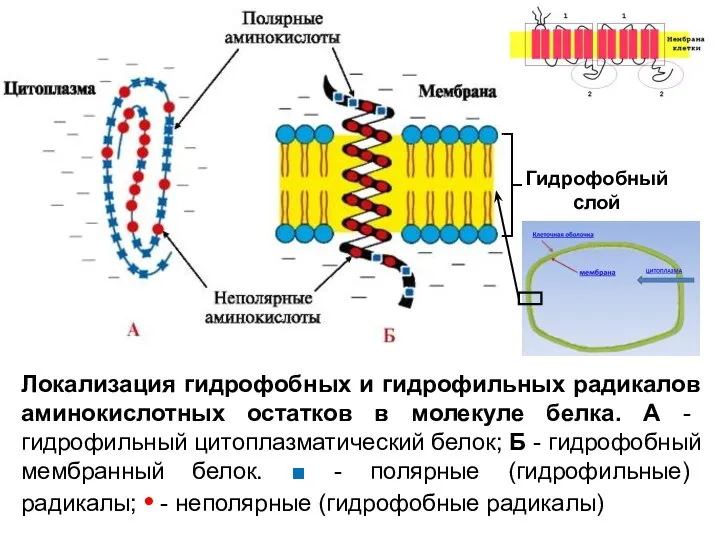
- 57. Локализация гидрофобных и гидрофильных радикалов аминокислотных остатков в молекуле белка. А - гидрофильный цитоплазматический белок; Б
- 62. !!! Для сложных белков (которые содержат не только аминокислоты, но и неаминокислотные компоненты) расположение неаминокислотных компонентов
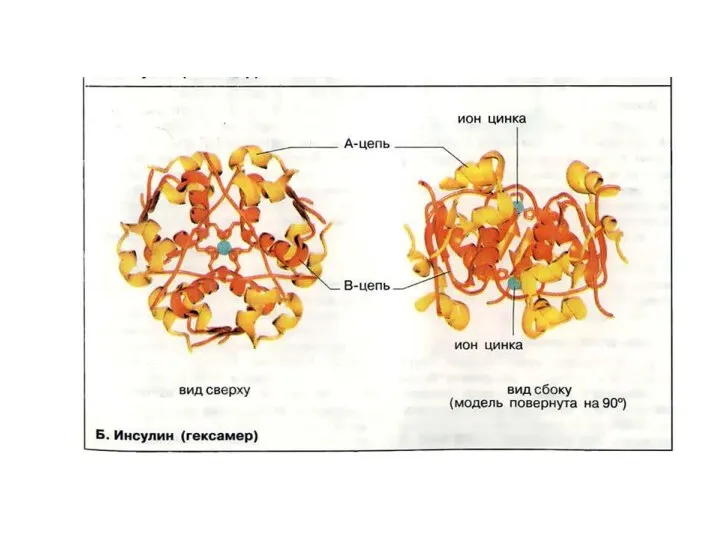
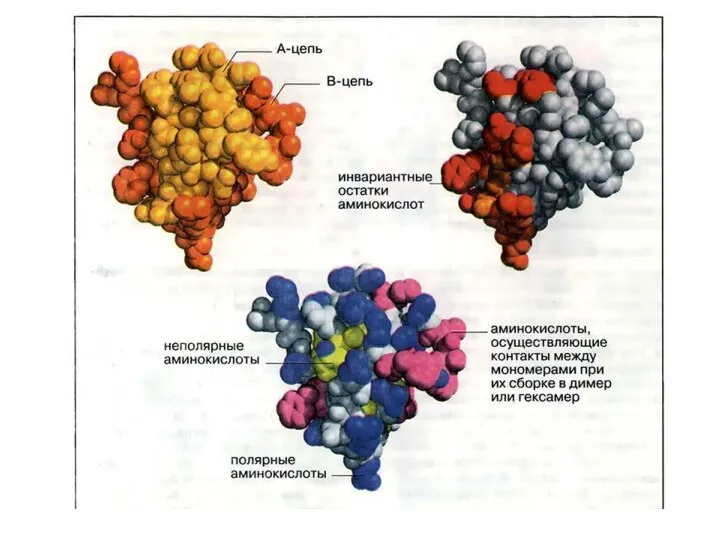
- 63. Четвертичная структура Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными связями,
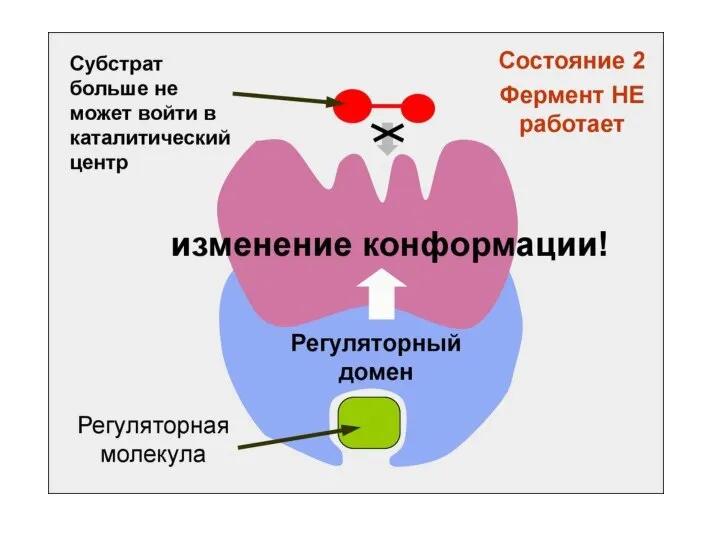
- 67. Многие ферменты имеют две каталитические субъединицы, которые согласованно меняют свою конформацию. В других случаях ферменты имеют
- 68. Сложная третичная и четвертичная структура белков необходима не только для выполнения ими их непосредственной функции, но
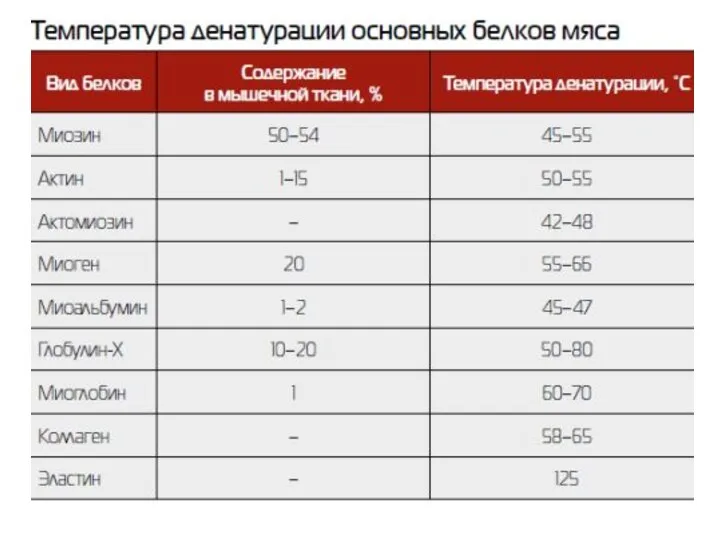
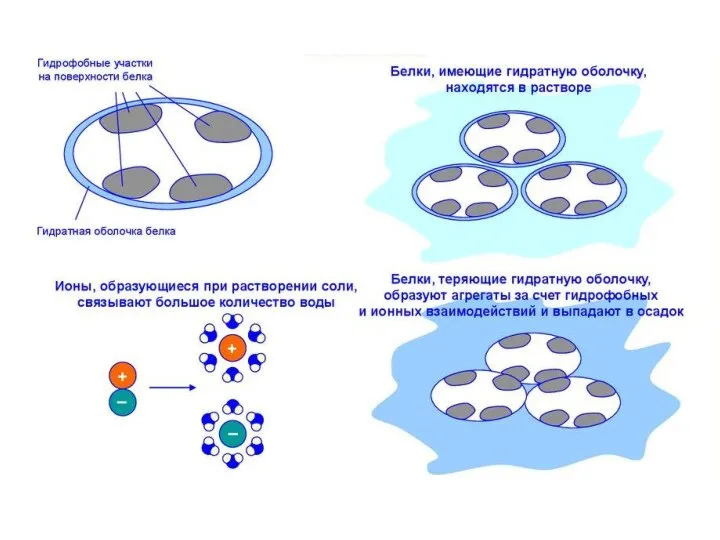
- 70. Денатурация белка Денатурация белка – нарушение вторичной и/или уникальной третичной структуры белка, сопровождающееся изменением его физико-химических
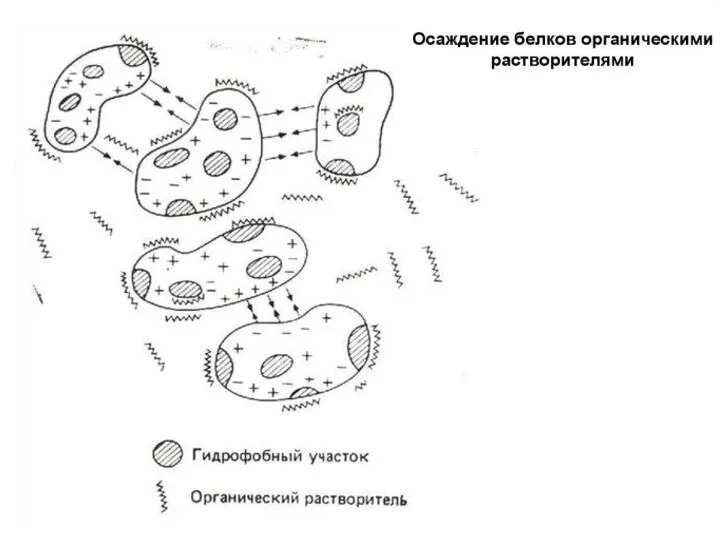
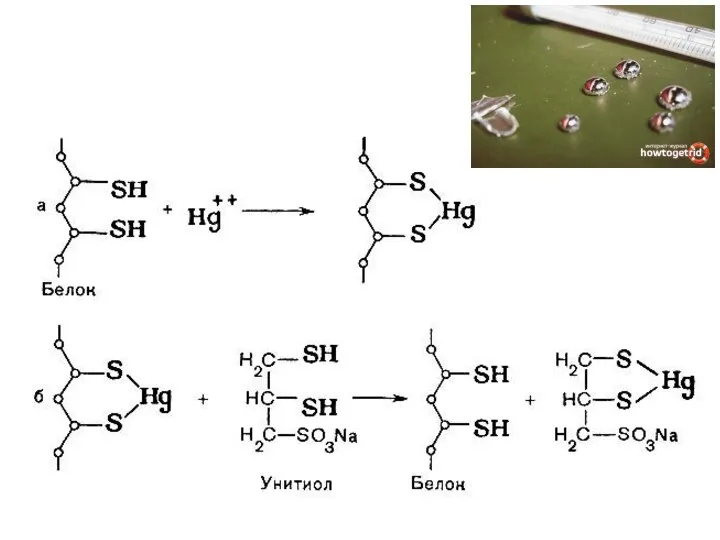
- 72. Денатурирующие агенты и воздействия: 1. Высокая температура 2. Сильные минеральные кислоты и основания. Разрушают ионные мостики
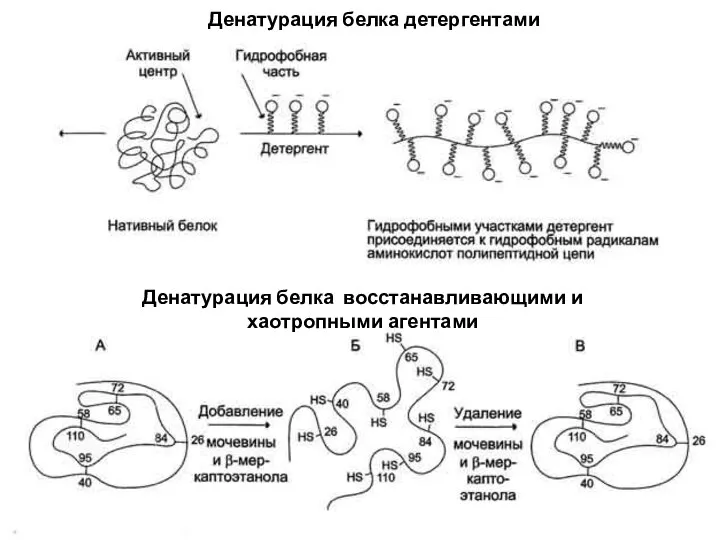
- 78. Денатурация белка детергентами Денатурация белка восстанавливающими и хаотропными агентами
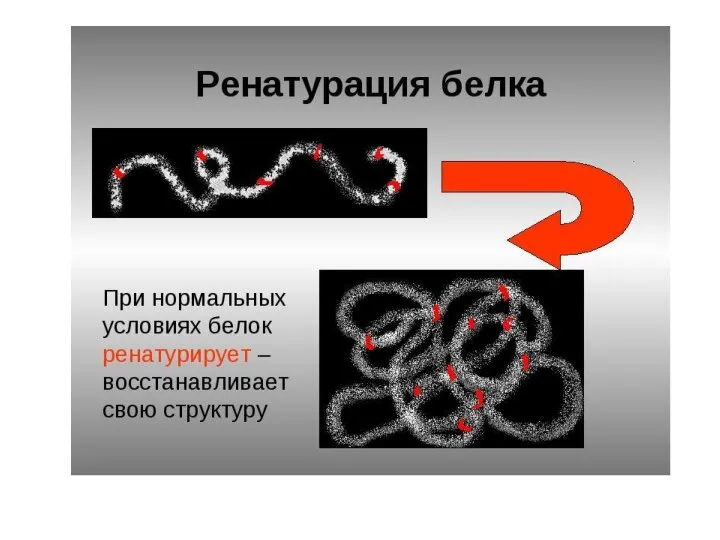
- 80. Ренатурация белка Если белок при денатурации остался в растворе, он может быть ренатурирован при возвращении условий
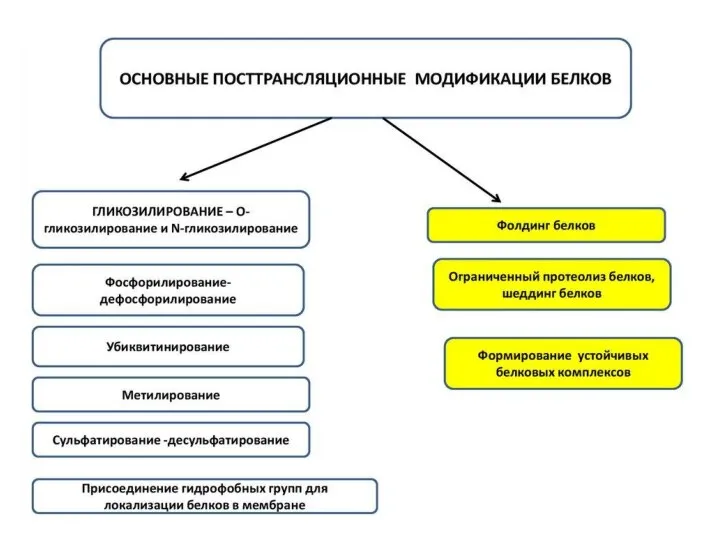
- 82. Посттрансляционная модификация белков
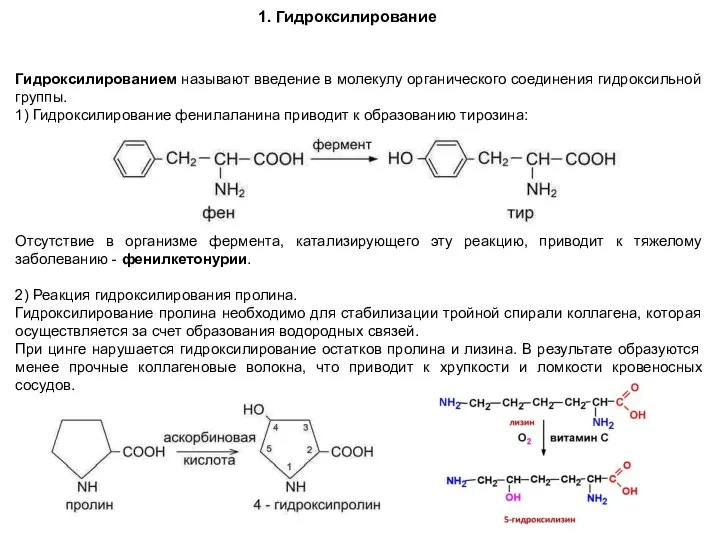
- 84. 1. Гидроксилирование Гидроксилированием называют введение в молекулу органического соединения гидроксильной группы. 1) Гидроксилирование фенилаланина приводит к
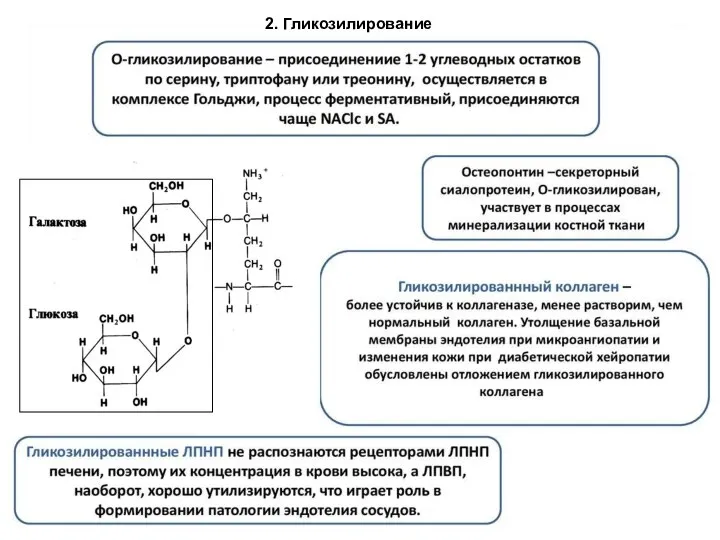
- 85. 2. Гликозилирование
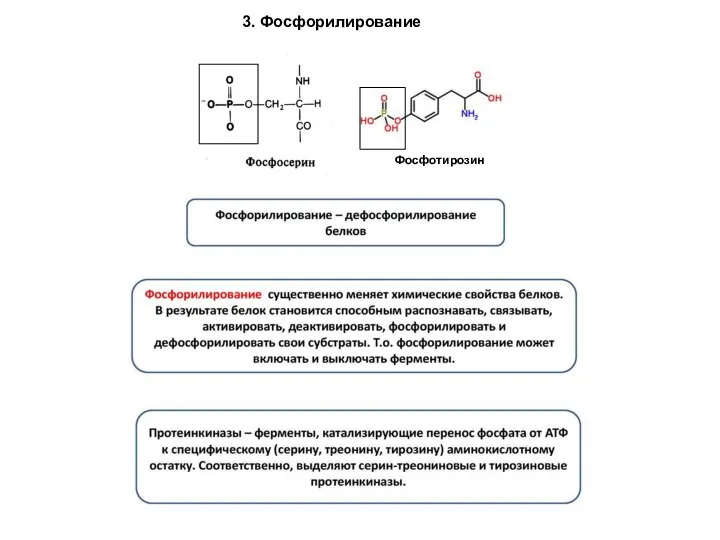
- 86. 3. Фосфорилирование Фосфотирозин
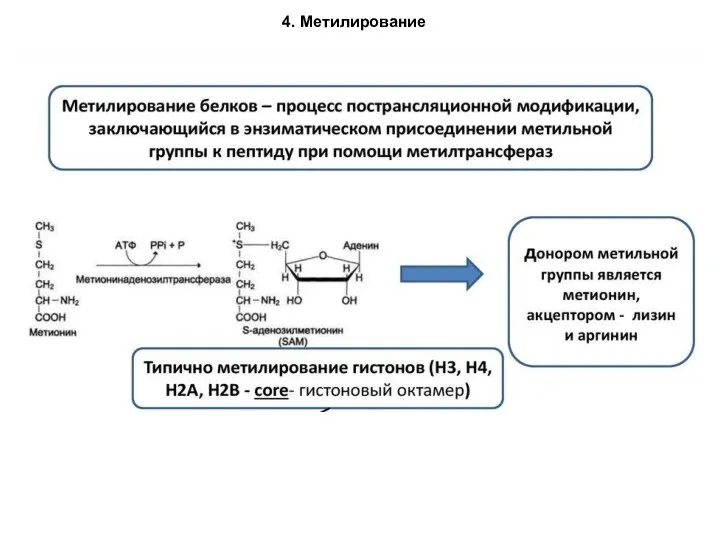
- 87. 4. Метилирование
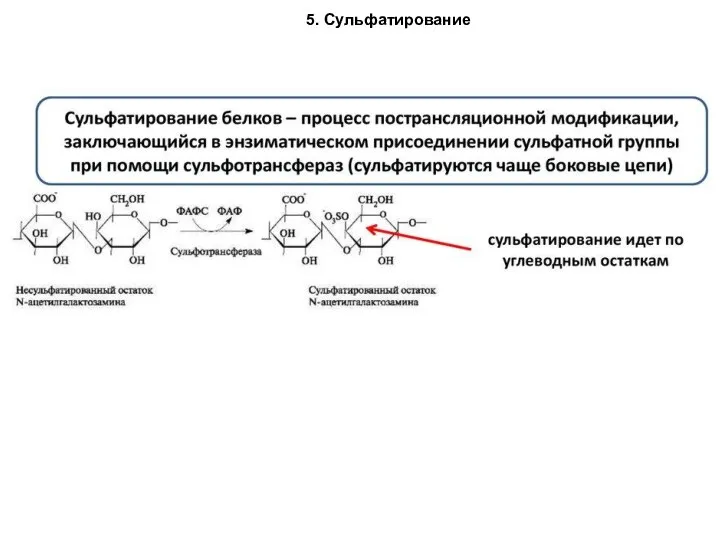
- 88. 5. Сульфатирование
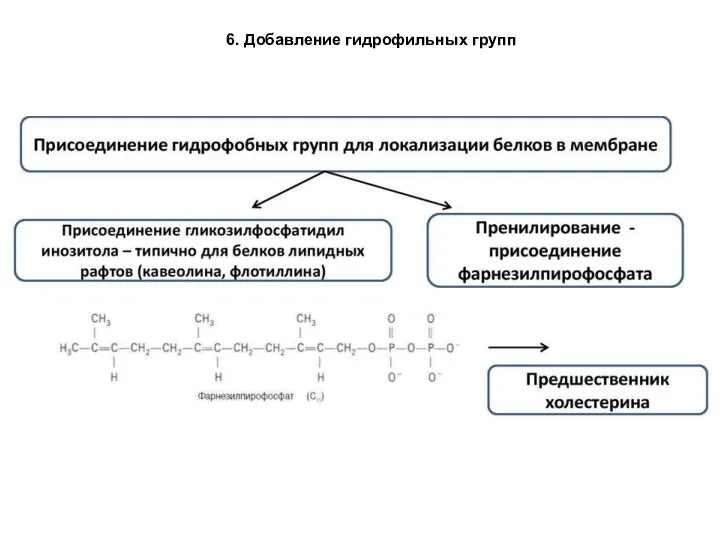
- 89. 6. Добавление гидрофильных групп
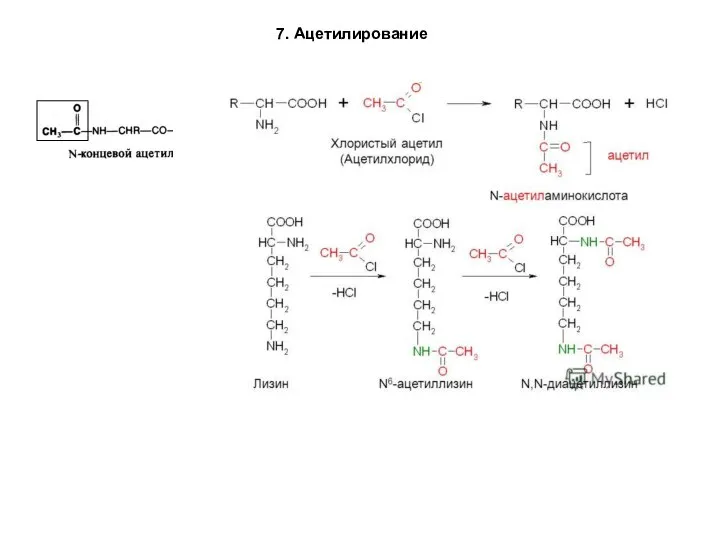
- 90. 7. Ацетилирование
- 91. Катаболизм белков
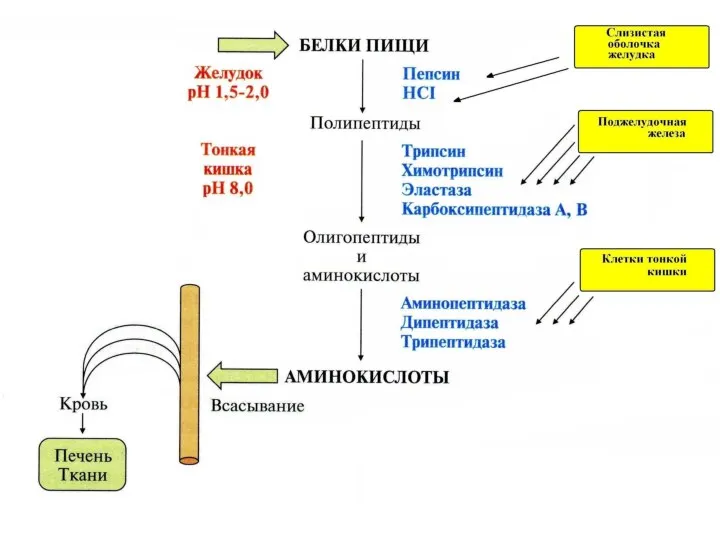
- 92. 1. В нейтральной среде полипептидная цепь является химически стабильной. В сильнокислой среде и при нагревании, полипептидная
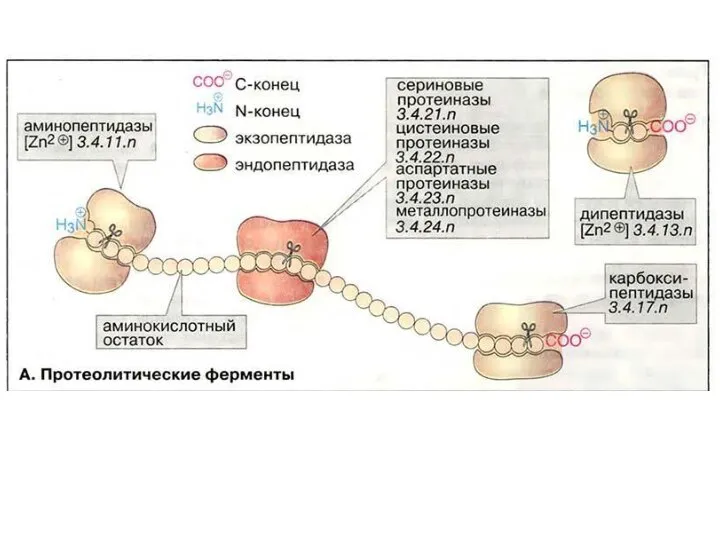
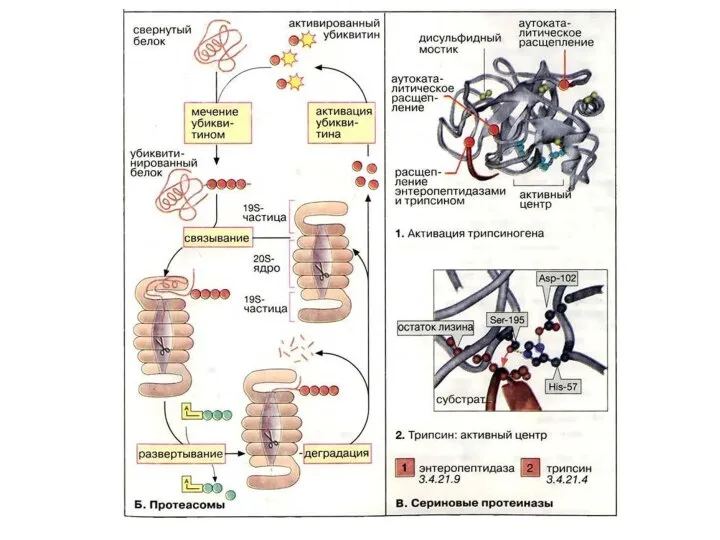
- 93. Ферменты, осуществляющие деградацию белков, называются протеазами. По месту атаки молекулы субстрата протеолитические ферменты делятся на: 1.
- 98. Скачать презентацию



































 Томский лес
Томский лес Особенности строения и жизнедеятельности земноводных
Особенности строения и жизнедеятельности земноводных Митоз. Общая биология, 9 класс
Митоз. Общая биология, 9 класс Открытия в области биотехнологии
Открытия в области биотехнологии Нервная регуляция работы внутренних органов
Нервная регуляция работы внутренних органов Методы создания ГМО
Методы создания ГМО Характер строения и окраска ствола и ветвей
Характер строения и окраска ствола и ветвей Ткани. Эпителиальные, соединительные, мышечные, нервная ткани. Строение и функция нейрона. Синапс. Образование тканей
Ткани. Эпителиальные, соединительные, мышечные, нервная ткани. Строение и функция нейрона. Синапс. Образование тканей Жануарлар мiнез
Жануарлар мiнез Распорядок дня у студента
Распорядок дня у студента Насекомые, амбарные вредители
Насекомые, амбарные вредители Череп. Интересные факты
Череп. Интересные факты Пищеварительные железы. Брюшина
Пищеварительные железы. Брюшина Домашние птицы
Домашние птицы Значение и мероприятия селекционно-племенной работы в животноводстве
Значение и мероприятия селекционно-племенной работы в животноводстве Строение синапса
Строение синапса Микромир, как искусство
Микромир, как искусство Скелет туловища
Скелет туловища Ретикулярная восходящая активирующая система
Ретикулярная восходящая активирующая система Как выбрать породу собаки
Как выбрать породу собаки Тема: Влияние температуры на живые организмы Цели: Дать понятие абиотическому фактору, тепловому балансу Проклассифицировать ра
Тема: Влияние температуры на живые организмы Цели: Дать понятие абиотическому фактору, тепловому балансу Проклассифицировать ра Презентация на тему ТИП ГУБКИ
Презентация на тему ТИП ГУБКИ  Лекция 3 Физиология микроорганизмов
Лекция 3 Физиология микроорганизмов Комнатные растения
Комнатные растения Пищеварение и всасывание в кишечнике
Пищеварение и всасывание в кишечнике Физиология нейронов и глии
Физиология нейронов и глии Пищеварительная система. Часть 2
Пищеварительная система. Часть 2 Технологии животноводства. Заболевания животных и их предупреждение
Технологии животноводства. Заболевания животных и их предупреждение