Слайд 2 Камышева К.С. Основы микробиологии и иммунологии Уч. пособие. «Феникс», 2015 г.

с.252-259
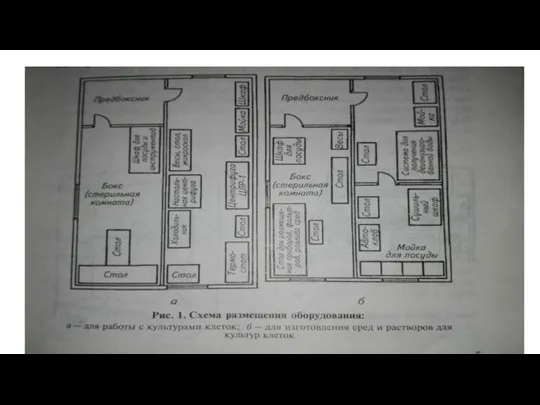
Слайд 3Устройство вирусологической лаборатории.
Для организации диагностической лаборатории используют изолированный отсек, состоящий не менее

чем из 5-6 комнат.
Слайд 5Под лабораторию отводят светлое помещение.
Комнаты для работы с вирусным материалом должны

быть хорошо освещены и состоять из предбоксника и бокса, разделенных стеклянной перегородкой с дверьми.
В боксах размещают только столы, стулья и принадлежности для работы.
Поверхность столов покрывают нержавеющей сталью, пластиком или стеклом, а над рабочей поверхностью устанавливают бактерицидные лампы.
Слайд 6У входа в бокс кладут резиновый губчатый дезковрик, пропитанный дезраствором.
В предбокснике

лежат стерильная одежда и оборудование, соответствующее назначению бокса.
Лабораторию обеспечивают холодной и горячей водой и вентиляцией с подачей стерильного воздуха.
Слайд 7Для регистрации поступающего патматериала предназначена приемная,где размещают несколько столов, обитых оцинкованной жестью, и

емкости с дезрастворами (3% хлорамина, натрия гидроксида или 5% фенола).
В комнате для предварительной обработки материала (вскрывочной) вскрывают трупы и отбирают материал для дальнейшего исследования.
Слайд 8Комнаты-боксы оборудуют в зависимости от назначения.
В автоклавной стерилизуют посуду, питательные среды, аппаратуру,

питательные среды и обезвреживают инфекционный материал. Необходимо иметь два автоклава: для чистых материалов и для инфицированных.
Моечная предназначена для мытья посуды, аппаратуры и приборов.
Слайд 9Виварий должен иметь карантинное отделение, комнаты для здоровых и экспериментальных животных и

подсобные помещения.
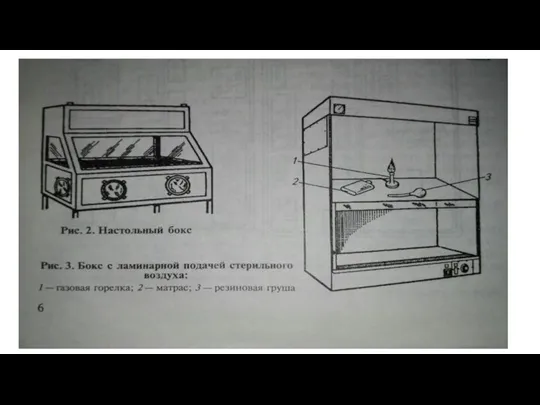
Для вирусологической лаборатории любого типа обязательной частью лаборатории является настольный бокс или лучше бокс с ламинарной подачей воздуха.
Слайд 11ТРЕБОВАНИЯ К СБОРУ, ХРАНЕНИЮ И ТРАНСПОРТИРОВКЕ МАТЕРИАЛА ДЛЯ ВИРУСОЛОГИЧЕСКИХ И СЕРОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Результаты

вирусологических и серологических исследований в значительной степени зависят от правильного сбора, хранения и транспортировки проб в лабораторию.
Сбор, хранение и транспортировка материала:
При необходимости берут мазки из зева и носа обычными сухими стерильными тампонами, которыми пользуются для проведения исследования на дифтерию (не позже 5 дней от момента заболевания). Один тампон вводится сначала в одну ноздрю, вдоль носовой перегородки, а затем в другую. Тампон из носа удаляется не сразу, он должен впитать носовое отделяемое. Другим тампоном берется мазок с задней стенки глотки и миндалин. Мазки из зева рекомендуется делать до еды или через 2 часа после приема пищи. Оба тампона помещают в одну пробирку. В день взятия материал доставляется в лабораторию либо подвергается замораживанию при t -20 град. С.
Слайд 12Забор ликвора для вирусологического исследования берется в стационаре одновременно со взятием его

с лечебной целью или для проведения исследования в клинической или бактериологической лаборатории. Спинномозговая жидкость берется стерильно в количестве 2 - 3 мл в сухую стерильную пробирку.
Слайд 13Для диагностического исследования необходимо две пробы крови больного (по 1 мл), 1

проба должна быть взята в день постановки первичного диагноза, 2 проба - через 2 - 3 недели после первой.
Забор крови для серологического исследования на определение антител проводится в количестве 1 мл.
Кровь забирается из пальца. Палец обрабатывают спиртом и прокалывают специальной стерильной иглой мякоть концевой фаланги. Прокол делают немного дальше от средней линии, ближе к боковой поверхности пальца (место прохождения более крупных сосудов пальца).
Слайд 14Выступающие на месте прокола капли собирают краем чистой, стерильной, сухой пробирки так, чтобы

они постепенно стекали на дно.
Рекомендуется слегка массировать боковые стороны пальца по направлению от основания его к ногтевой фаланге.
В холодное время года перед взятием крови необходимо прогреть кисть руки в теплой воде.
На пробирки наклеивают этикетки и с направлением доставляют в вирусологическую лабораторию в день забора. На этикетке, кроме фамилии и имени, указывается, какая порция крови взята (1-я или 2-я).
Слайд 15В сопроводительном документе (направлении) к материалу, собранному для серологического исследования в вирусологическую

лабораторию, необходимо указать:
1. Название учреждения, которое направляет материал на исследования, и телефон.
2. Фамилию и имя (больного) обследуемого.
3. Возраст.
4. Дату заболевания, контакта с больным.
5. Предполагаемый диагноз или повод к обследованию (у больного: кратко клинические данные).
6. Наличие или отсутствие прививок против кори, краснухи или эпидемического паротита.
7. Дату и подпись медицинского лица.
Слайд 16Вирусологические методы исследования — методы изучения биологии вирусов и их идентификации.
В вирусологии

широко используются методы молекулярной биологии, с помощью которых удалось установить молекулярную структуру вирусных частиц, способы проникновения их в клетку и особенности репродукции вирусов, первичной структуры вирусных нуклеиновых кислот и белков.
Слайд 17Развиваются методы определения последовательности составляющих элементов вирусных нуклеиновых кислот и аминокислот белка.

Появляется возможность связать функции нуклеиновых кислот и кодируемых ими белков с последовательностью нуклеотидов и установить причины внутриклеточных процессов, играющих важную роль в патогенезе вирусной инфекции.
Слайд 20 Вирусологические методы исследования основаны также на иммунологических процессах (взаимодействие антигена с

антителами), биологических свойствах вируса (способность к гемагглютинации, гемолизу, ферментативная активность), особенностях взаимодействия вируса с клеткой-хозяином (характер цитопатического эффекта, образование внутриклеточных включений и т.д.).
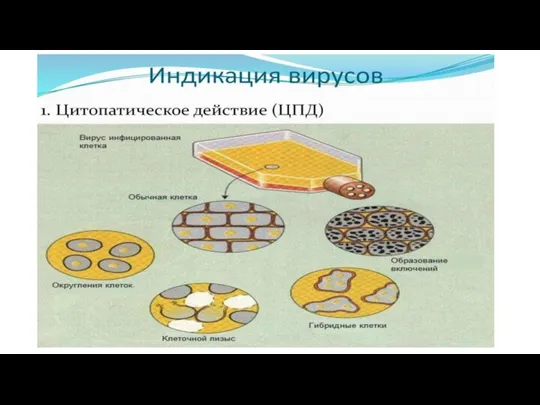
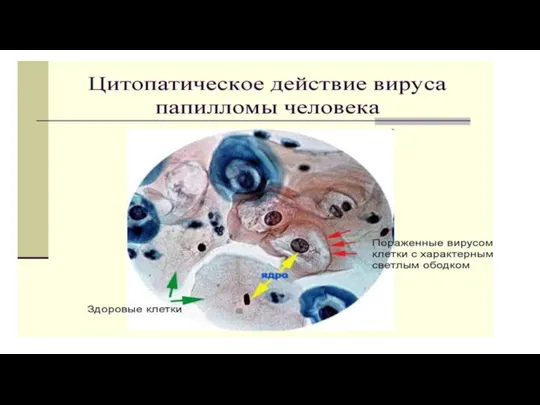
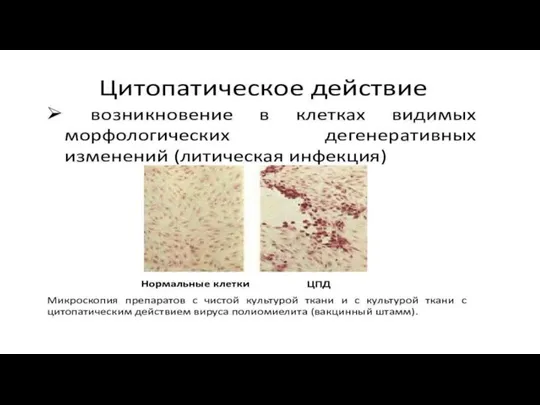
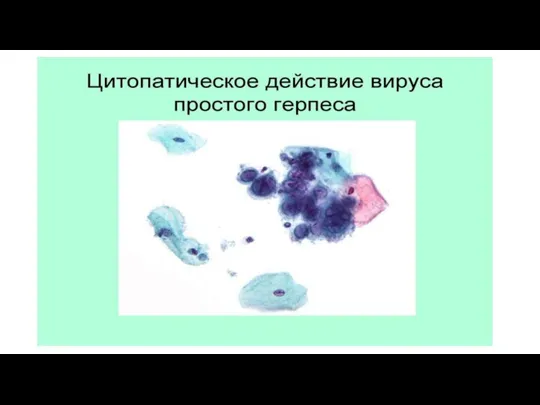
Слайд 22Цитопатический эффект (ЦПЭ). Многие, но отнюдь не все вирусы убивают клетки, в

которых они размножаются, и по мере того как вновь образующиеся вирионы захватывают все большее число клеток, в клетках инфицированного монослоя постепенно накапливаются изменения, которые можно выявить с помощью гистологических методик.
Эти изменения называют цитопатическими эффектами (ЦПЭ), а вызывающие их вирусы — цитопатогенными.
Слайд 28В большинстве случаев ЦПЭ можно наблюдать в нефиксированных, неокрашенных культурах при малом

увеличении микроскопа.
ЦПЭ имеет важное значение при диагностике и выделении вирусов от больных людей или зараженных животных. Некоторые вирусы охотно размножаются в клеточных культурах при первичном выделении.
Слайд 29Время появления первых отчетливых цитопатических изменений зависит отчасти от числа вирионов, которое

содержала проба, однако в гораздо большей степени оно определяется скоростью размножения изучаемого вируса.
Например, энтеровирусы и вирус простого герпеса, характеризующиеся коротким латентным периодом и дающие высокий урожай, обычно вызывают различимый ЦПЭ через 24—48 ч и полностью разрушают монослой примерно через 3 дня.
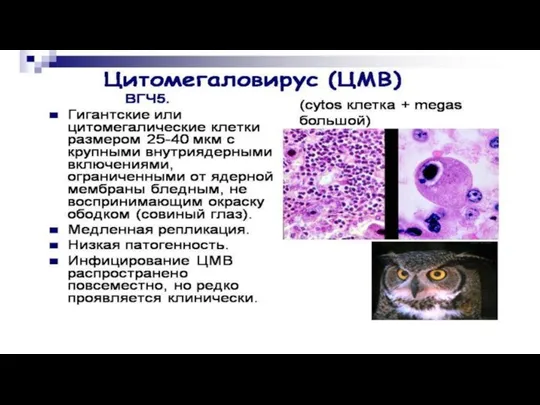
Слайд 30Однако цитомегаловирусы, вирус краснухи и некоторые медленно растущие аденовирусы не вызывают ЦПЭ

в течение нескольких недель. Поскольку за это время культуры клеток подвергаются неспецифической дегенерации, инфицированные клетки и культуральную среду необходимо перенести на свежий монослой.
Слайд 31После такого «слепого пассажа» часто проявляется ЦПЭ, что может быть связано с

увеличением титра вируса или отбором варианта, лучше адаптированного к данной культуре клеток.
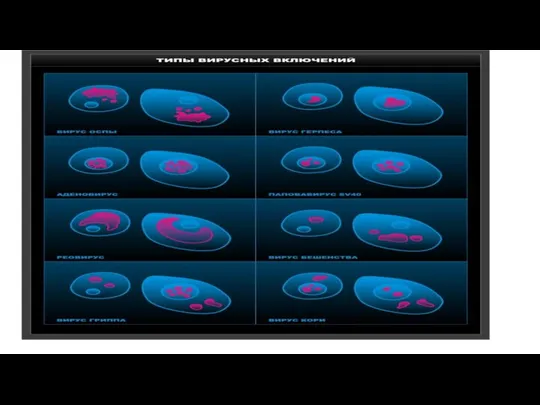
Внутриклеточные включения формируются в заражённых вирусом клетках — это места синтеза и сборки вирусных структур.
Они являются продуктами взаимосодействия вируса и клетки. Внутриклеточные включения могут быть в цитоплазме и в ядрах зараженных вирусом клетках.
Слайд 34По форме включения могут быть округлыми, кристаллоподобными, в виде тяжей и т.п.

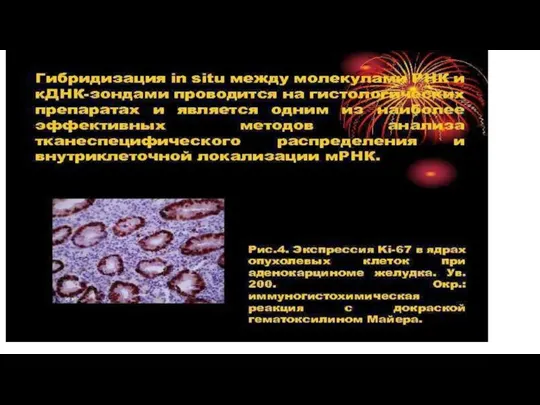
Для идентификации внутриклеточных включений (принадлежности к тому или другому вирусу) часто используют различные серологические реакции (РИФ, ИФА, РИА, ПЦР, метод молекулярной гибридизации, метод иммуноэлектронной микроскопии и др.).
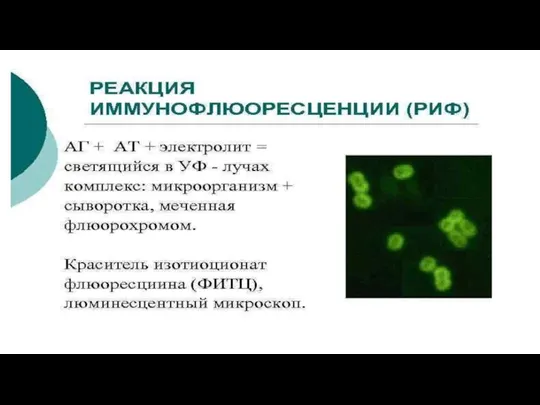
Слайд 35Реакция иммунофлюоресценции (РИФ) — это метод, с помощью которого можно выявить антитела к известным

антигенам. Метод основан на микроскопии окрашенных специальным образом мазков и других образцов тканей. Применяется в основном для обнаружения возбудителей инфекций мочеполовых путей, таких как хламидии, микоплазмы, трихомонады, гонококки, вирус герпеса и пр.
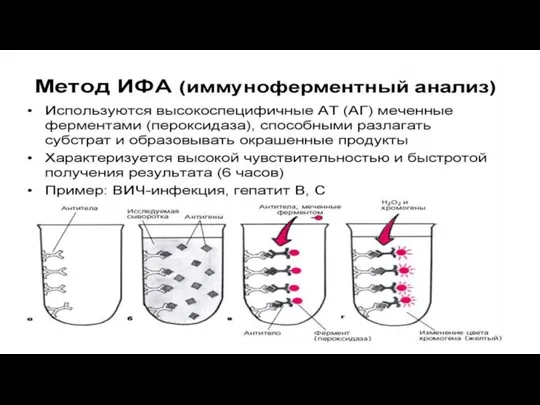
Слайд 38иммуноферментный анализ (ИФА) — это метод лабораторной диагностики, основанный на реакции «антиген-антитело», который позволяет

выявить вещества белковой природы (в том числе ферменты, вирусы, фрагменты бактерий и другие компоненты биологических жидкостей).
Слайд 41Радиоиммунный анализ (РИА), также радиоиммунологический или изотопный иммунологический анализ, (англ. Radioimmunoassay, RIA) —

метод количественного определения биологически активных веществ в биологических жидкостях...
Слайд 43В диагностике вирусных инфекций, при культивировании, выделении и идентификации вирусов, а также

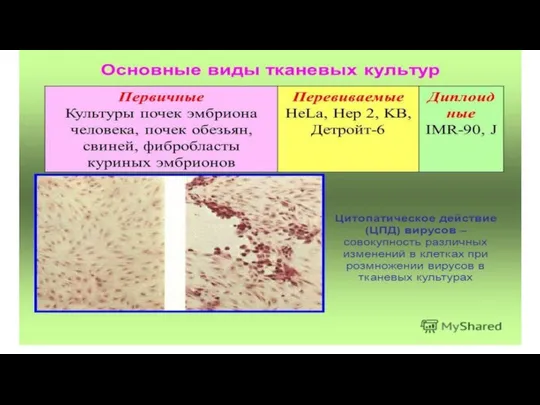
при получении вакцинных препаратов широко применяют метод культуры ткани и клеток.
Используют первичные, вторичные, стабильные перевиваемые и диплоидные клеточные культуры. Первичные культуры получают при диспергировании ткани протеолитическими ферментами (трипсином, коллагеназой).
Слайд 45 Источником клеток могут быть ткани и органы (чаще почки) эмбрионов человека

и животных. Суспензию клеток в питательной среде помещают в так называемые матрацы, бутыли или чашки Петри, где после прикрепления к поверхности сосуда клетки начинают размножаться. Для заражения вирусами используют обычно клеточный монослой. Питательную жидкость сливают, вносят вирусную суспензию в определенных разведениях и после контакта с клетками добавляют свежую питательную среду, обычно без сыворотки.
Слайд 46 Клетки большинства первичных культур могут быть пересеяны, такая культура называется вторичной.

При дальнейшем пассировании клеток формируется популяция фибробластоподобных клеток, способных к быстрому размножению, большая часть которых сохраняет исходный набор хромосом.
Это так называемые диплоидные клетки.
Пассаж - это заражение живой системы, с целью получения новой популяции вируса.
Слайд 47Через три пассажа в клетках происходит накопление вируса, что сопровождается появлением признаков

репродукции, видимых на уровне макроорганизма.
При серийном культивировании клеток получают стабильные перевиваемые клеточные культуры.
При пассажах появляются быстро делящиеся однородные клетки с гетероплоидным набором хромосом.
Слайд 48Стабильные линии клеток могут быть однослойными и
суспензионными.
Однослойные культуры растут в

виде сплошного слоя на поверхности стекла, суспензионные — в виде суспензий в различных сосудах с использованием перемешивающих устройств. Существует более 400 линий клеток, полученных от 40 различных видов животных (в т.ч. от приматов, птиц, рептилий, амфибий, рыб, насекомых) и человека.
Слайд 49В искусственных питательных средах можно культивировать кусочки отдельных органов и тканей (органные

культуры).
Эти типы культур сохраняют структуру ткани, что особенно важно для выделения и пассирования вирусов, которые не репродуцируются в недифференцированных тканевых культурах (например, коронавирусы).
Слайд 50 В зараженных клеточных культурах вирусы можно обнаружить по изменению морфологии клеток,

цитопатическому действию, которое может иметь специфический характер, появлению включений, путем определения вирусных антигенов в клетке и в культуральной жидкости; установления биологических свойств вирусного потомства в культуральной жидкости и титрования вирусов в культуре ткани, куриных эмбрионах или на чувствительных животных; путем выявления отдельных вирусных нуклеиновых кислот в клетках методом молекулярной гибридизации или скоплений нуклеиновых кислот цитохимическим методом с помощью люминесцентной микроскопии.
Слайд 51 Выделение вирусов является трудоемким и длительным процессом. Его осуществляют с целью

определения циркулирующего среди населения типа или варианта вируса (например, для идентификации сероварианта вируса гриппа, дикого или вакцинного штамма вируса полиомиелита и т.д.);
в случаях, когда это необходимо для проведения срочных эпидемиологических мероприятий;
при появлении новых типов или вариантов вирусов; при необходимости подтверждения предварительного диагноза;
для индикации вирусов в объектах окружающей среды.
Слайд 52При выделении вирусов учитывают возможность их персистирования в организме человека, а также

возникновения смешанной инфекции, вызванной двумя и более вирусами.
Генетически однородная популяция вируса, полученная от одного вириона, называется вирусным клоном, а сам процесс получения его — клонированием.
Слайд 53Выбор метода лабораторной диагностики в каждом отдельном случае зависит от характера заболевания,

периода болезни и возможностей лаборатории. Современная диагностика вирусных инфекций основана на экспресс-методах, позволяющих получать ответ через несколько часов после взятия клинического материала в ранние сроки после заболевания.
К ним относятся электронная и иммунная электронная микроскопия,
а также иммунофлюоресценция, метод молекулярной гибридизации, выявление антител класса lgM и др.
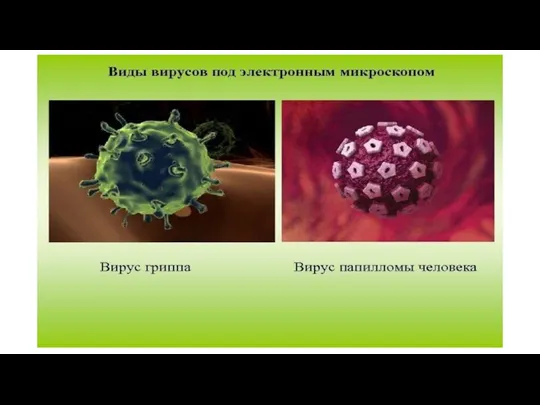
Слайд 54 Электронная микроскопия вирусов, окрашенных методом негативного контрастирования, позволяет дифференцировать вирусы и

определять их концентрацию. Применение электронной микроскопии в диагностике вирусных инфекций ограничивается теми случаями, когда концентрация вирусных частиц в клиническом материале достаточно высокая (105 в 1 мл и выше).
Слайд 56Недостатком метода является невозможность отличать вирусы, принадлежащие к одной таксономической группе.
Этот

недостаток устраняется путем использования иммунной электронной микроскопии.
Метод основан на образовании иммунных комплексов при добавлении специфической сыворотки к вирусным частицам, при этом происходит одновременная концентрация вирусных частиц, позволяющая идентифицировать их.
Слайд 59Метод применяют также для выявления антител.
В целях экспресс-диагностики проводят электронно-микроскопическое исследование

экстрактов тканей, фекалий, жидкости из везикул, секретов из носоглотки.
Электронную микроскопию широко используют для изучения морфогенеза вируса, ее возможности расширяются при применении меченых антител.
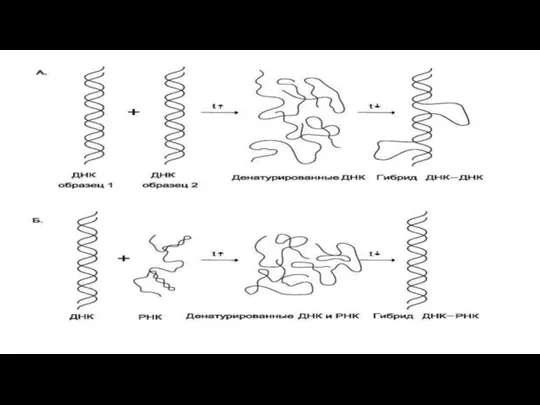
Слайд 60 Метод молекулярной гибридизации, основанный на выявлении вирусоспецифических нуклеиновых кислот, позволяет обнаружить

единичные копии генов и по степени чувствительности не имеет себе равных.
Реакция основана на гибридизации комплементарных нитей ДНК или РНК (зондов) и формировании двунитчатых структур.
Наиболее дешевым зондом является клонированная рекомбинантная ДНК. Зонд метят радиоактивными предшественниками (обычно радиоактивным фосфором).
Слайд 63Перспективно использование колориметрических реакций. Существует несколько вариантов молекулярной гибридизации: точечная, блот-гибридизация, сэндвич-гибридизация,

гибридизация in situ и др.
Антитела класса lgM появляются раньше, чем антитела класса G (на 3—5-й день болезни) и исчезают через несколько недель, поэтому их обнаружение свидетельствует о только что перенесенной инфекции.
Антитела класса lgM выявляют методом иммунофлюоресценции или с помощью иммуноферментного анализа, используя антисыворотки (сыворотки против тяжелых цепей lgM).
Слайд 66 Серологические методы в вирусологии основаны на классических иммунологических реакциях (см. Иммунологические методы

исследования)
. Эти методы используют для идентификации вирусов с помощью набора известных сывороток и для серодиагностики с целью определения нарастания антител во второй сыворотке по сравнению с первой (первую сыворотку берут в первые дни после заболевания, вторую — через 2—3 нед.). Диагностическое значение имеет не менее чем четырехкратное нарастание антител во второй сыворотке.
Если выявление антител класса lgM свидетельствует о недавно перенесенной инфекции,
то антитела класса lgG сохраняются в течение нескольких лет, а иногда и пожизненно.
Слайд 67Свойства бактериофагов
В конце ХХ века стало ясно, что бактерии безусловно доминируют в

биосфере Земли, составляя более 90% ее биомассы. У каждого вида имеется множество специализированных типов вирусов. По предварительным оценкам, число видов бактериофагов составляет около 1015.
Чтобы понять масштаб этой цифры, можно сказать, что если каждый человек на Земле будет каждый день открывать по одному новому бактериофагу, то на описание всех их понадобится 30 лет.
Таким образом, бактериофаги – самые малоизученные существа в нашей биосфере. Большинство известных сегодня бактериофагов принадлежит к отряду Caudovirales – хвостатые вирусы.
Слайд 68Помимо постоянного эволюционного соревнования механизмов защиты у бактерий и нападения у вирусов,

причиной сложившегося равновесия можно считать и то, что бактериофаги специализировались по своему инфекционному действию. Если имеется крупная колония бактерий, где своих жертв найдут и следующие поколения фагов, то уничтожение бактерий литическими (убивающими, дословно – растворяющими) фагами идет быстро и непрерывно.
Слайд 69Если потенциальных жертв маловато или внешние условия не слишком подходят для эффективного

размножения фагов, то преимущество получают фаги с лизогенным циклом развития.
В этом случае после внедрения внутрь бактерии ДНК фага не сразу запускает механизм инфекции, а до поры до времени существует внутри клетки в пассивном состоянии, зачастую внедряясь в бактериальный геном.
Слайд 70В таком состоянии профага вирус может существовать долго, проходя вместе с хромосомой

бактерии циклы деления клетки.
И лишь когда бактерия попадает в благоприятную для размножения среду, активируется литический цикл инфекции.
При этом, когда ДНК фага освобождается из бактериальной хромосомы, часто захватываются и соседние участки бактериального генома, а их содержимое в дальнейшем может перенестись в следующую бактерию, которую заразит бактериофаг.
Этот процесс (трансдукция генов) считается важнейшим средством переноса информации между прокариотами – организмами без клеточных ядер.




















































 Биологическая роль АТФ
Биологическая роль АТФ Системы кровоснабжения, крово- и лимфооттока
Системы кровоснабжения, крово- и лимфооттока Строение мышц
Строение мышц Грудная клетка
Грудная клетка Домашние животные
Домашние животные Мембрана и органоиды клетки (1)
Мембрана и органоиды клетки (1) Казуально-аналитический метод, его сильные и слабые стороны
Казуально-аналитический метод, его сильные и слабые стороны 4_Биология_7 класс_Органические вещества в продуктах питания_Презентация
4_Биология_7 класс_Органические вещества в продуктах питания_Презентация Засохшие растения
Засохшие растения Угадай животное
Угадай животное СТРОЕНИЕ. ФУНКЦИОНИРОВАНИЕ И СВОЙСТВА ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ. ШИРЯКОВА ЭВЕЛИНА. КЛЫПЕНКОВА НАДЕЖДА. ЛЕОНТЬЕВА ДИАНА
СТРОЕНИЕ. ФУНКЦИОНИРОВАНИЕ И СВОЙСТВА ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ. ШИРЯКОВА ЭВЕЛИНА. КЛЫПЕНКОВА НАДЕЖДА. ЛЕОНТЬЕВА ДИАНА Легкие
Легкие 1_Selektsia_rasteniy
1_Selektsia_rasteniy Клеточный цикл. Митоз. Мейоз
Клеточный цикл. Митоз. Мейоз Образование почв и их разнообразие
Образование почв и их разнообразие Насекомые леса
Насекомые леса Защита сада от болезней и вредителей
Защита сада от болезней и вредителей История открытия витаминов
История открытия витаминов Губки
Губки Ракообразные. Раки и Крабы
Ракообразные. Раки и Крабы Пищеварение в ротовой полости
Пищеварение в ротовой полости Отделы и области тела животных
Отделы и области тела животных Сад как лес
Сад как лес Организм человека
Организм человека Лук репчатый. Выращивание лука в почве с использованием удобрений
Лук репчатый. Выращивание лука в почве с использованием удобрений Дріжджі - одноклітинні гриби
Дріжджі - одноклітинні гриби Соединения костей таза. Таз в целом. Соединение костей свободной нижней конечности
Соединения костей таза. Таз в целом. Соединение костей свободной нижней конечности Снег и лед в жизни растений, животных, людей
Снег и лед в жизни растений, животных, людей