Содержание
- 2. Историю изучения мутационного процесса можно разделить на 5 периодов. В течение первого периода (1900--1927) были развиты
- 3. Мутагенез Нобелевская премия - 1946
- 4. Третий период начался незадолго до второй мировой войны, когда открытие химического мутагенеза поставило новые проблемы, а
- 5. Это направление оказалось весьма плодотворным и до сих пор служит источником информации о действии мутагенов на
- 6. Первый период: с 1900 по 1927 г. Голландский ботаник Гуго Де Фриз, один из тех, кто
- 7. Он понял, что при рода мутаций нерасторжимо связана с природой гена. В своем выступлении, относящемся к
- 8. Фундаментальные проблемы, которые возникли в первый период: 1. Какое свойство генетического материала позволяет ему точно реплицироваться
- 9. Третий период: (с начала второй мировой войны до 1953 г.) Этот период в изучении мутагенеза был
- 10. К концу этого периода накопилось большое количество следующих проблем: 1. Загадка точной репликации генов лишь осложнилась
- 11. Четвертый период: (с 1953 до начала 1965 г.) Этот период менее четко определен во времени, чем
- 12. Пятый период: (с 1965 г. по сегодняшний день) Сегодняшние исследования целиком базируются на достижениях предыдущих периодов.
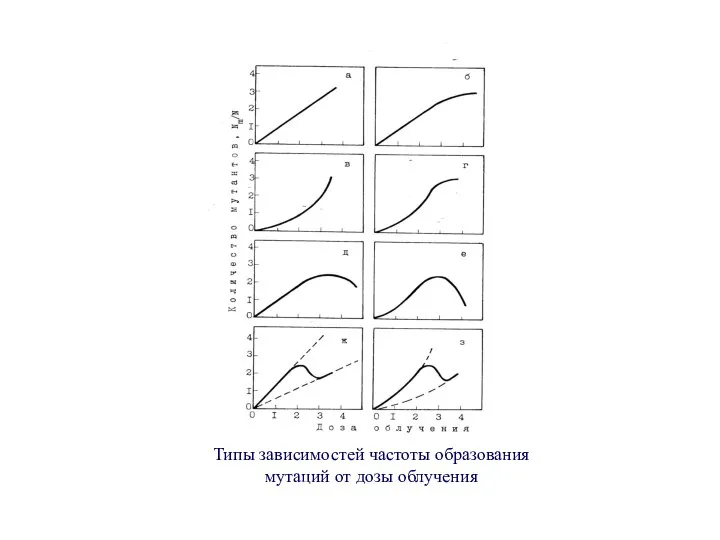
- 13. Типы зависимостей частоты образования мутаций от дозы облучения
- 14. Возрастание вероятности инактивации клеток, имеющих мутационное повреждение. Harm, Stein, 1956 Алиханян и соавт, 1960 Кривиский, 1960
- 15. ОСНОВНЫЕ ТИПЫ МУТАГЕННЫХ ПОВРЕЖДЕНИЙ ДНК Мутагенные факторы можно разделить на три группы. В первую входят агенты,
- 16. При действии ионизирующих излучений премутационными событиями служат в основном щелочестабильные повреждения ДНК. К ним следует прежде
- 17. Так как ОР в данном случае не могут перейти из донорской ДНК в хромосому клетки, то
- 18. МУТАГЕННОЕ ДЕЙСТВИЕ γ-ИЗЛУЧЕНИЯ НА КЛЕТКИ БАКТЕРИЙ Дозовая зависимость выхода мутаций к фагоустойчивости у бактерий, выявленная в
- 19. Квадратичная дозовая зависимость по образованию триптофановых реверсийу Е.соli - WР-2 была обнаружена в 1978 . В
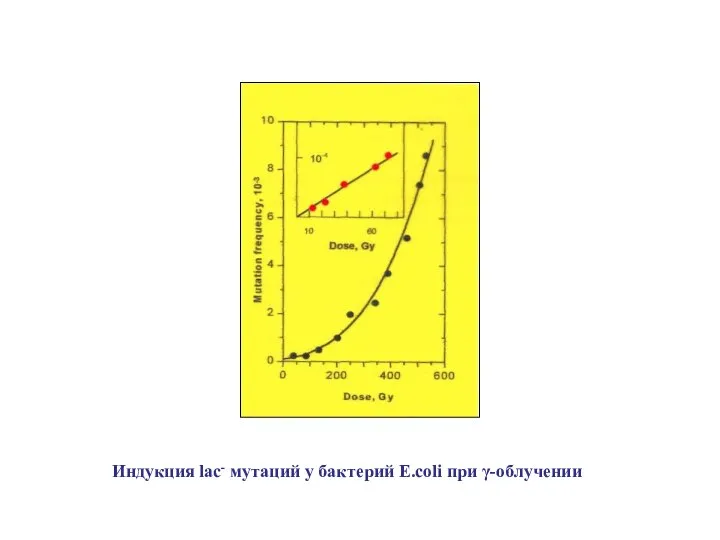
- 20. Индукция lac- мутаций у бактерий E.coli при γ-облучении
- 21. ОСНОВНЫЕ ГИПОТЕЗЫ МЕХАНИЗМА МУТАГЕННОГО ДЕЙСТВИЯ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ 1. Классическая модель Линейный тип зависимости Nm/N(D) часто наблюдается
- 22. 2. Репарационная модель. Для объяснения квадратичных зависимостей было предположено, что в формировании начального премутационного события участвуют
- 23. Nm/N(D) = (βD [1 - exp (- aD)], uде β= kMl/M - коэффициент пропорциональности. Из этого
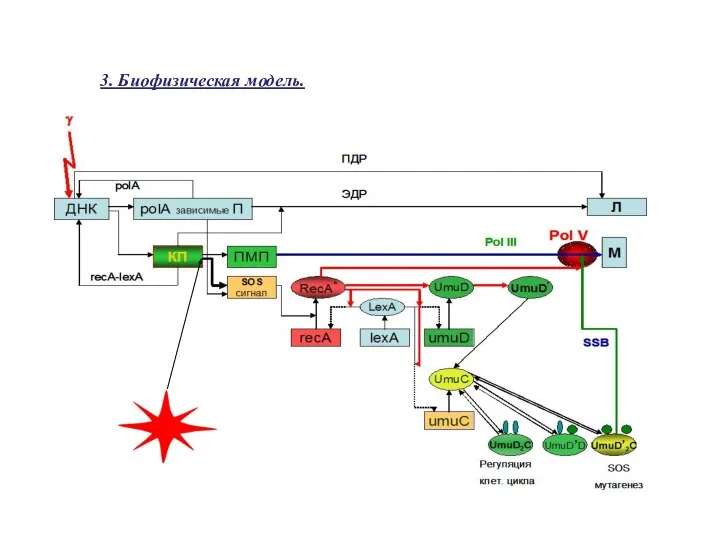
- 24. 3. Биофизическая модель.
- 25. При действии ионизирующего излучения в ДНК клеток с некоторой частотой образуются прямые двунитевые разрывы (ПДР) ДНК,
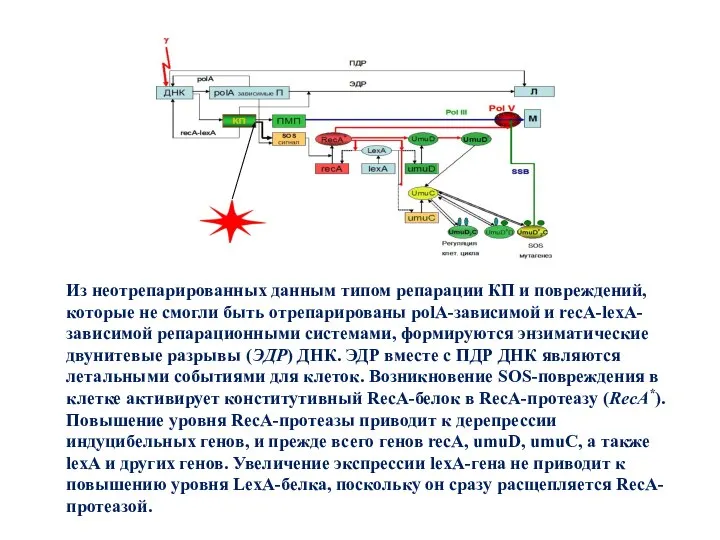
- 26. Из неотрепарированных данным типом репарации КП и повреждений, которые не смогли быть отрепарированы polA-зависимой и recA-lexA-зависимой
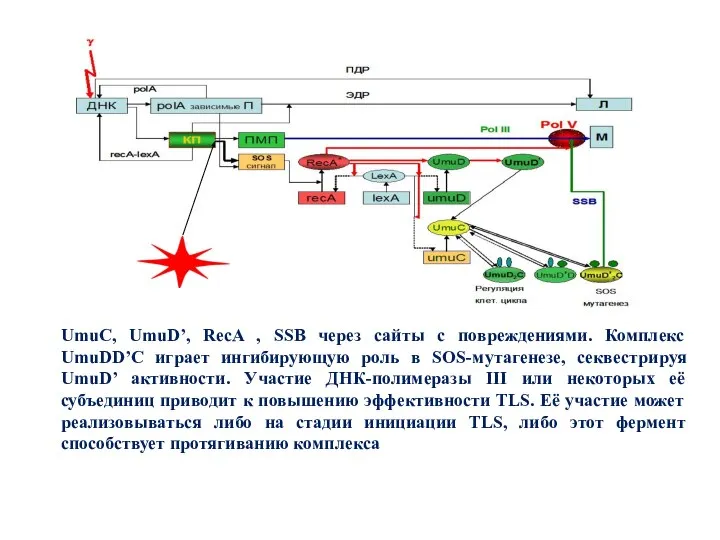
- 27. Комплекс UmuDD’C играет ингибирующую роль в SOS-мутагенезе, секвестрируя UmuD’ активности. Участие ДНК-полимеразы III или некоторых её
- 28. Из неотрепарированных данным типом репарации КП и повреждений, которые не смогли быть отрепарированы polA-зависимой и recA-lexA-зависимой
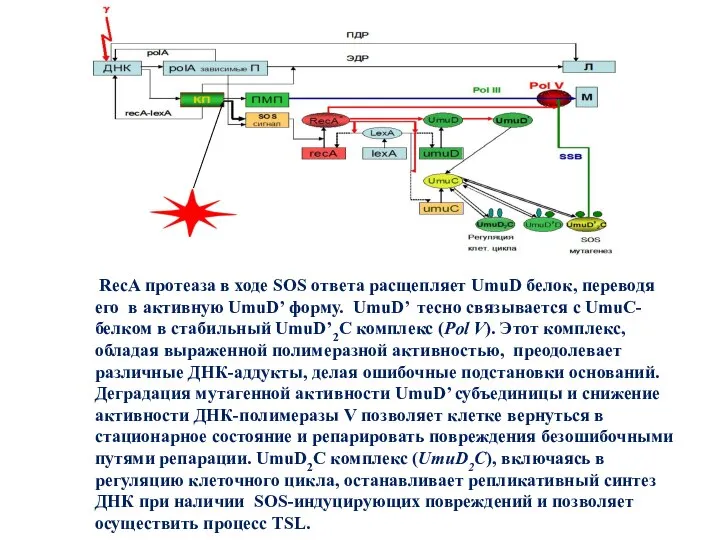
- 29. RecA протеаза в ходе SOS ответа расщепляет UmuD белок, переводя его в активную UmuD’ форму. UmuD’
- 30. UmuC, UmuD’, RecA , SSB через сайты с повреждениями. Комплекс UmuDD’C играет ингибирующую роль в SOS-мутагенезе,
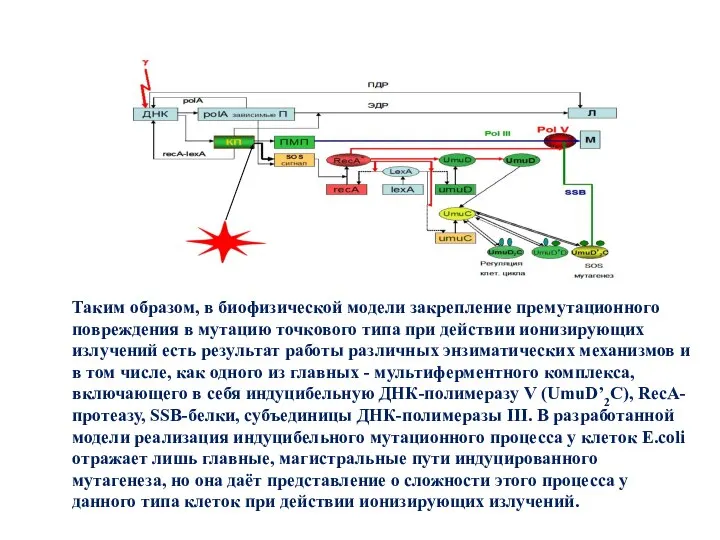
- 31. Таким образом, в биофизической модели закрепление премутационного повреждения в мутацию точкового типа при действии ионизирующих излучений
- 32. SOS –тест системы
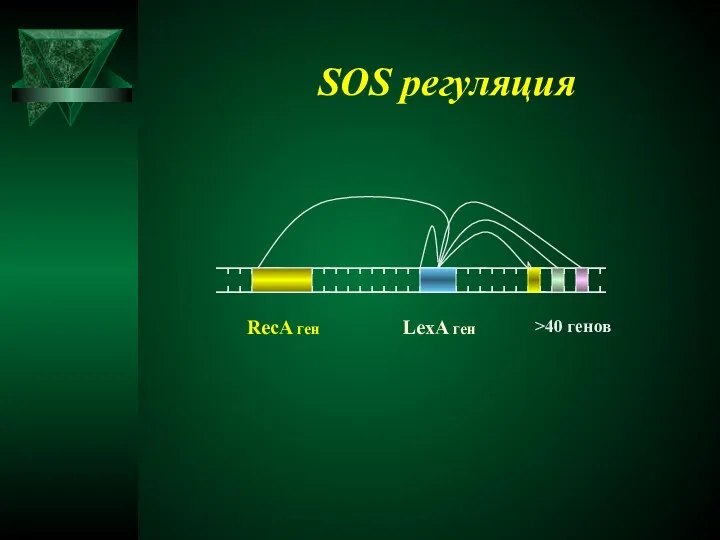
- 33. RecA ген LexA ген >40 генов SOS регуляция
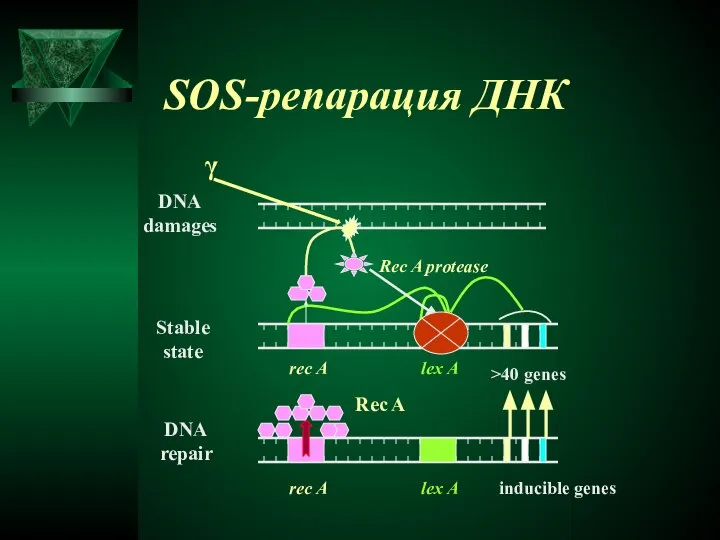
- 34. SOS-репарация ДНК γ Rec A protease rec A lex A >40 genes rec A lex A
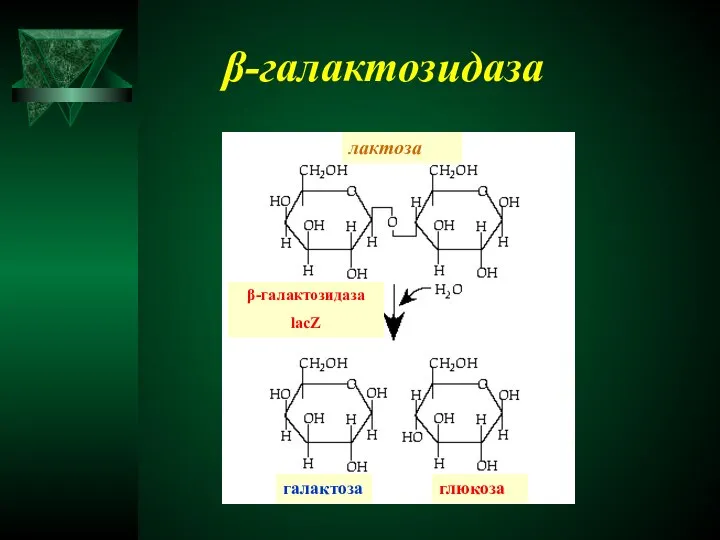
- 35. β-галактозидаза лактоза β-галактозидаза lacZ галактоза глюкоза
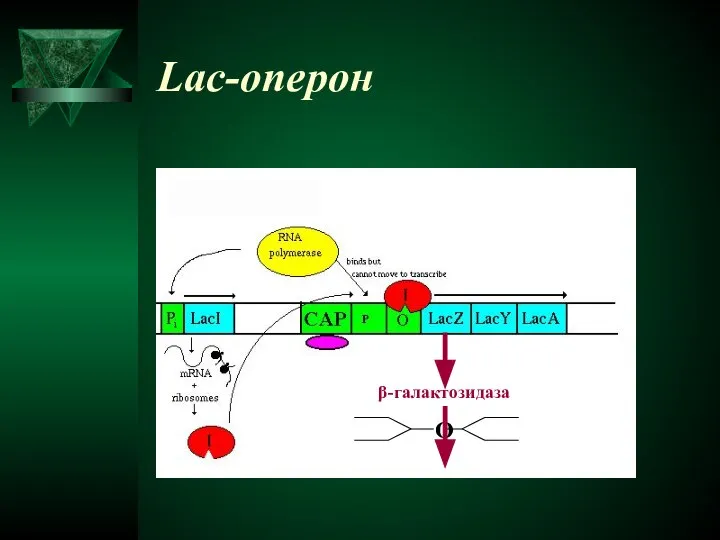
- 36. Lac-оперон β-галактозидаза О
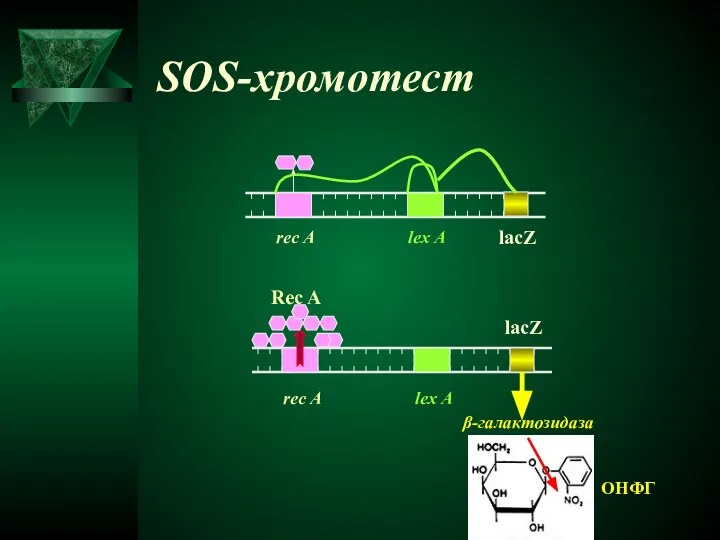
- 37. SOS-хромотест rec A lex A rec A lex A Rec A lacZ β-галактозидаза ОНФГ lacZ
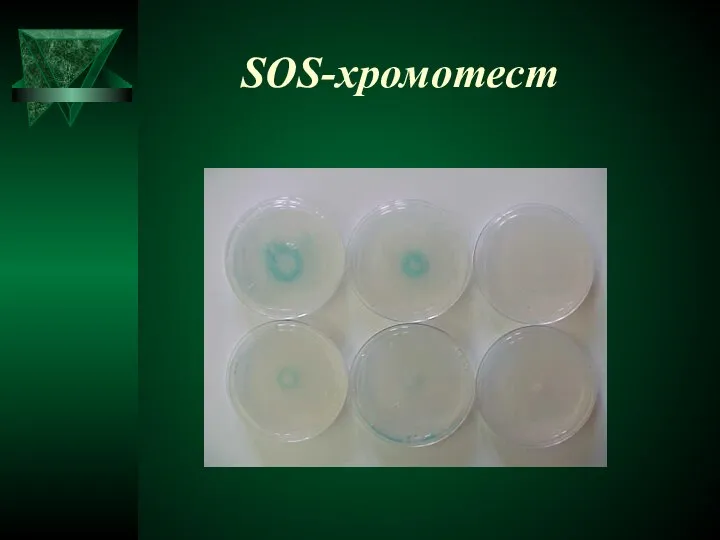
- 38. SOS-хромотест
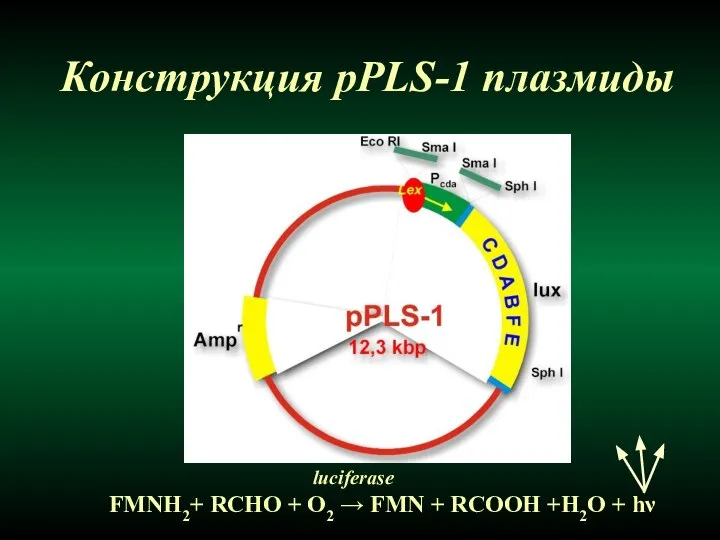
- 39. Конструкция pPLS-1 плазмиды FMNH2+ RCHO + O2 → FMN + RCOOH +H2O + hν luciferase
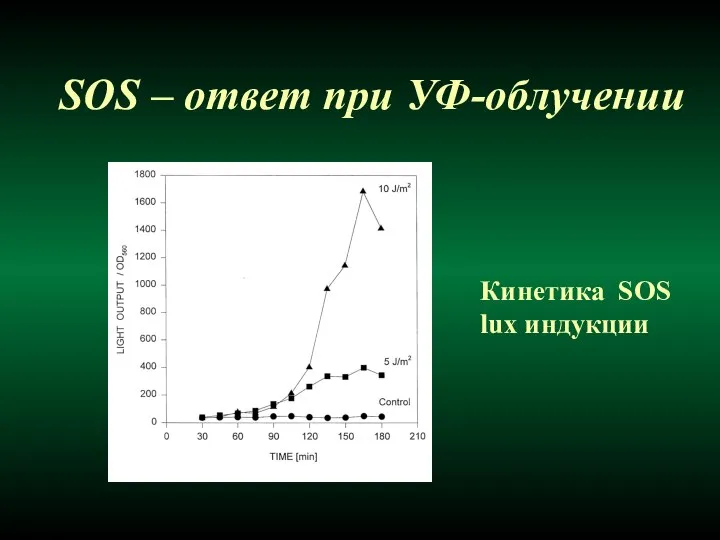
- 40. SOS – ответ при УФ-облучении Кинетика SOS lux индукции
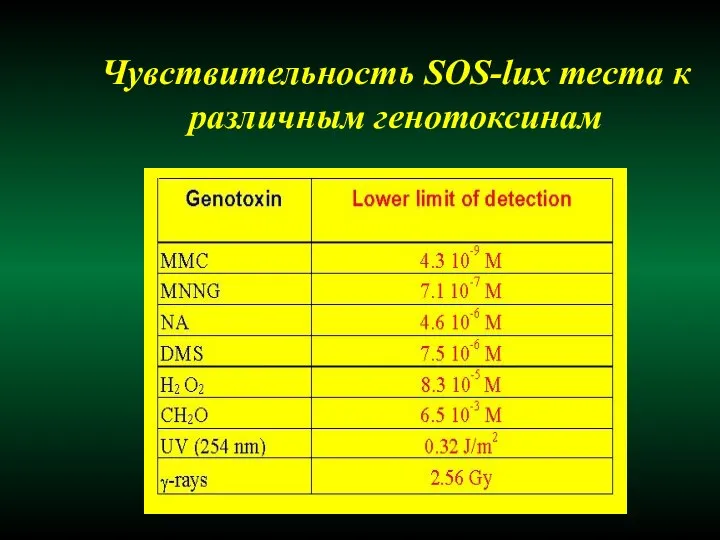
- 41. Чувствительность SOS-lux теста к различным генотоксинам
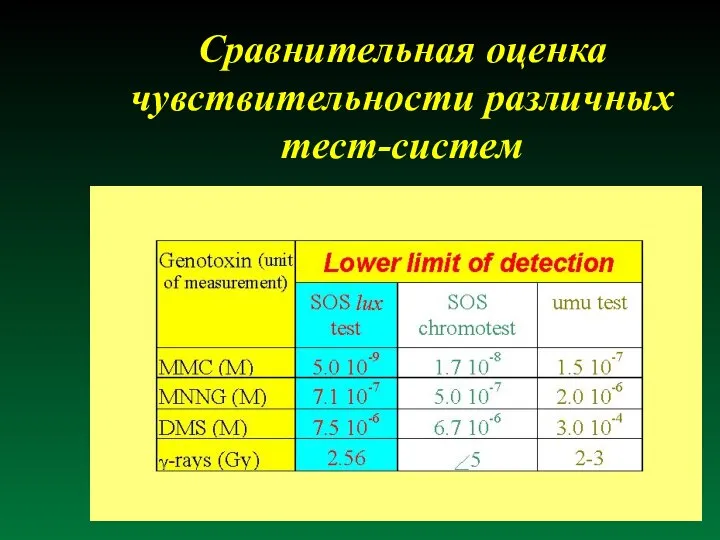
- 42. Сравнительная оценка чувствительности различных тест-систем
- 43. фаг λ λ
- 44. Частица фага Хромосома фага длиной около 50000 пар оснований находится в головке фага, где она намотана
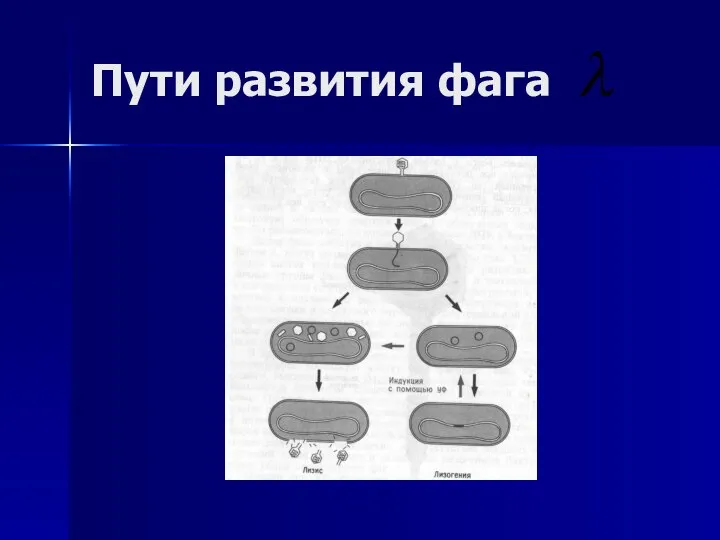
- 45. Пути развития фага
- 46. Репрессор Репрессор-белок из 236 аминокислот. Димер формируется главным образом за счет контактов между карбокси - концевыми
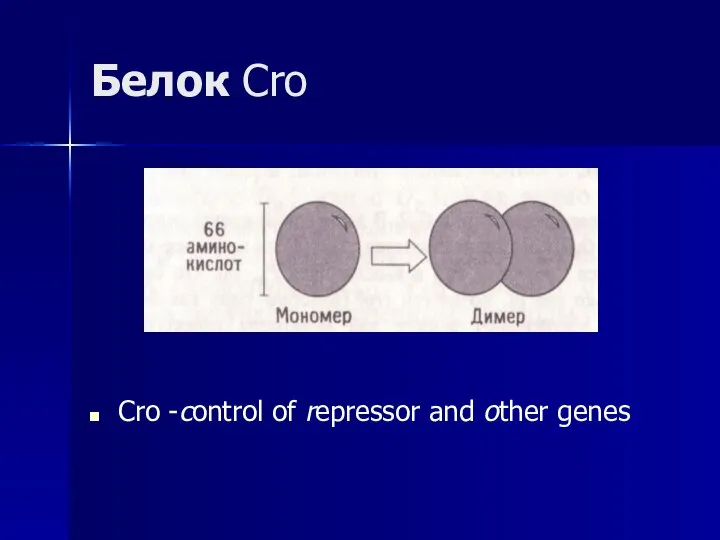
- 47. Белок Cro Cro -control of repressor and other genes
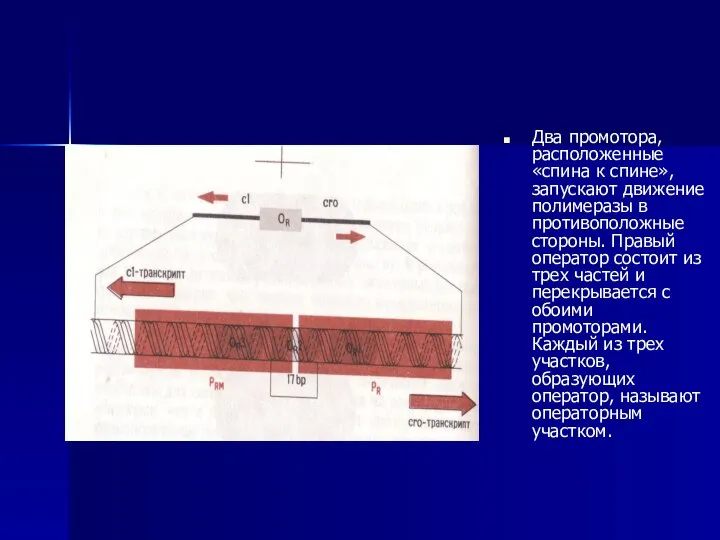
- 48. Два промотора,расположенные «спина к спине»,запускают движение полимеразы в противоположные стороны. Правый оператор состоит из трех частей
- 49. Действие репрессора и Cro
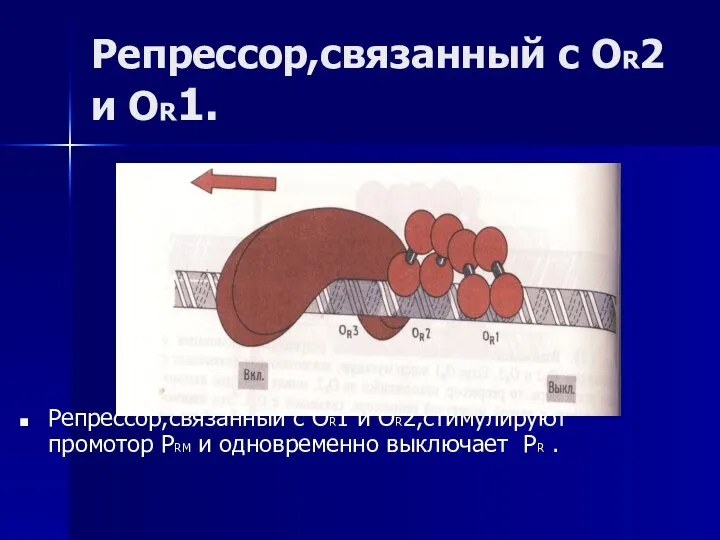
- 50. Репрессор,связанный с OR2 и OR1. Репрессор,связанный с OR1 и OR2,стимулируют промотор PRM и одновременно выключает PR
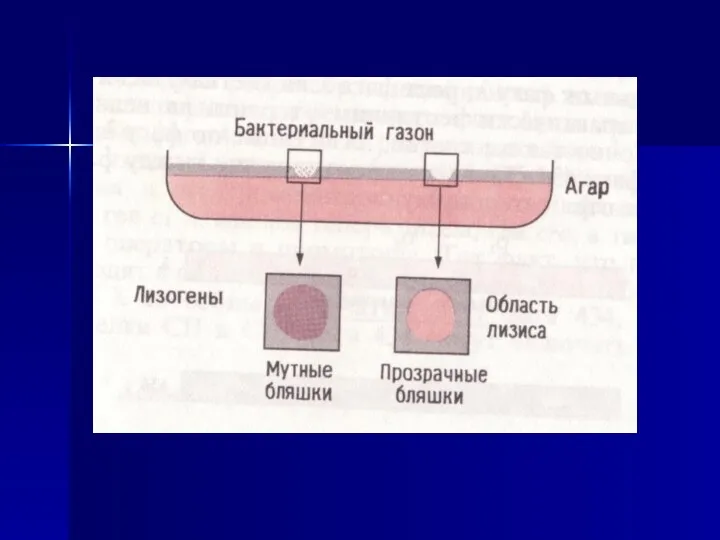
- 51. Как УФ-облучение изменяет поведение лизогенных клеток?
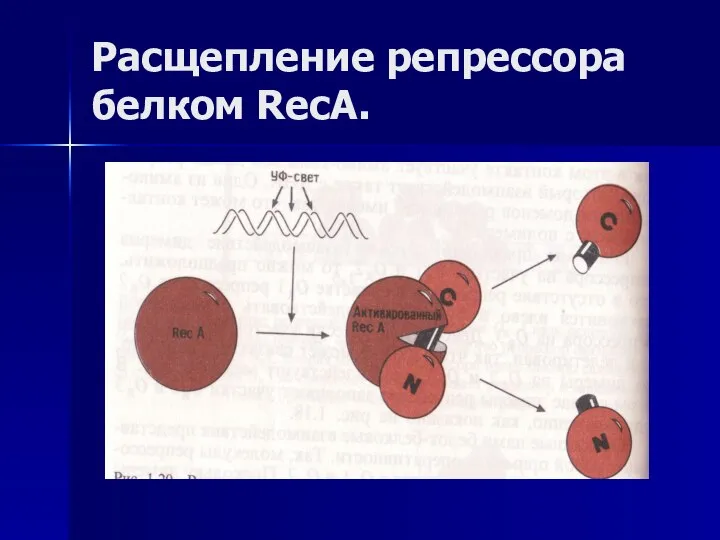
- 52. Расщепление репрессора белком RecA.
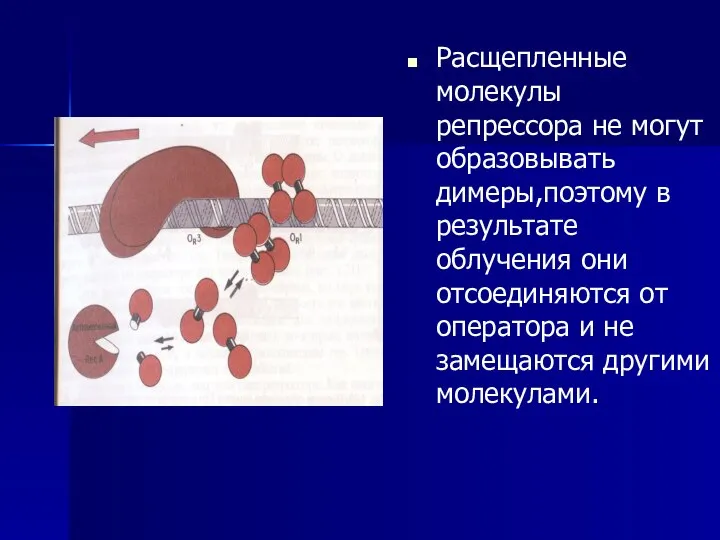
- 53. Расщепленные молекулы репрессора не могут образовывать димеры,поэтому в результате облучения они отсоединяются от оператора и не
- 54. Связывание белка Cro с OR. Димеры Cro независимо связываются с каждым из трех участков оператора.
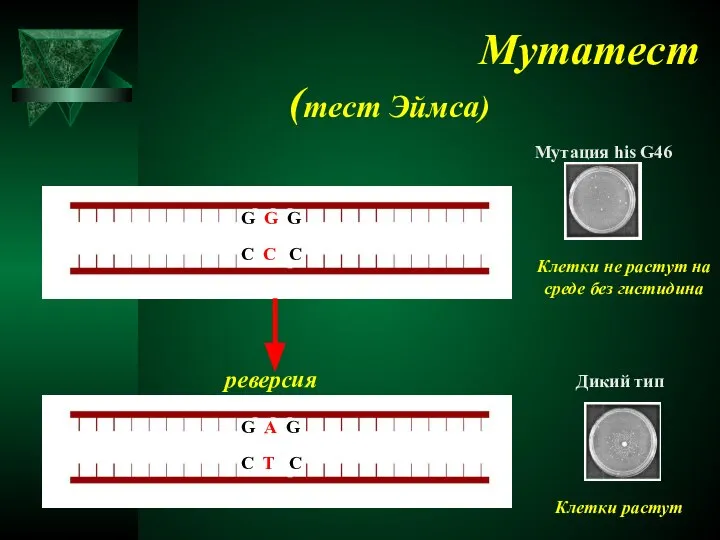
- 56. Мутатест (тест Эймса) Мутация his G46 Клетки не растут на среде без гистидина реверсия
- 58. Скачать презентацию



















![Nm/N(D) = (βD [1 - exp (- aD)], uде β= kMl/M -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/946729/slide-22.jpg)










 Триасово-Юрское вымирание динозавров
Триасово-Юрское вымирание динозавров Белки
Белки Лишайники
Лишайники Плакаты по биологии
Плакаты по биологии Круглые черви и прогресс
Круглые черви и прогресс Презентация на тему Методы изучения клетки
Презентация на тему Методы изучения клетки  Красная книга Самарской области
Красная книга Самарской области Опыление и оплодотворение
Опыление и оплодотворение Тип Хордовые
Тип Хордовые Отряд Голенастые
Отряд Голенастые Динозавры. Мезозойская эра
Динозавры. Мезозойская эра Расселение и распространение живых организмов
Расселение и распространение живых организмов Строение и жизнедеятельность водорослей
Строение и жизнедеятельность водорослей Альбом 1 семестр
Альбом 1 семестр Эволюционное учение Ч. Дарвина
Эволюционное учение Ч. Дарвина Способы размножения ( 6 класс)
Способы размножения ( 6 класс) Презентация на тему Одомашненные насекомые
Презентация на тему Одомашненные насекомые  Анализ групп крови у жителей Московского района города Твери
Анализ групп крови у жителей Московского района города Твери Презентация на тему Тип Губки. Тип Кишечнополостные
Презентация на тему Тип Губки. Тип Кишечнополостные 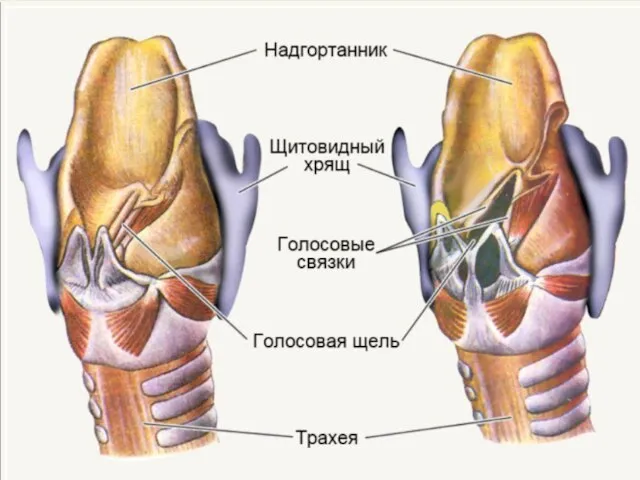 Как формируется голос? Участие носовой и ротовой полости в формировании речи (3)
Как формируется голос? Участие носовой и ротовой полости в формировании речи (3) Растения на поверхности аквариума
Растения на поверхности аквариума Для чего нужен витамин К человеку ?
Для чего нужен витамин К человеку ? Лечебно-диагностический процесс как система
Лечебно-диагностический процесс как система Вегетативная нервная система
Вегетативная нервная система Насекомые леса
Насекомые леса Части тела
Части тела Море и морские обитатели
Море и морские обитатели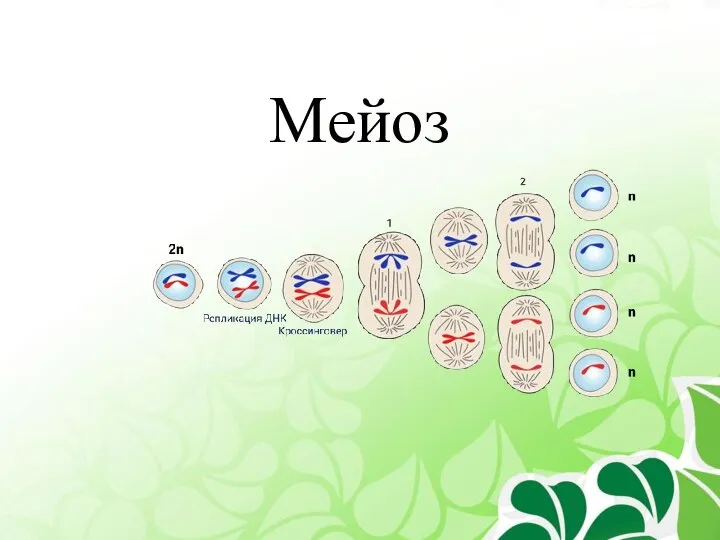 Мейоз
Мейоз