Содержание
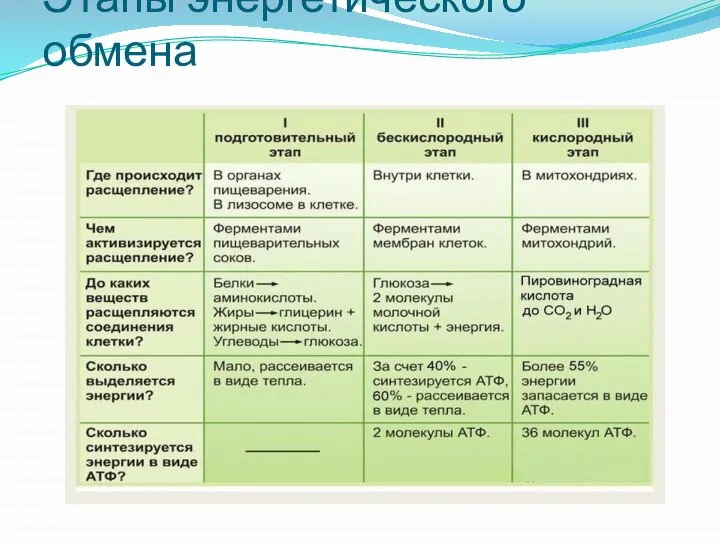
- 2. Этапы энергетического обмена
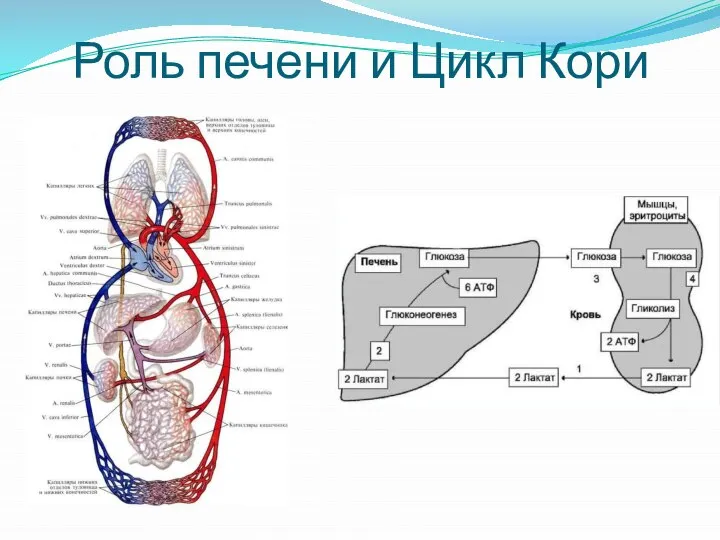
- 3. Роль печени и Цикл Кори
- 4. Классификация ферментов
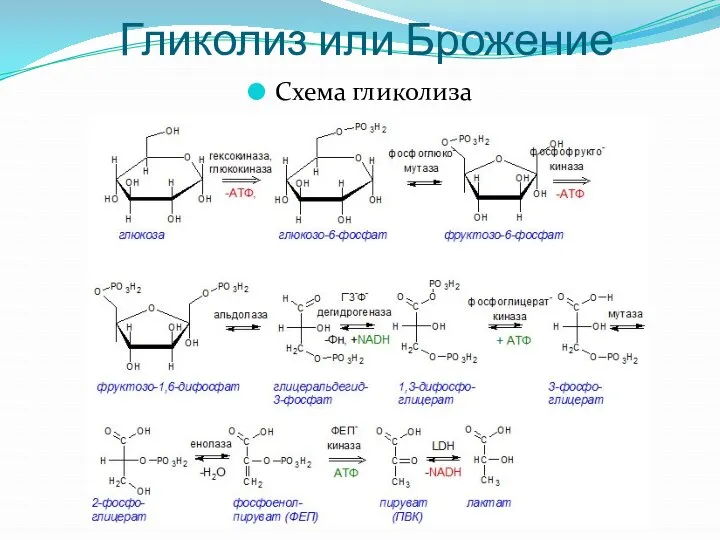
- 5. Гликолиз или Брожение Схема гликолиза
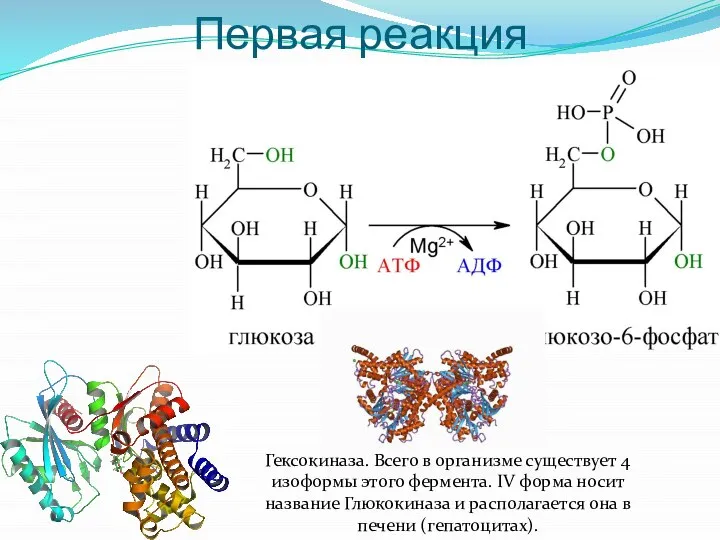
- 6. Первая реакция Гексокиназа. Всего в организме существует 4 изоформы этого фермента. IV форма носит название Глюкокиназа
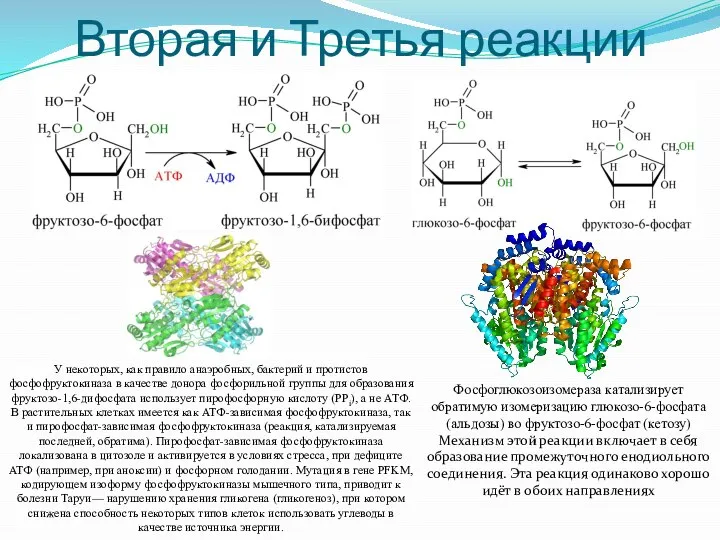
- 7. Вторая и Третья реакции Фосфоглюкозоизомераза катализирует обратимую изомеризацию глюкозо-6-фосфата (альдозы) во фруктозо-6-фосфат (кетозу) Механизм этой реакции
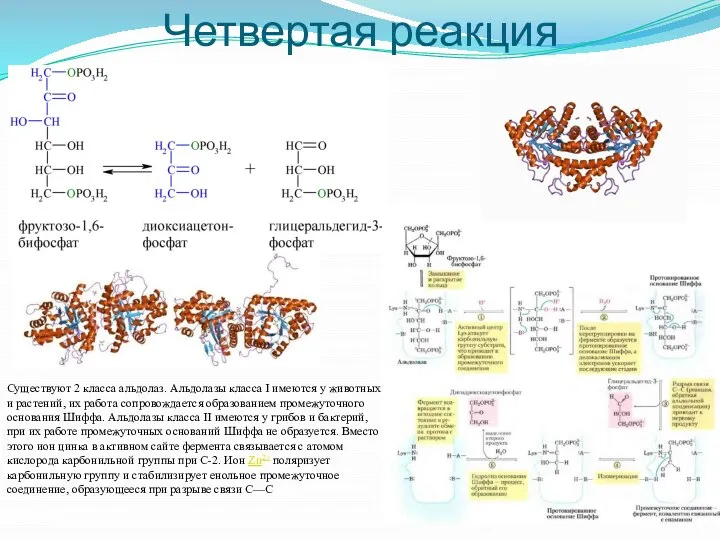
- 8. Четвертая реакция Существуют 2 класса альдолаз. Альдолазы класса I имеются у животных и растений, их работа
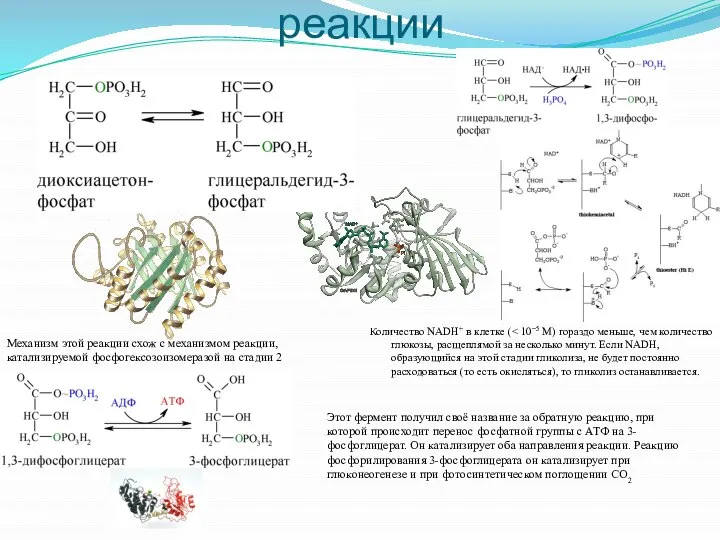
- 9. Пятая, Шестая и Седьмая реакции Количество NADH+ в клетке ( Механизм этой реакции схож с механизмом
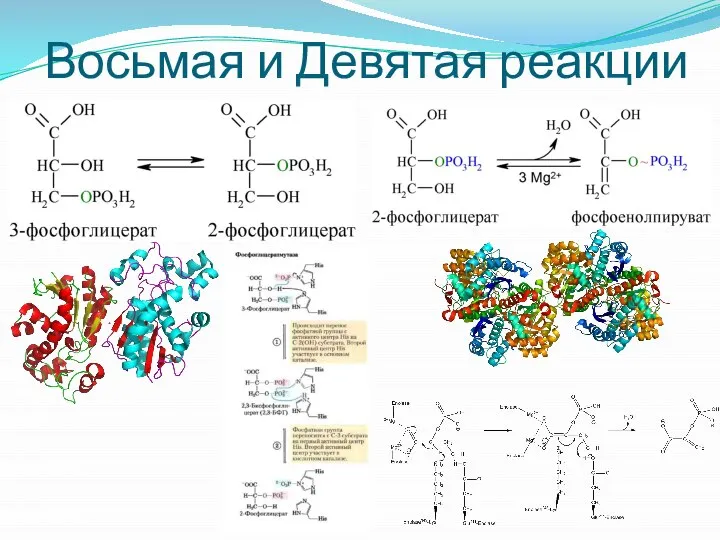
- 10. Восьмая и Девятая реакции
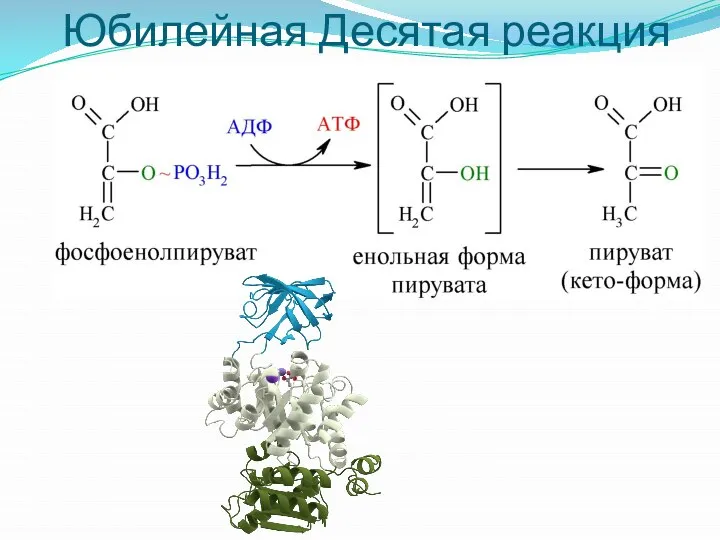
- 11. Юбилейная Десятая реакция
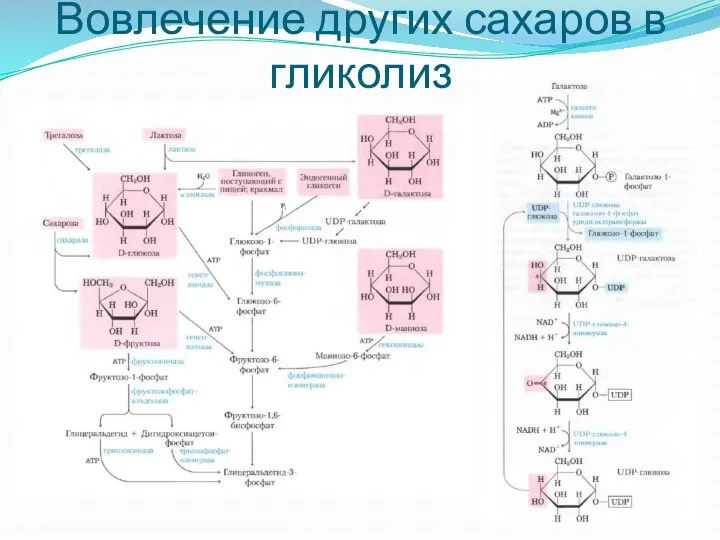
- 12. Вовлечение других сахаров в гликолиз
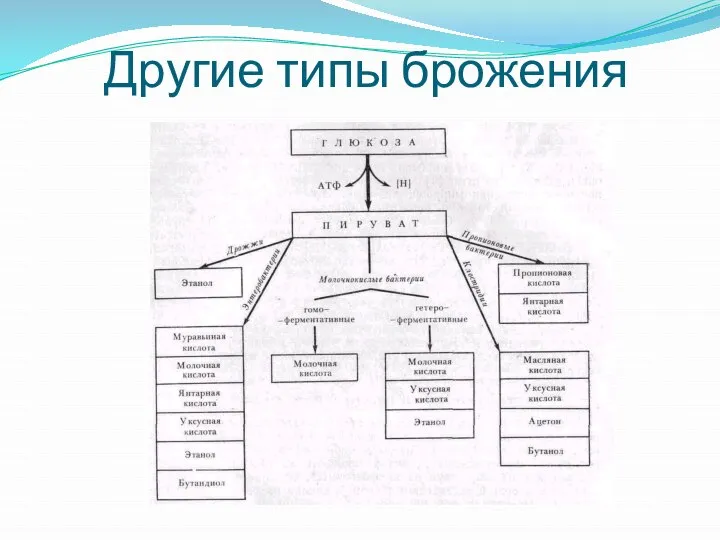
- 13. Другие типы брожения
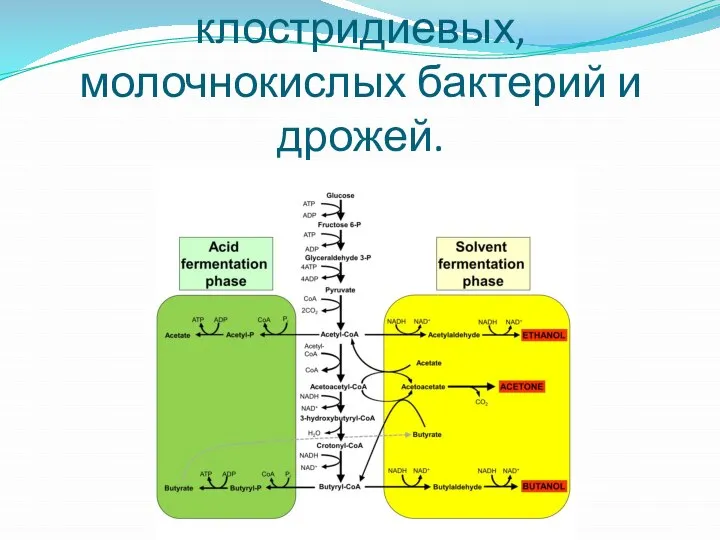
- 14. Брожение по типу клостридиевых, молочнокислых бактерий и дрожей.
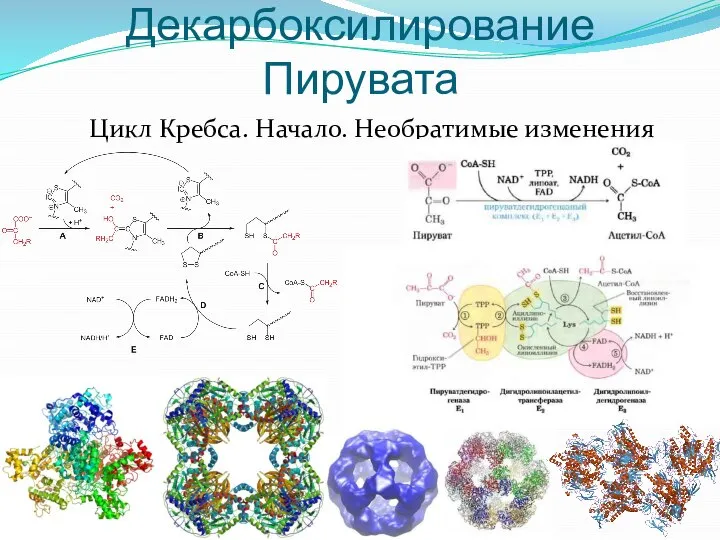
- 15. Окислительное Декарбоксилирование Пирувата Цикл Кребса. Начало. Необратимые изменения
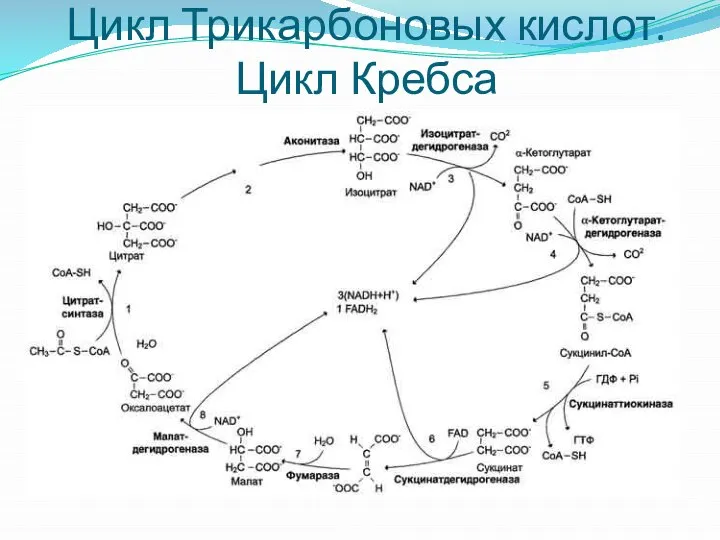
- 17. Цикл Трикарбоновых кислот. Цикл Кребса
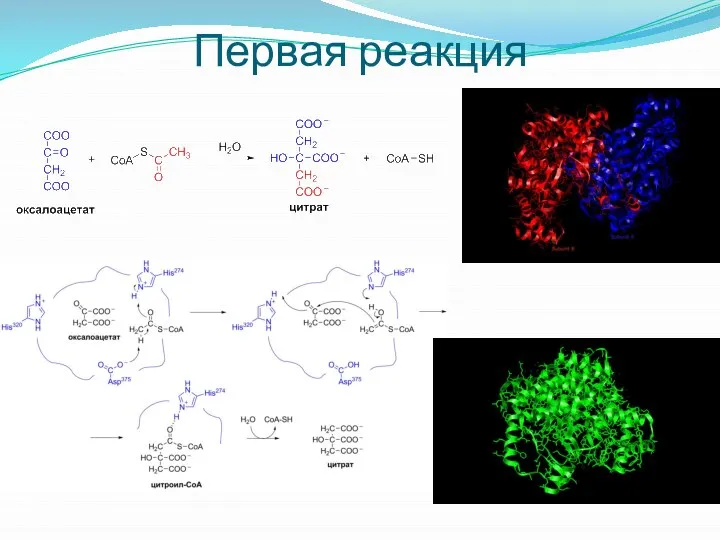
- 18. Первая реакция
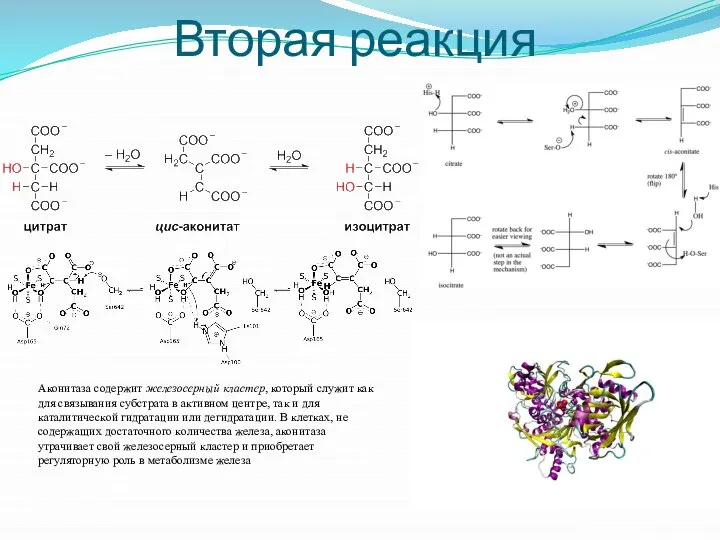
- 19. Вторая реакция Аконитаза содержит железосерный кластер, который служит как для связывания субстрата в активном центре, так
- 20. Третья и Четвертая реакция В клетках обнаружены две различных формы (изозима) изоцитратдегидрогеназы. Для функционирования одной из
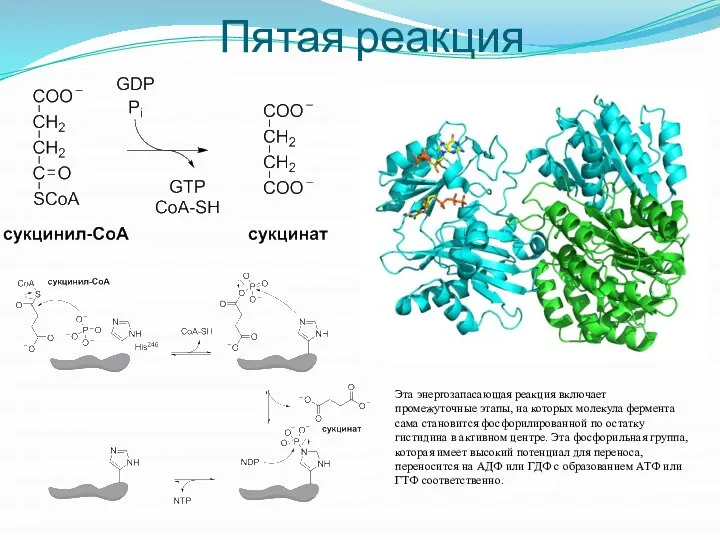
- 21. Пятая реакция Эта энергозапасающая реакция включает промежуточные этапы, на которых молекула фермента сама становится фосфорилированной по
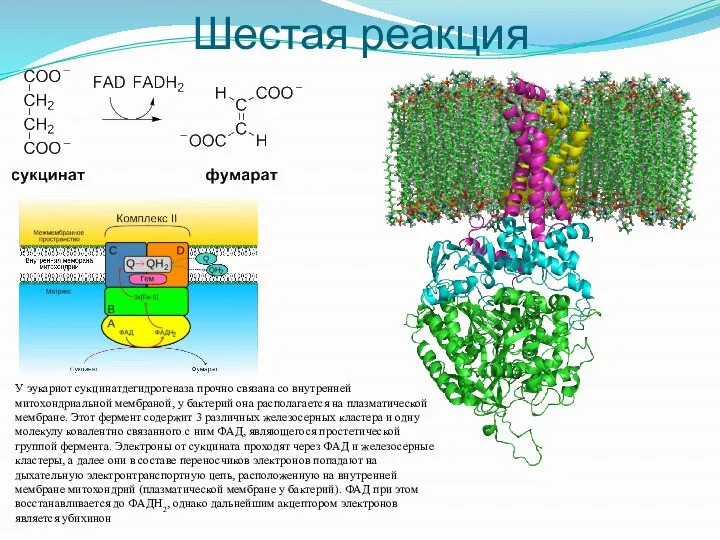
- 22. Шестая реакция У эукариот сукцинатдегидрогеназа прочно связана со внутренней митохондриальной мембраной, у бактерий она располагается на
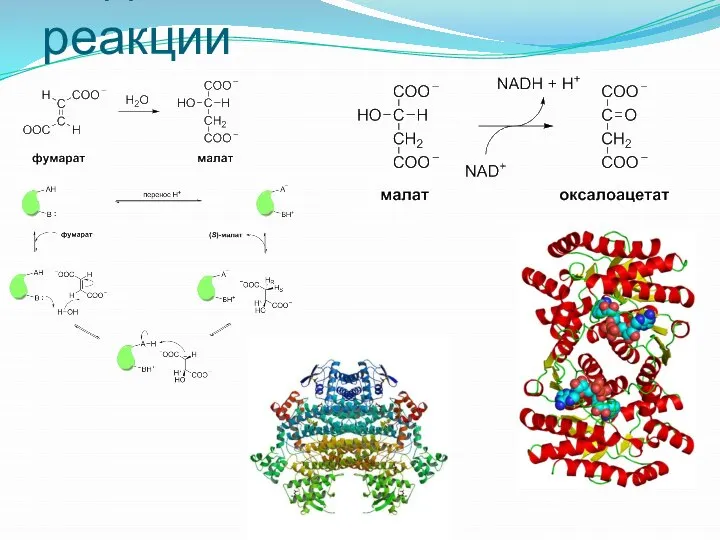
- 23. Седьмая и Восьмая реакции
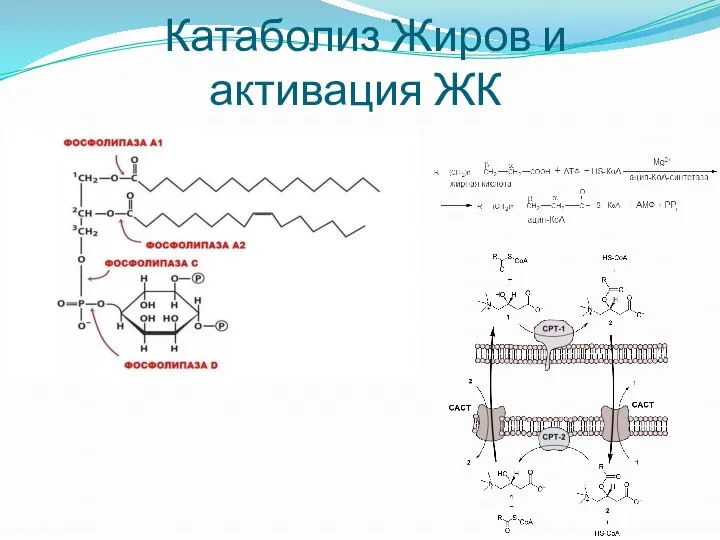
- 24. Катаболиз Жиров и активация ЖК
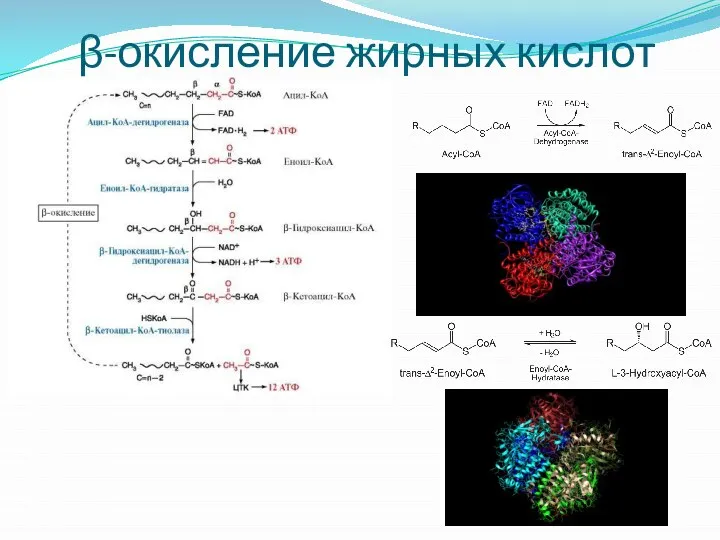
- 25. β-окисление жирных кислот
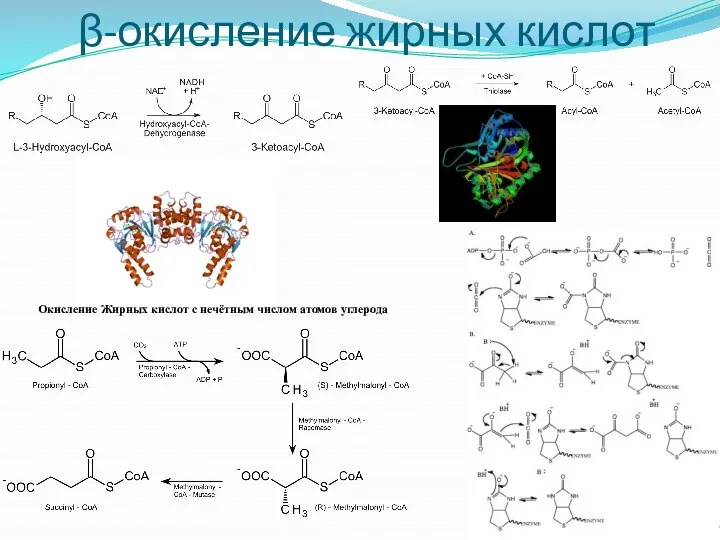
- 26. β-окисление жирных кислот Окисление Жирных кислот с нечётным числом атомов углерода
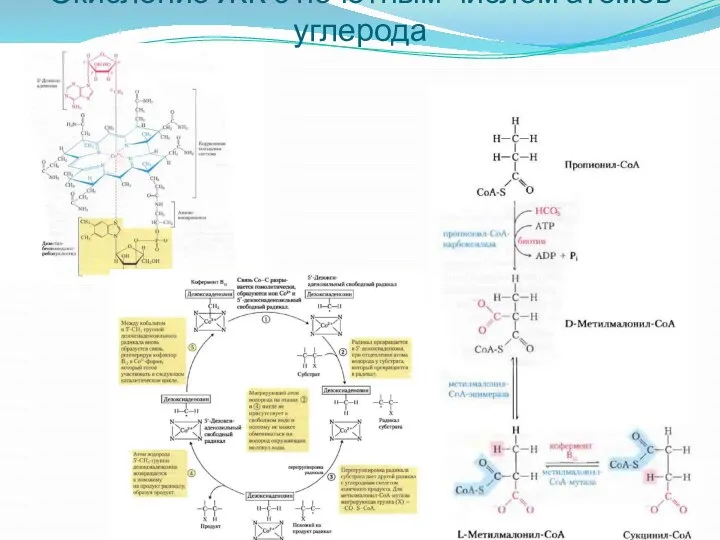
- 27. Окисление ЖК с нечётным числом атомов углерода
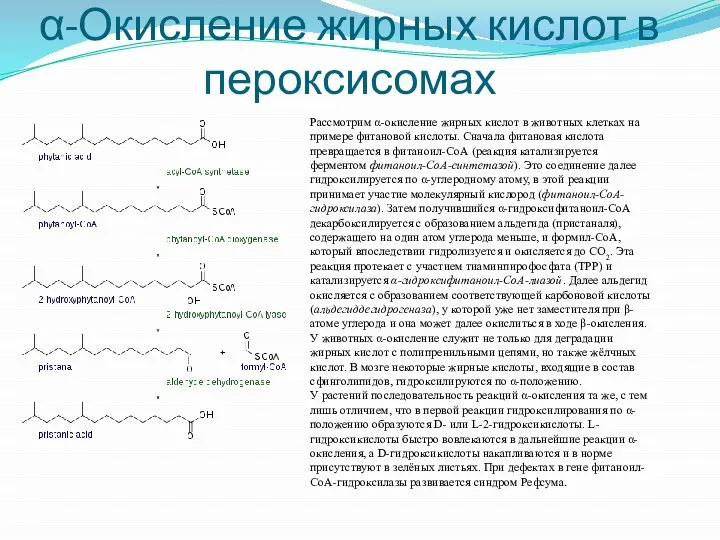
- 28. α-Окисление жирных кислот в пероксисомах Рассмотрим α-окисление жирных кислот в животных клетках на примере фитановой кислоты.
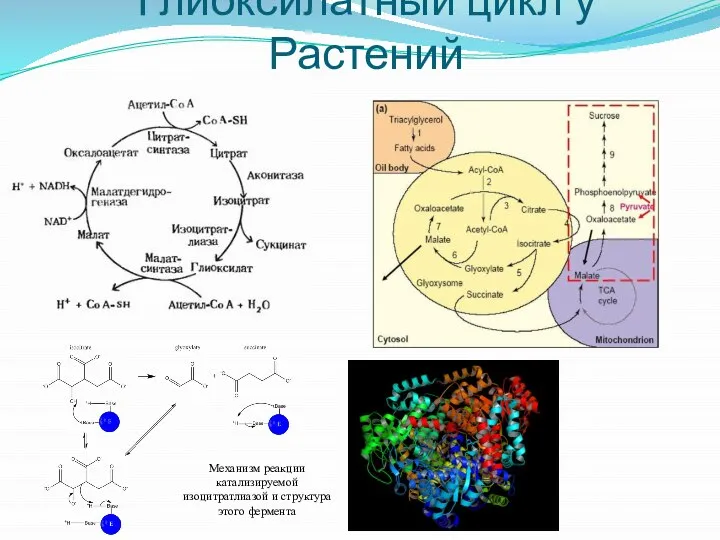
- 29. Глиоксилатный цикл у Растений Механизм реакции катализируемой изоцитратлиазой и структура этого фермента
- 31. Скачать презентацию


 Научные достижение в биологии за последние 10 лет
Научные достижение в биологии за последние 10 лет 3 закона Г.И. Менделя
3 закона Г.И. Менделя Дикие и домашние животные
Дикие и домашние животные Презентация на тему Клетки крови 8 класс
Презентация на тему Клетки крови 8 класс  Животные водоема
Животные водоема Решение генетических задач
Решение генетических задач Этапы эволюции человека
Этапы эволюции человека Многообразие и экология грибов
Многообразие и экология грибов Взаимодействие неаллельных генов. Неполное доминирование
Взаимодействие неаллельных генов. Неполное доминирование Скорпион
Скорпион Злаковые растения
Злаковые растения Голосеменные растения
Голосеменные растения Для чего человеку нужны кости и мышцы?
Для чего человеку нужны кости и мышцы? Грибы
Грибы Эумеланин. Феомеланин
Эумеланин. Феомеланин Подразливість та рухи рослин
Подразливість та рухи рослин Нервная система
Нервная система Строение и функции соматической нервной системы
Строение и функции соматической нервной системы Гровинг (Growing)
Гровинг (Growing) В лес по ягоды
В лес по ягоды Презентация на тему Биотопливо проблемы и перспективы
Презентация на тему Биотопливо проблемы и перспективы  Ситуационная задача по биохимии
Ситуационная задача по биохимии Большие кошки (начало)
Большие кошки (начало)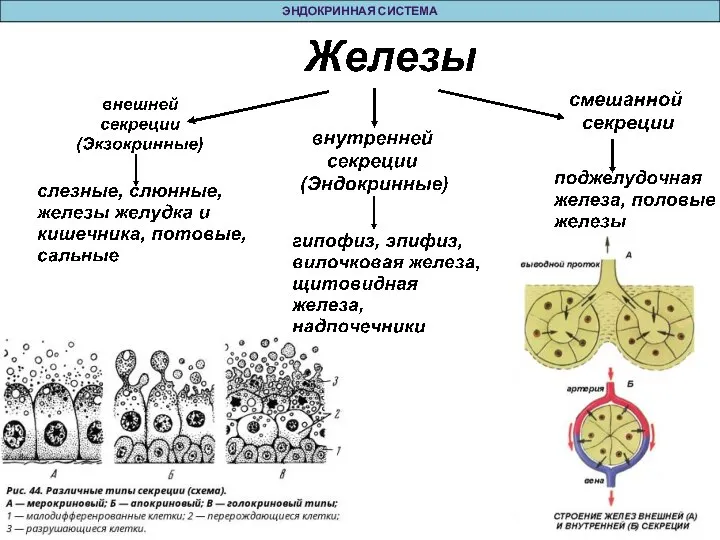 Эндокринная система
Эндокринная система Atmosfera temasy boýunça umumylaşdyrmak.Test
Atmosfera temasy boýunça umumylaşdyrmak.Test Dziedziczenie cech ilościowych
Dziedziczenie cech ilościowych Sindroamele de obstrucţie bronşică
Sindroamele de obstrucţie bronşică Энергетический обмен
Энергетический обмен