Содержание
- 2. Ферменты энзимы( от греческого en zyme – дрожжи) ( от латинского fermentum – закваска), эти белки
- 3. воспалительные процессы)
- 4. Сходство и отличие ферментов и неорганических катализаторов
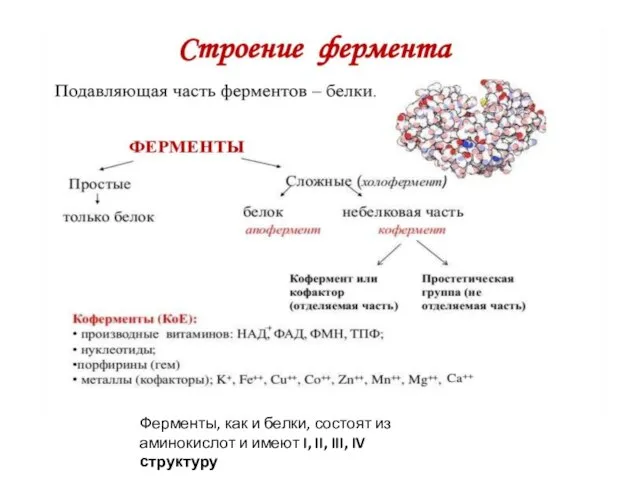
- 5. Ферменты, как и белки, состоят из аминокислот и имеют I, II, III, IV структуру
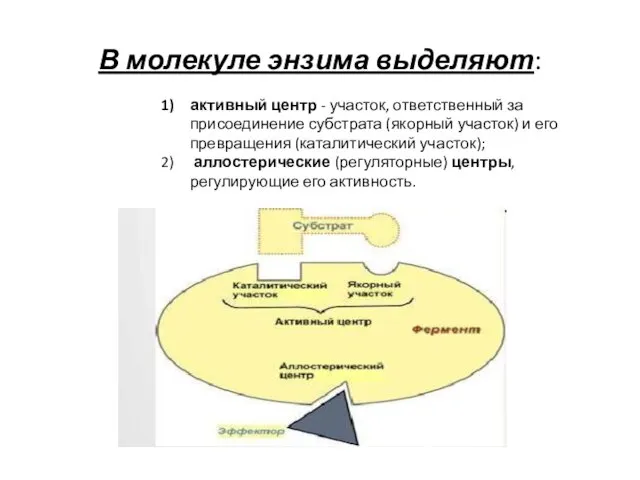
- 6. В молекуле энзима выделяют: активный центр - участок, ответственный за присоединение субстрата (якорный участок) и его
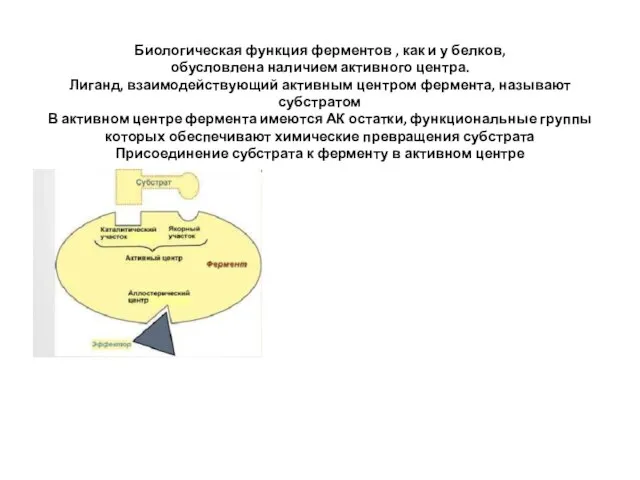
- 7. Биологическая функция ферментов , как и у белков, обусловлена наличием активного центра. Лиганд, взаимодействующий активным центром
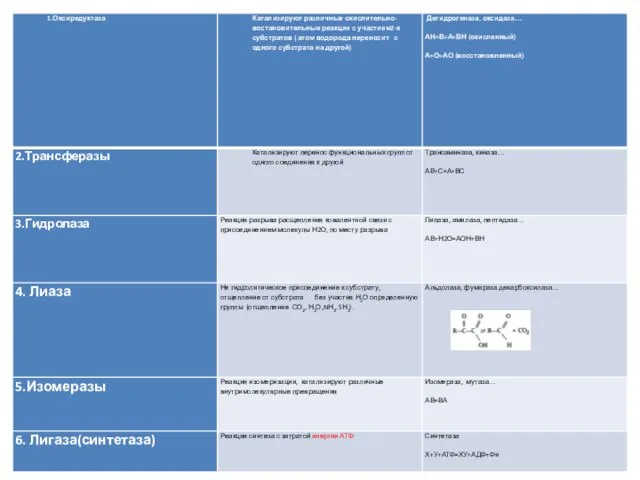
- 8. Номенклатура ферментов В 1961 году на международном союзе биохимиков была выдвинута единая классификация ферментов В 1972
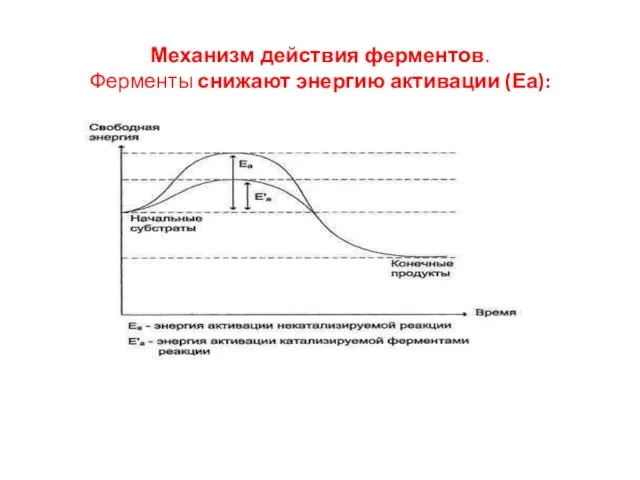
- 10. Механизм действия ферментов. Ферменты снижают энергию активации (Еа):
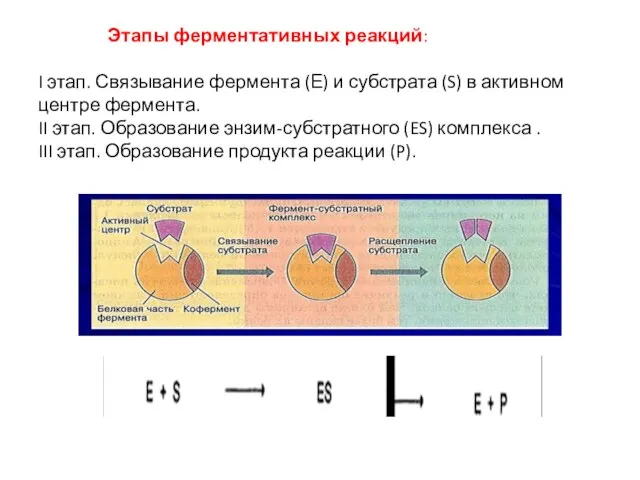
- 11. Этапы ферментативных реакций: I этап. Связывание фермента (Е) и субстрата (S) в активном центре фермента. II
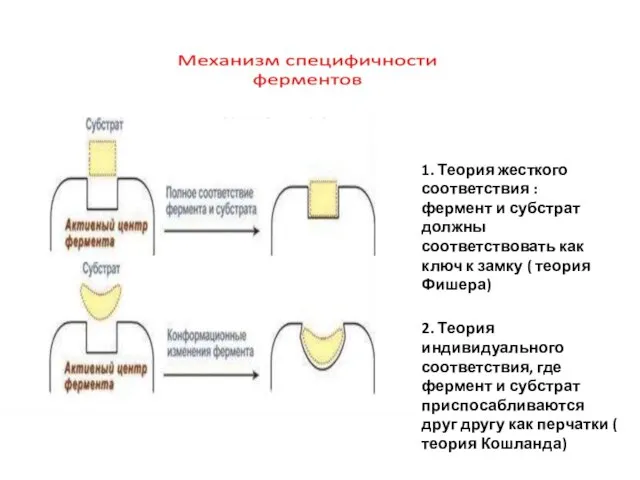
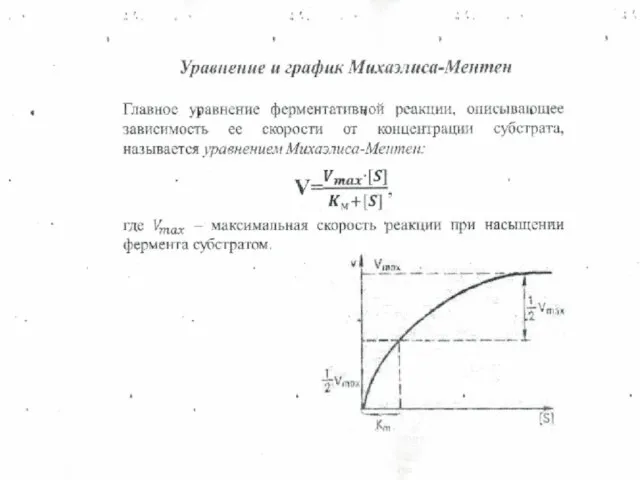
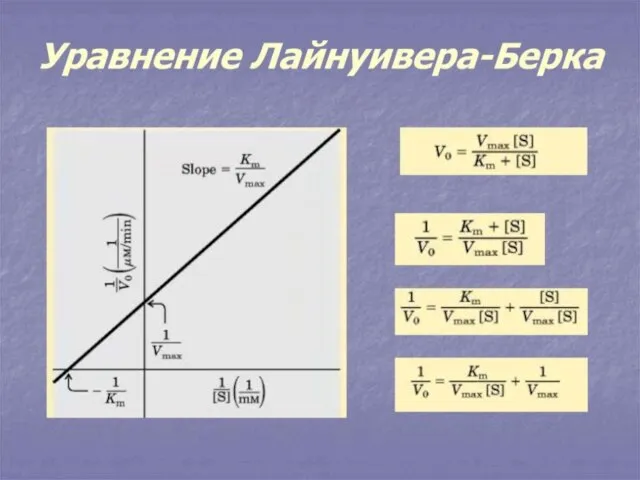
- 12. 1. Теория жесткого соответствия : фермент и субстрат должны соответствовать как ключ к замку ( теория
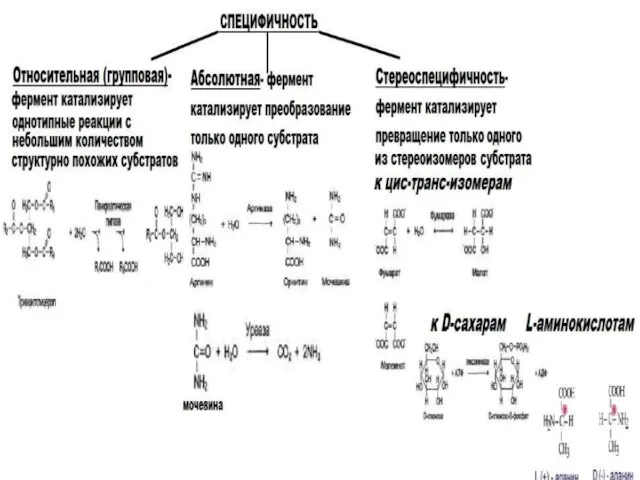
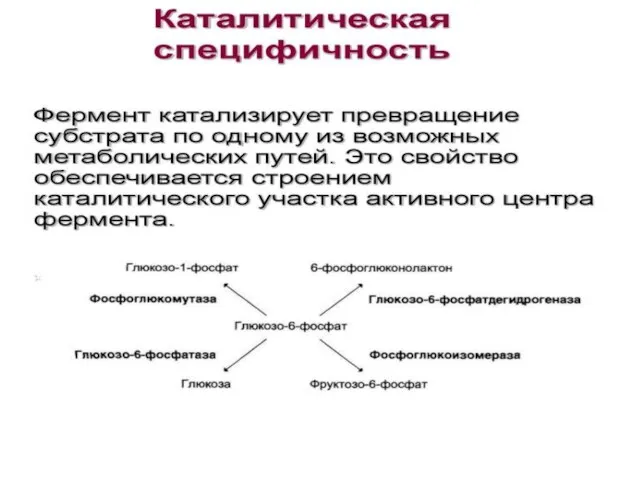
- 13. Специфичность
- 17. Активность ферментов и единицы активности ферментов •Международная единица (МЕ) активности фермента – это количество фермента, которое
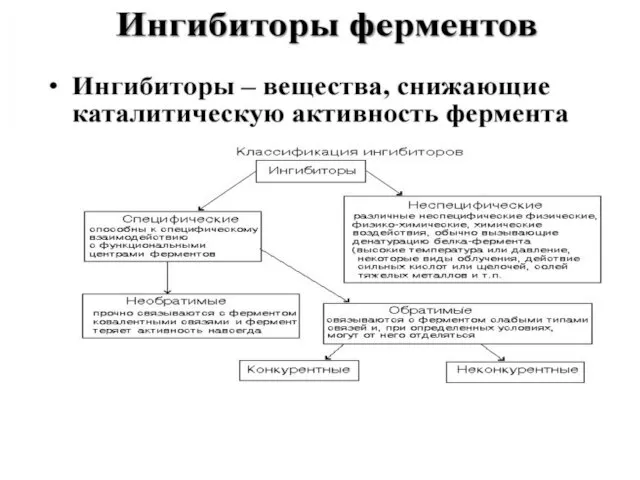
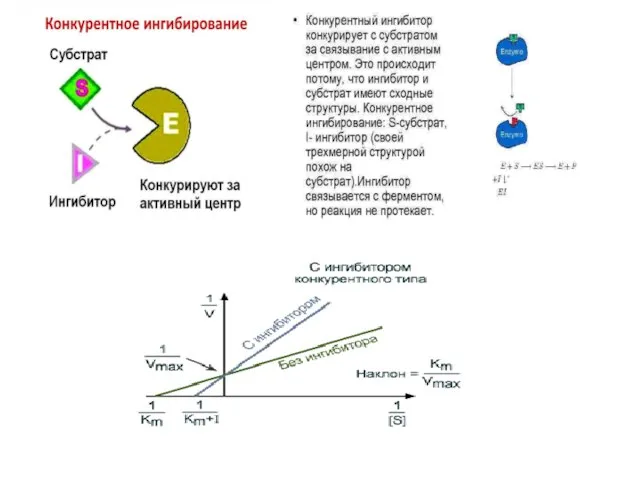
- 18. КОФЕРМЕНТЫ – низкомолекулярные органические вещества не белковой природы. Они чаще всего содержат в своём составе различные
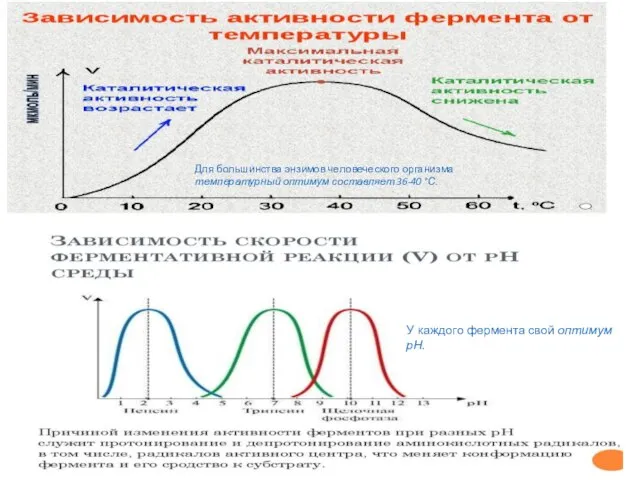
- 24. У каждого фермента свой оптимум рН. Для большинства энзимов человеческого организма температурный оптимум составляет 36-40 °С.
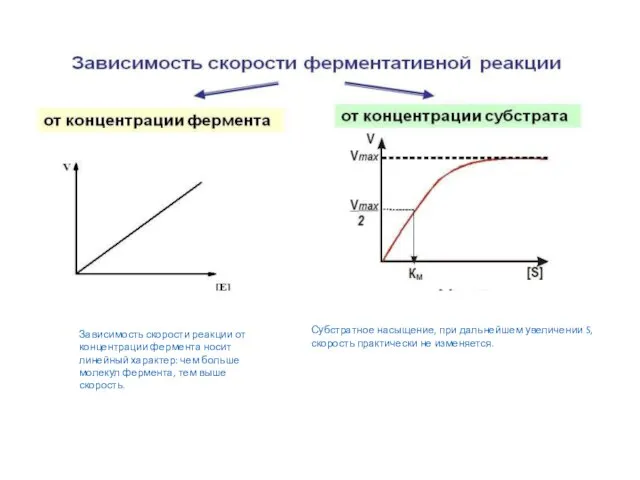
- 25. Зависимость скорости реакции от концентрации фермента носит линейный характер: чем больше молекул фермента, тем выше скорость.
- 33. Медицинская энзимология – это энзимология, которая изучает применение ферментов в медицине. В медицинской энзимологии выделяют три
- 37. Скачать презентацию















 Генетические доказательства эволюции
Генетические доказательства эволюции Бактерии. Тема урока:что такое бактерия, строения бактериальной клетки, формы бактерий, виды бактерий.
Бактерии. Тема урока:что такое бактерия, строения бактериальной клетки, формы бактерий, виды бактерий. Расселение и распространение живых организмов
Расселение и распространение живых организмов Законы наследственности. Типы гибридизации
Законы наследственности. Типы гибридизации Барбарис Тунберга
Барбарис Тунберга The human brain
The human brain Кабачок. 3 класс
Кабачок. 3 класс Пастереллез, или геморрагическая септицемия молодняка
Пастереллез, или геморрагическая септицемия молодняка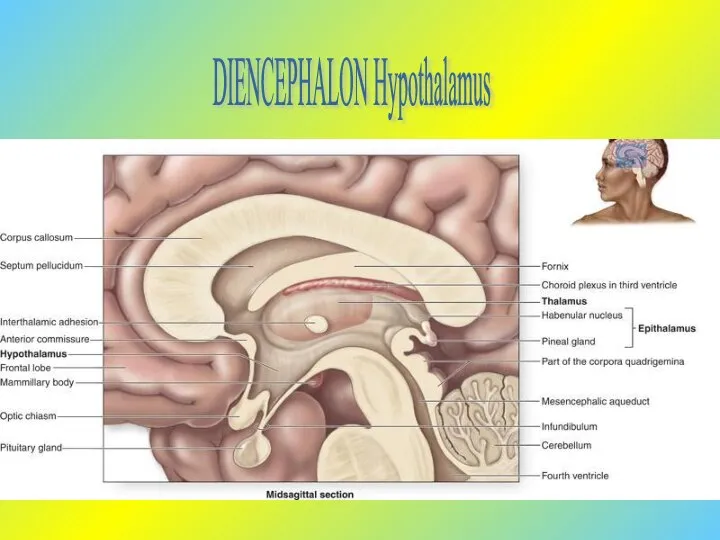 Гипоталамус
Гипоталамус Кожа. Структура кожи
Кожа. Структура кожи Презентация на тему Кроссворд на тему Организм человека
Презентация на тему Кроссворд на тему Организм человека  Страусообразные, Нандуобразные, Казуарообразные, Гусеобразные
Страусообразные, Нандуобразные, Казуарообразные, Гусеобразные Кожа человека
Кожа человека Фотосинтез
Фотосинтез Анатомия органов слуха
Анатомия органов слуха Тип Моллюски
Тип Моллюски Анализаторы. Строение и общие закономерности развития сенсорных систем
Анализаторы. Строение и общие закономерности развития сенсорных систем Микология (греч. Микес – гриб) - наука о грибах
Микология (греч. Микес – гриб) - наука о грибах Морские жители
Морские жители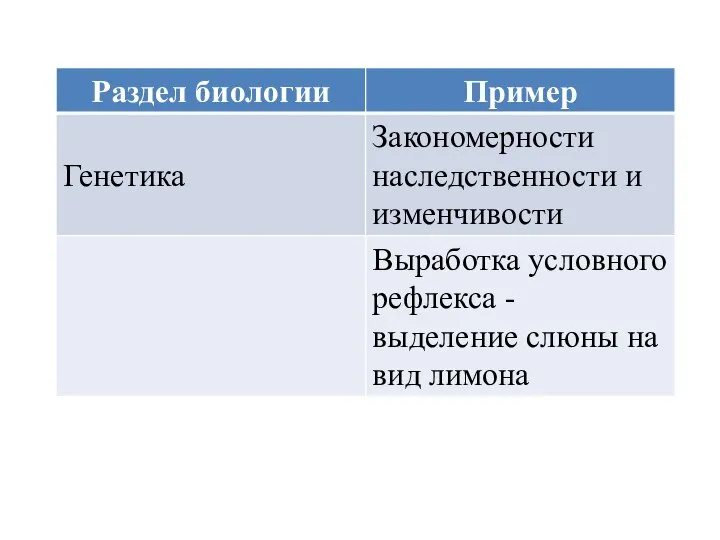 Раздел биологии. Генетика
Раздел биологии. Генетика Половые клетки
Половые клетки Введение в изучение спланхнологии. Функциональная анатомия органов пищеварительной и дыхательной систем
Введение в изучение спланхнологии. Функциональная анатомия органов пищеварительной и дыхательной систем Задачи генетика
Задачи генетика Презентация на тему Земля - наш дом
Презентация на тему Земля - наш дом  ВПР. Зоология, 7 класс
ВПР. Зоология, 7 класс Скелет туловища
Скелет туловища Рівні організації живої матерії
Рівні організації живої матерії Лучевая диагностика. Предмет история развития
Лучевая диагностика. Предмет история развития