Супрамолекулярная химия в живой природе. Тетрапиррольные макроциклы. Кобаламин. Гемоглобин. ДНК. РНК. Синтез белка
- Главная
- Биология
- Супрамолекулярная химия в живой природе. Тетрапиррольные макроциклы. Кобаламин. Гемоглобин. ДНК. РНК. Синтез белка

Содержание
- 2. ВИТАМИН В12 (кобаламины), группа соед. - производных коррина (ф-ла I), предотвращающих развитие злокачеств. анемии и дегенеративные
- 4. Основные формы витамина В12 Оксикобаламин (II, R = ОН) - фиолетово-красные кристаллы; т. пл. 300°С (с
- 5. Метилкобаламин (СН3-В12; ф-ла II, R = СН3) - в организме находится в меньших кол-вах, чем др.
- 6. В молекуле витамина В12 центральный атом кобальта соединен с атомами азота четырех восстановленных пиррольных колец, образующих
- 7. Биологическая роль. В 20-х годах ХХ века было замечено, что смертельно опасную пернициозную анемию можно вылечить
- 8. Для понимания биохимической роли кофермента В12 сначала необходимо дать определение понятию «кофермент». Коферменты, или коэнзимы —
- 10. Биологическая роль. Выявлены ферментные системы, в составе которых в качестве простетической группы участвуют не свободный витамин
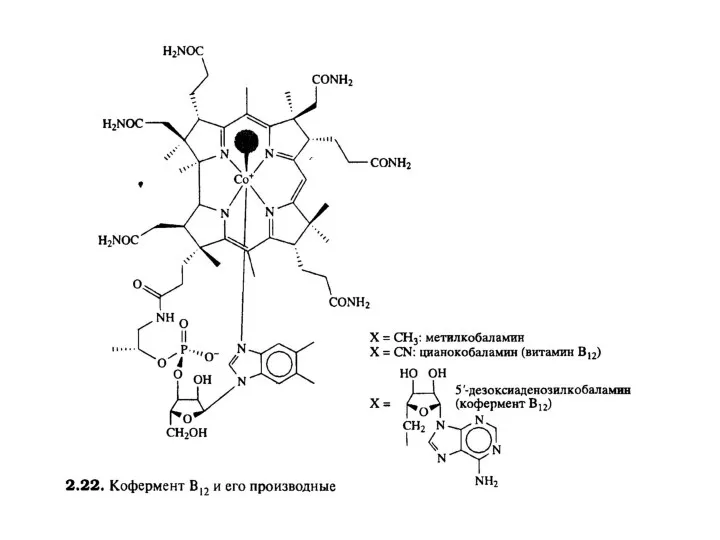
- 11. Химические реакции, в которых витамин В12 принимает участие как кофермент, условно делят на 2 группы в
- 12. Вторая группа реакций при участии В12-коферментов заключается во внутримолекулярном переносе водорода в реакциях изомеризации. Механизм этих
- 13. Следует подчеркнуть, что реакция изомеризации метилмалонил-КоА требует наличия 5'-дезоксиаденозилкобаламина в качестве кофермента, в то время как
- 14. Радикальный механизм мутазной активности Биохимия кофермента В12 обычно связана или с мутазной активностью фермента, включающей миграцию
- 15. Распространение в природе и суточная потребность. Витамин В12 является единственным витамином, синтез которого осуществляется исключительно микроорганизмами;
- 16. Гемоглобин. Гем = протопорфирин + Fe2+
- 17. Жизненно необходимой составляющей метаболизма высших организмов является кислород воздуха. Он метаболически окисляет сахара, такие, как глюкоза
- 18. Для того чтобы аэробные организмы могли использовать реакционноспособ- ный О2 в процессе, противоположном фотосинтезу, необходимо поглотить
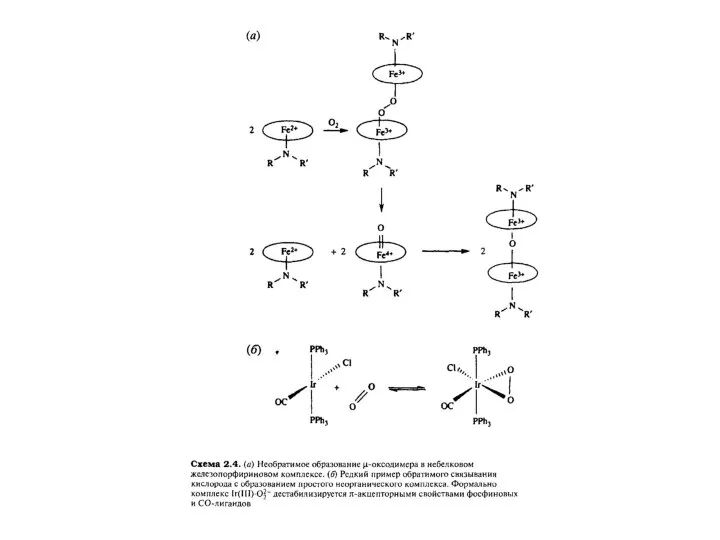
- 20. Главной проблемой реакции металлических центров с О2 является его склонность к необратимому окислительному взаимодействию с металлическим
- 21. В соответствии с моделью Вайсса Fe3+-центр является Низкоспиновым/ Это должно приводить к парамагнетизму как от одного
- 23. Окисленный гем и его непосредственное белковое окружение, включающее стабилизирующие водородные связи.
- 24. Хорошо известно, что такие газы, как СО, или легкоадсорбирующиеся соли, например CN-, крайне токсичны. Это происходит
- 26. ДНК, РНК и биосинтез белка. Нуклеиновые кислоты как самособирающиеся супрамолекулярные системы. Ученые никогда не переставали удивляться
- 27. ДНК (дезоксирибонуклеиновая кислота) хорошо известна как молекула, несущая в себе всю генетическую информацию, необходимую для построения
- 29. Как и большинство других моносахаридов, рибоза существует не в линейной, а в циклической полуацетальной форме. Последняя
- 31. С помощью ферментативного гидролиза нуклеиновых кислот было установлено, что элементарными звеньями, из которых они состоят, являются
- 39. Биосинтез белка происходит в два этапа. В первый этап входит транскрипция и процессинг РНК, второй этап
- 40. Между транскрипцией и трансляцией молекула мРНК претерпевает ряд последовательных изменений, которые обеспечивают созревание функционирующей матрицы для
- 41. Сплайсинг (от англ. splice — сращивать или склеивать концы чего-либо) — процесс вырезания определенных нуклеотидных последовательностей
- 42. Экзон [от английского ex(pressi)on — выражение, выразительность], участок гена (ДНК) эукариот, несущий генетическую информацию, кодирующую синтез
- 43. Трансляция У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции, а у
- 45. Скачать презентацию
Слайд 2ВИТАМИН В12 (кобаламины), группа соед. - производных коррина (ф-ла I), предотвращающих развитие
ВИТАМИН В12 (кобаламины), группа соед. - производных коррина (ф-ла I), предотвращающих развитие
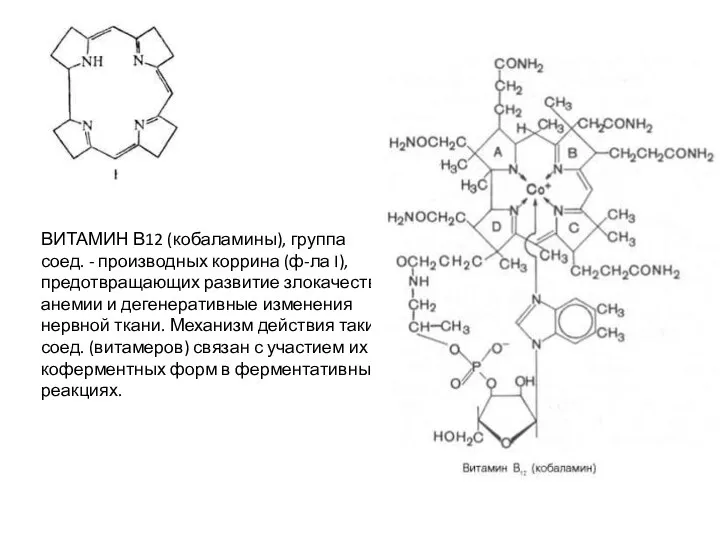
Слайд 4Основные формы витамина В12
Оксикобаламин (II, R = ОН) - фиолетово-красные кристаллы; т.
Основные формы витамина В12
Оксикобаламин (II, R = ОН) - фиолетово-красные кристаллы; т.
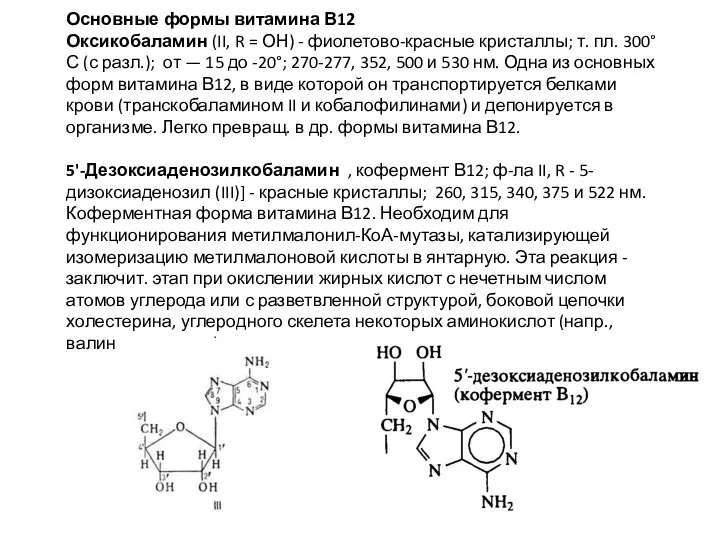
5'-Дезоксиаденозилкобаламин , кофермент В12; ф-ла II, R - 5-дизоксиаденозил (III)] - красные кристаллы; 260, 315, 340, 375 и 522 нм. Коферментная форма витамина В12. Необходим для функционирования метилмалонил-КоА-мутазы, катализирующей изомеризацию метилмалоновой кислоты в янтарную. Эта реакция - заключит. этап при окислении жирных кислот с нечетным числом атомов углерода или с разветвленной структурой, боковой цепочки холестерина, углеродного скелета некоторых аминокислот (напр., валина, треонина).
Слайд 5Метилкобаламин (СН3-В12; ф-ла II, R = СН3) - в организме находится в
Метилкобаламин (СН3-В12; ф-ла II, R = СН3) - в организме находится в

Кофермент В12 и его производные - единственные металлоорганические соединения естественного происхождения. В физиологических условиях (рН 7, окисленный водный раствор) связь Со-С очень стабильна.
Цианокобаламин (II, R = CN) - лек. форма витамина В12, не встречающаяся в природе. Кристаллич. вещество рубиново-красного цвета; мол. м. 1355,5, выше 200°С постепенно разлагается, не плавясь до 320 °С; —59,9°; раств. в воде (1,25% при 25 °С), низших спиртах и алифатич. кислотах, феноле, ДМСО, не раств. в др. орг. растворителях; 278, 361, 525, 550 нм. Группа CN и остаток 5,6-диметилбензимидазолилриботида занимает в молекуле аксиальное положение по отношению к корриновому циклу. Цианокобаламин разрушается под действием окислителей, восстановителей и света. Его водные растворы устойчивы при рН 4,0-7,0. Группа CN легко замещается др. лигандами, например ОН, NO2, SO3, СН3. Образующиеся производные под действием иона CN- вновь превращ. в Цианокобаламин.
Слайд 6В молекуле витамина В12 центральный атом кобальта соединен с атомами азота четырех
В молекуле витамина В12 центральный атом кобальта соединен с атомами азота четырех

Слайд 7Биологическая роль.
В 20-х годах ХХ века было замечено, что смертельно опасную пернициозную
Биологическая роль.
В 20-х годах ХХ века было замечено, что смертельно опасную пернициозную

В 1955 Д. Ходжкин расшифровала структуру. В 1964 г. Д. Кроуфут-Ходжкин была удостоена Нобелевской премии в области химии за определение кристаллической структуры
Слайд 8Для понимания биохимической роли кофермента В12 сначала необходимо дать определение понятию «кофермент».
Для понимания биохимической роли кофермента В12 сначала необходимо дать определение понятию «кофермент».

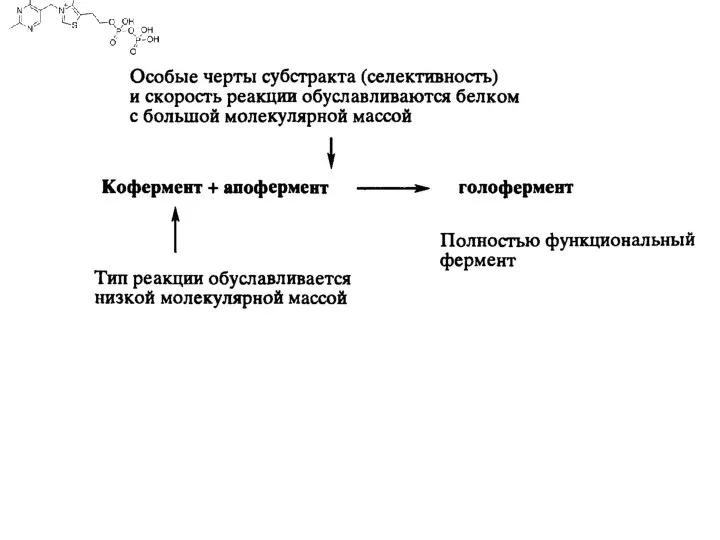
Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента. Комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента, называемую холоферментом. Роль коферментов нередко играют витамины или их метаболиты (чаще всего — фосфорилированные формы витаминов группы B). Например, коферментом фермента карбоксилазы является тиамин-пирофосфат, коферментом многих аминотрансфераз — пиридоксаль-6-фосфат. Кофермент — одна из составных частей биологической каталитической системы. Для функционирования такой системы требуются кофермент, апофермент и субстрат. Химическая реакция происходит между коферментом и субстратом, а оба они связываются апоферментом. кофермент В12 участвует в целом ряде биологических реакций с различными апоферментами. Эти реакции могут включать гомолиз связи Со—С, приводящий к образованию алкильного радикала, который вызывает перестройку структуры, а также к редокс-реакции путем восстановления до Со(Н) и СоA) и алкилирования. Тип реакции определяется природой кофермента, тогда как природа апофермента отвечает за селективность реакции по отношению к субстрату и за региоспецифичность.
Слайд 10Биологическая роль. Выявлены ферментные системы, в составе которых в качестве простетической группы
Биологическая роль. Выявлены ферментные системы, в составе которых в качестве простетической группы

Слайд 11Химические реакции, в которых витамин В12 принимает участие как кофермент, условно делят
Химические реакции, в которых витамин В12 принимает участие как кофермент, условно делят
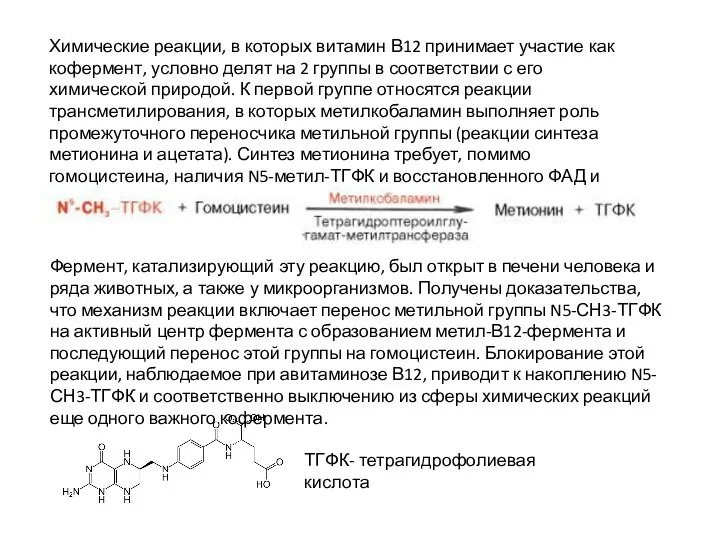
Фермент, катализирующий эту реакцию, был открыт в печени человека и ряда животных, а также у микроорганизмов. Получены доказательства, что механизм реакции включает перенос метильной группы N5-СН3-ТГФК на активный центр фермента с образованием метил-В12-фермента и последующий перенос этой группы на гомоцистеин. Блокирование этой реакции, наблюдаемое при авитаминозе В12, приводит к накоплению N5-СН3-ТГФК и соответственно выключению из сферы химических реакций еще одного важного кофермента.
ТГФК- тетрагидрофолиевая кислота
Слайд 12Вторая группа реакций при участии В12-коферментов заключается во внутримолекулярном переносе водорода в
Вторая группа реакций при участии В12-коферментов заключается во внутримолекулярном переносе водорода в
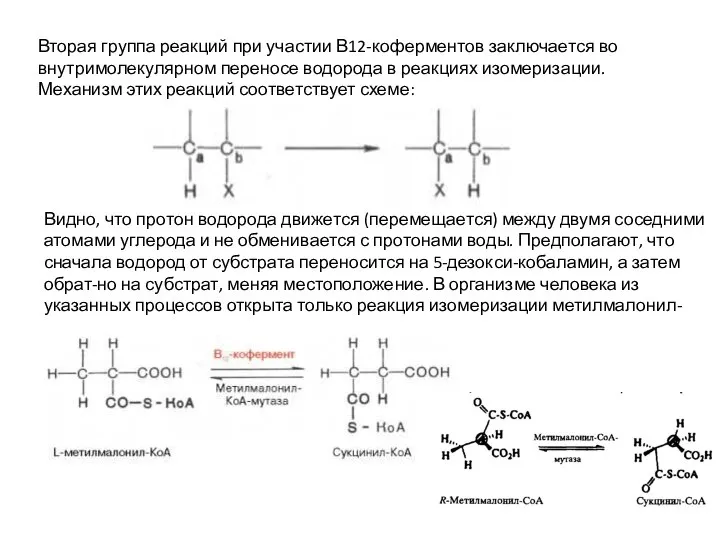
Видно, что протон водорода движется (перемещается) между двумя соседними атомами углерода и не обменивается с протонами воды. Предполагают, что сначала водород от субстрата переносится на 5-дезокси-кобаламин, а затем обрат-но на субстрат, меняя местоположение. В организме человека из указанных процессов открыта только реакция изомеризации метилмалонил-КоА в сукцинил-КоА.
Слайд 13Следует подчеркнуть, что реакция изомеризации метилмалонил-КоА требует наличия 5'-дезоксиаденозилкобаламина в качестве кофермента,
Следует подчеркнуть, что реакция изомеризации метилмалонил-КоА требует наличия 5'-дезоксиаденозилкобаламина в качестве кофермента,

Слайд 14Радикальный механизм мутазной активности
Биохимия кофермента В12 обычно связана или с мутазной активностью
Радикальный механизм мутазной активности
Биохимия кофермента В12 обычно связана или с мутазной активностью
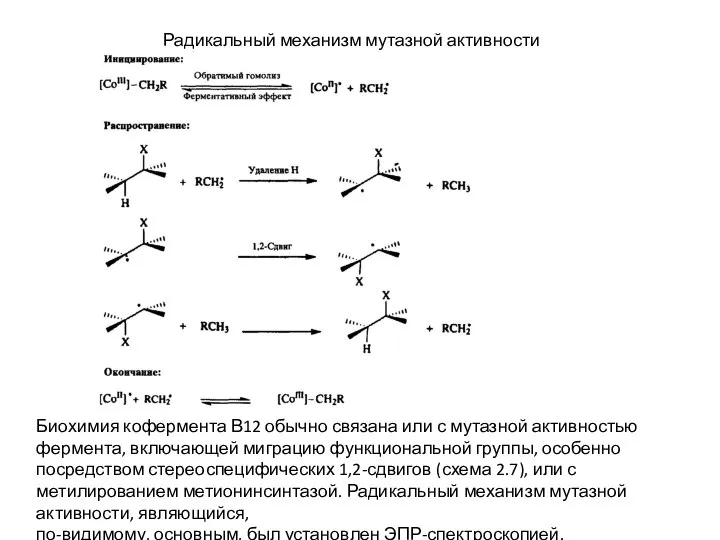
по-видимому, основным, был установлен ЭПР-спектроскопией.
Слайд 15Распространение в природе и суточная потребность. Витамин В12 является единственным витамином, синтез
Распространение в природе и суточная потребность. Витамин В12 является единственным витамином, синтез

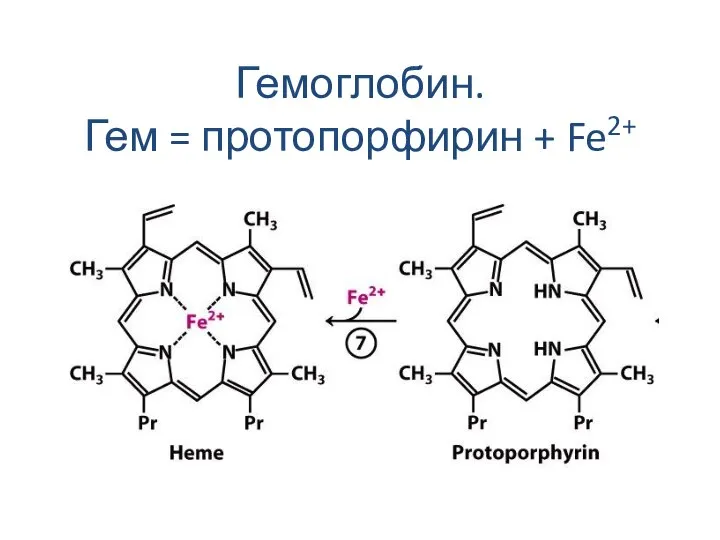
Слайд 16Гемоглобин.
Гем = протопорфирин + Fe2+
Гемоглобин.
Гем = протопорфирин + Fe2+
Слайд 17Жизненно необходимой составляющей метаболизма высших
организмов является кислород воздуха. Он метаболически окисляет
Жизненно необходимой составляющей метаболизма высших
организмов является кислород воздуха. Он метаболически окисляет

В первобытном океане вода была наиболее мощным источником электронов. К сожалению, для простейших организмов О2 - крайне реакционноспособный и высокотоксичный газ. Первоначально кислород удалялся из атмосферы восстановленными ионами таких металлов, как Fe(II) и Мп(Н), но 2 млрд лет назад , судя по отложениям большого количества осадков оксидов металлов, содержание О2 в атмосфере начало расти с менее 1 % (как на необитаемых планетах и Луне сейчас) до 21% (по объему). В результате большинство простейших организмов должно было бы погибнуть по механизмам гибели радикалов и окисления металлоферментов. Выжить смогли только вновь развившиеся аэробные организмы,
появившиеся благодаря избытку этого высокоэнергетического соединения. В настоящее время выживают только те немногие анаэробные организмы, которые живут в экологических нишах, например в глубине океан?, куда не может проникнуть атмосферный кислород, а также те, которые способны развить защитные механизмы от воздействия О2 и его частично восстановленных радикальных продуктов.
Слайд 18Для того чтобы аэробные организмы могли использовать реакционноспособ-
ный О2 в процессе,
Для того чтобы аэробные организмы могли использовать реакционноспособ-
ный О2 в процессе,
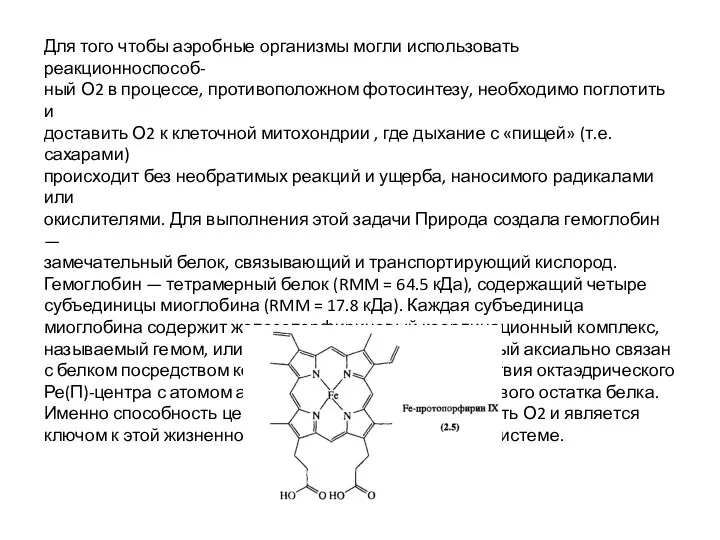
доставить О2 к клеточной митохондрии , где дыхание с «пищей» (т.е. сахарами)
происходит без необратимых реакций и ущерба, наносимого радикалами или
окислителями. Для выполнения этой задачи Природа создала гемоглобин —
замечательный белок, связывающий и транспортирующий кислород. Гемоглобин — тетрамерный белок (RMM = 64.5 кДа), содержащий четыре субъединицы миоглобина (RMM = 17.8 кДа). Каждая субъединица миоглобина содержит железопорфириновый координационный комплекс, называемый гемом, или Fe-протопорфирином IX, который аксиально связан с белком посредством координационного взаимодействия октаэдрического Ре(П)-центра с атомом азота из ближайшего гистидинового остатка белка. Именно способность центра железа обратимо связывать О2 и является ключом к этой жизненно необходимой биологической системе.
Слайд 20Главной проблемой реакции металлических центров с О2 является его
склонность к необратимому
Главной проблемой реакции металлических центров с О2 является его
склонность к необратимому

соответственно быть равны концентрациям, найденным в легких и во внутриклеточной среде. Более того, связывание О2 должно происходить селективно по отношению к остальным компонентам атмосферы, таким, например, как вода, N2, СО2, и такому великолепному для Fe(II) лиганду, как СО. Таким образом, гемоглобин - превосходный пример функционального и селективного супрамолекулярного рецептора.
Лаури Васка (англ. Lauri Vaska) (род. 7 мая 1925 в Раквере, Эстляндская губерния, Российская империя) — американский химик эстонского происхождения, внёсший существенный вклад в металлоорганическую химию.
В 1957 году Лаури Васка был принят в том же качестве в Меллонский институт в Питтсбурге, в котором проработал вплоть до 1964 года.Период его работы в Меллонском институте был особенно плодотворным. Совместно с доктором Ди Луцио в 1962 году Васка впервые дал описание иридиумному соединению, которое теперь известно под названием Комплекс Васка, транс-IrCl(CO)[P(C6H5)3]2. Совместно с рядом других учёных ему удалось продемонстрировать, что в данном соединении протекает ряд реакций с малыми молекулами. Например, он путём окисления может добавлять H2 для того, чтобы получился дигидрид. Впоследствии Васка обнаружил, что его комплекс имеет реверсивную O2 связь. Лаури открыл главные реакции окислительного присоединения, которые являются основными в процессе гомогенного катализа в металлоорганической химии.
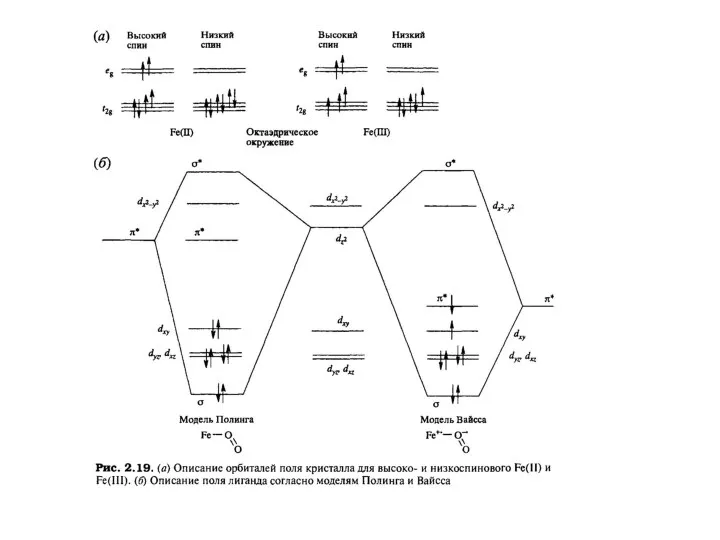
Слайд 21В соответствии с моделью Вайсса Fe3+-центр является
Низкоспиновым/ Это должно приводить к
В соответствии с моделью Вайсса Fe3+-центр является
Низкоспиновым/ Это должно приводить к

высокоспиновый Fe(III)-центр, у которого было бы пять неспаренных
электронов).
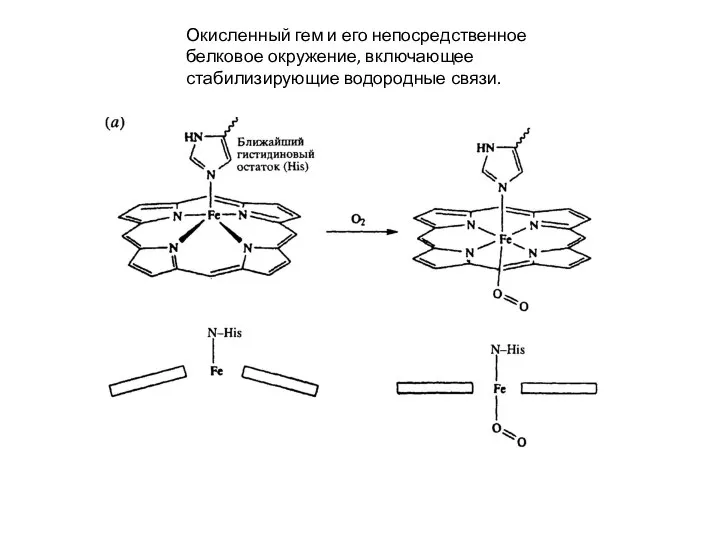
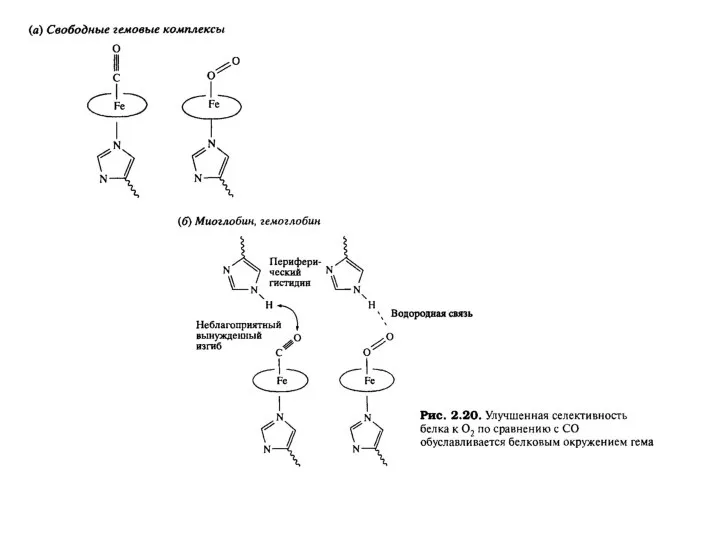
Слайд 23Окисленный гем и его непосредственное белковое окружение, включающее
стабилизирующие водородные связи.
Окисленный гем и его непосредственное белковое окружение, включающее
стабилизирующие водородные связи.
Слайд 24Хорошо известно, что такие газы, как СО, или легкоадсорбирующиеся соли,
например CN-,
Хорошо известно, что такие газы, как СО, или легкоадсорбирующиеся соли,
например CN-,

Слайд 26ДНК, РНК и биосинтез белка.
Нуклеиновые кислоты как самособирающиеся супрамолекулярные системы.
Ученые никогда
ДНК, РНК и биосинтез белка.
Нуклеиновые кислоты как самособирающиеся супрамолекулярные системы.
Ученые никогда

леиновых кислот, матричный синтез белков, строгоопределенная пространственная структура ферментов и рецепторов. Исследования краун-эфиров идругих молекул-контейнеров показали,что они в какой-то мере служат относительно простым прототипом подобных систем. Вполне естественно, что в последнее время в рамках супрамолекулярной химии на первый план вышли следующие по сложности задачи, а именно создание искусственных, пока сравнительно небольших макромолекул, способных к самосборке и самоорганизации. Однако, прежде чем говорить о них, стоит на примере нуклеиновых кислот кратко напомнить о том, каким образом эти процессы реализуются в природе.
Слайд 27ДНК (дезоксирибонуклеиновая кислота) хорошо известна как молекула, несущая в себе всю генетическую
ДНК (дезоксирибонуклеиновая кислота) хорошо известна как молекула, несущая в себе всю генетическую

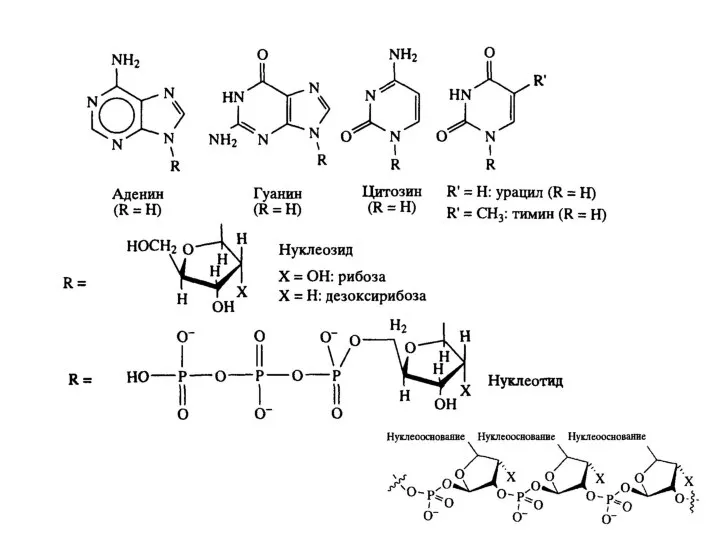
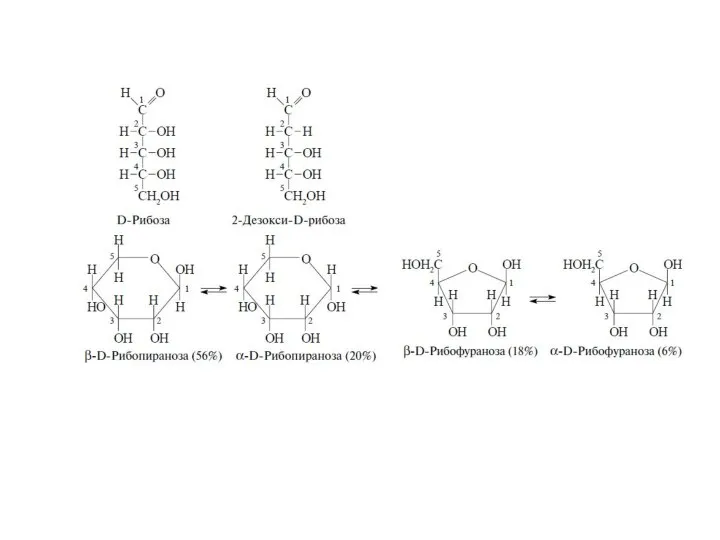
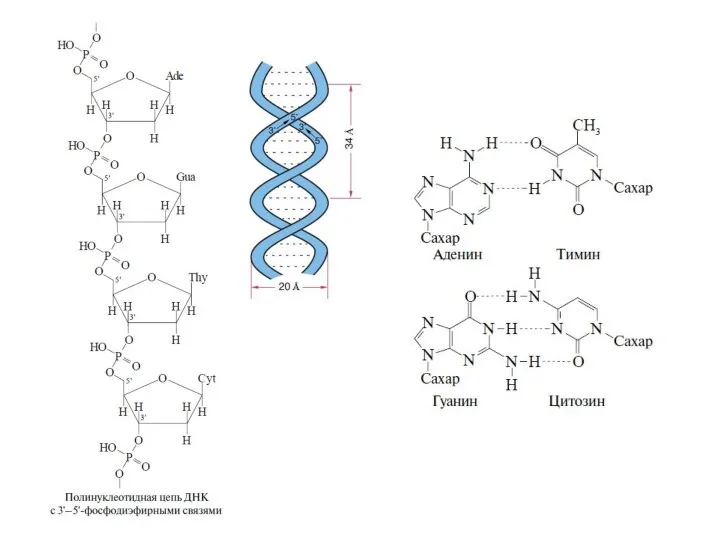
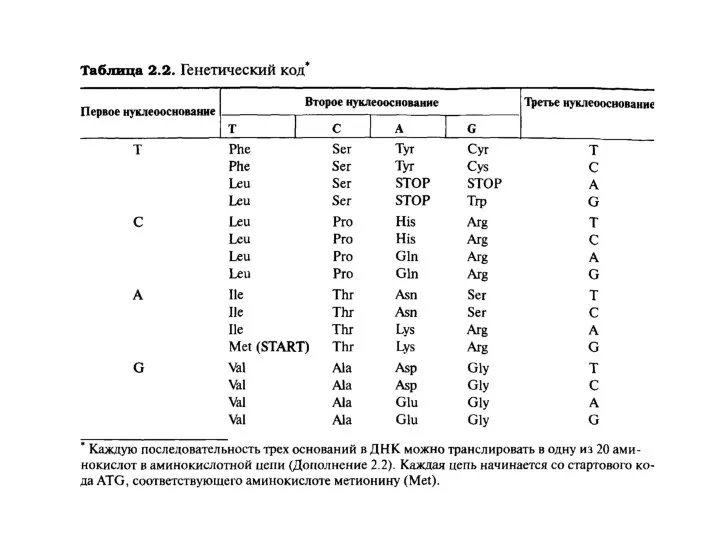
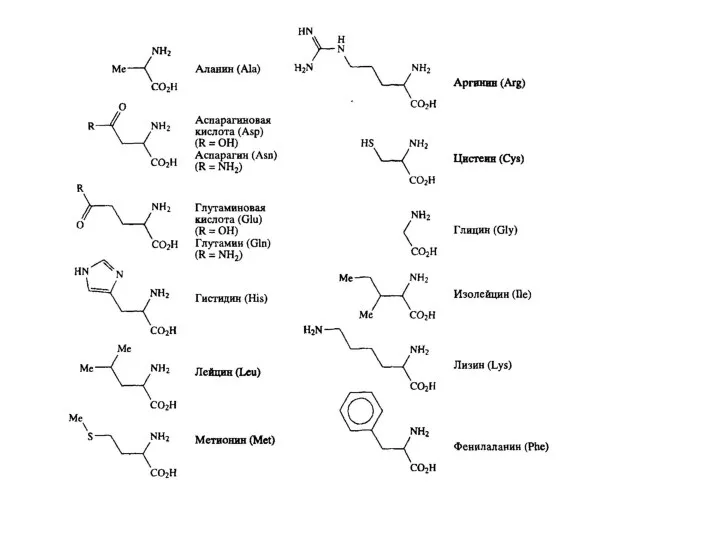
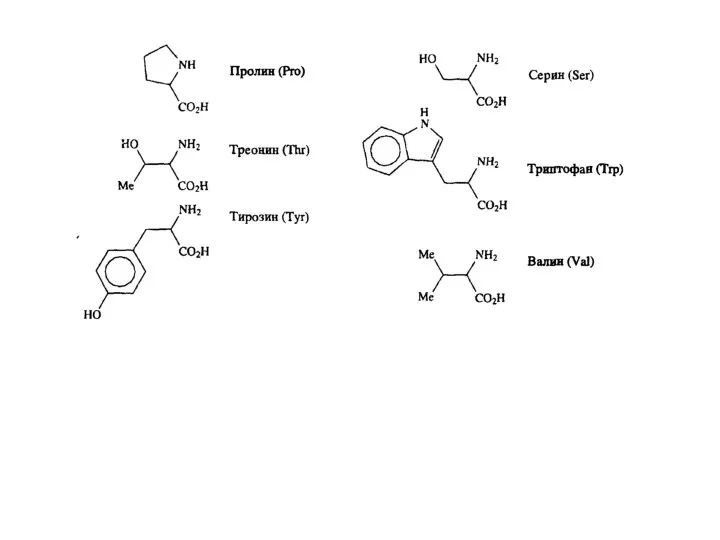
Существуют два типа нуклеиновых кислот: дезоксирибонуклеиновая кислота (ДНК) и семейство рибонуклеиновых кислот (РНК) . В ДНК закодирована вся биологическая информация, необходимая для развития и поддержания жизни живых организмов. Основная функция РНК –обеспечение синтеза надлежащих белков. С химической точки зрения нуклеиновые кислоты представляют собой биополимеры с молекулярной массой, достигающей нескольких миллионов дальтон. Основные составляющие ДНК представляют собой нуклеотиды — молекулы, содержащие нуклеооснования (аденин (А), тимин (Т), цитозин (С) или гуанин (G)), соединенные через сахар с фосфатным «хвостом». Компоненты А и Т известны как пурины, тогда как нуклеооснования С и G относятся к пиримидином. Полимеризация этих нуклеотидов через сахаро-фосфатные остатки приводит к образованию каркаса цепи ДНК B.8). Генетическая информация хранится в ДНК в виде большого числа трехбуквенных «слов». Эти «слова» содержат в себе триплеты нуклеооснований (GCC, CAG, АТС и т.д). Каждое «слово» биохимически передается в одну из 20 аминокислот белка. Имеются два существенных структурных отличия РНК от ДНК. Так, если в молекулах ДНК в качестве пиримидиновых оснований участвуют цитозин и тимин, то в РНК вместо тимина входит структурно близкий ему урацил. Второе отличие состоит в том, что сахарной компонентой в РНК является D-рибоза, в то время как в ДНК – 2-дезокси-D-рибоза.
Слайд 29Как и большинство других моносахаридов, рибоза существует не в линейной, а в

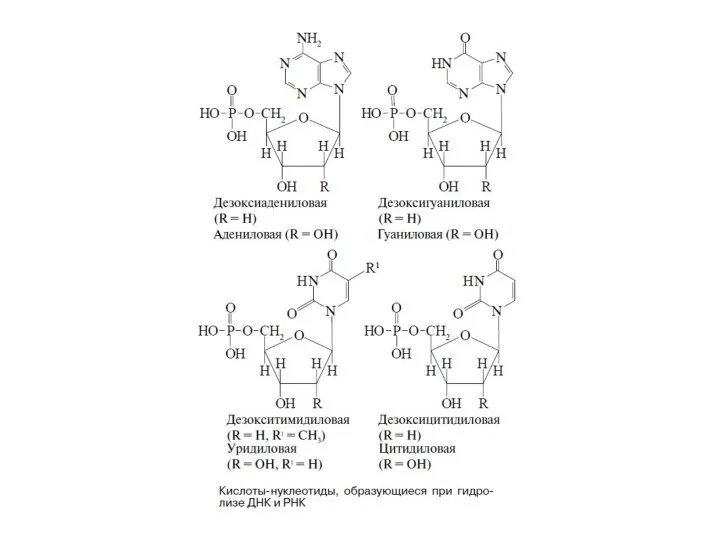
Слайд 31С помощью ферментативного гидролиза нуклеиновых кислот было установлено, что элементарными звеньями, из
С помощью ферментативного гидролиза нуклеиновых кислот было установлено, что элементарными звеньями, из

между собой так, как показано ниже. Как видно, остаток пентозы соединен с азотом N-9 в пуринах или N-1 в пиримидинах. Связь между азотистым гетеро-
циклом и сахаром осуществляется через пентозный атом углерода С-1, то есть в результате замены полуацетального гидроксила. Фосфорная кислота со-
единена сложноэфирной связью с группой CH2OH пентозы. Поскольку эта связь может осуществляться и через другие гидроксилы, в названия нуклеоти-
дов вводится уточнение, например 5'-адениловая кислота, имея в виду номер углеродного атома в группе CH2OH.
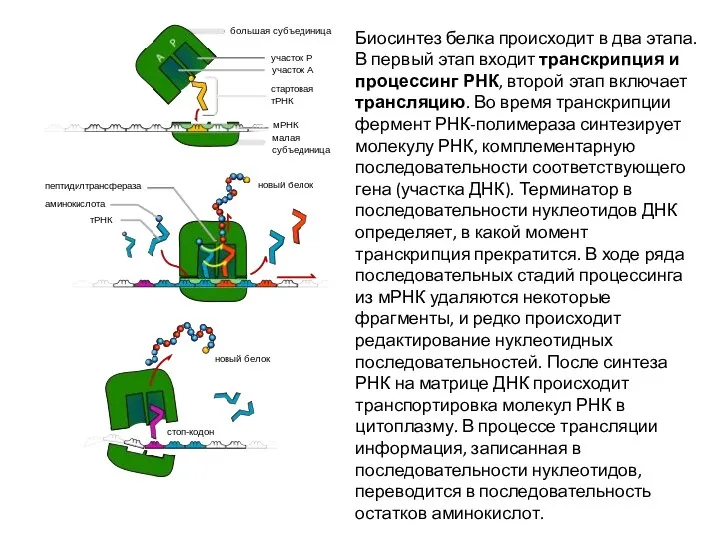
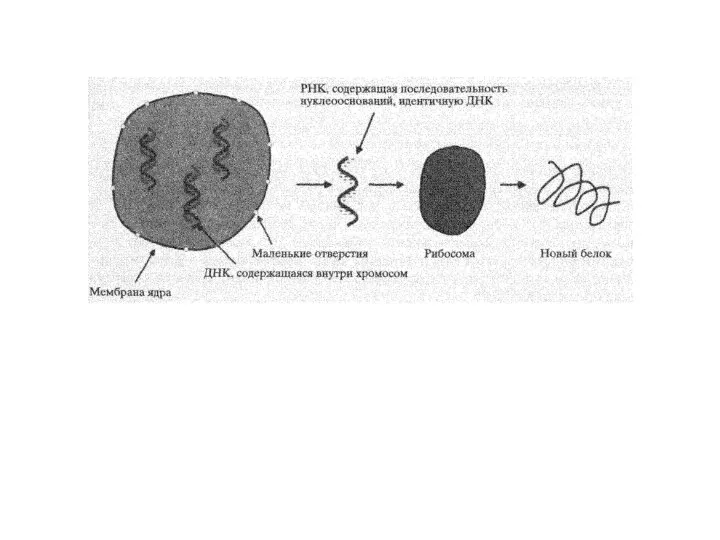
Слайд 39Биосинтез белка происходит в два этапа. В первый этап входит транскрипция и
Биосинтез белка происходит в два этапа. В первый этап входит транскрипция и
Слайд 40Между транскрипцией и трансляцией молекула мРНК претерпевает ряд последовательных изменений, которые обеспечивают
Между транскрипцией и трансляцией молекула мРНК претерпевает ряд последовательных изменений, которые обеспечивают
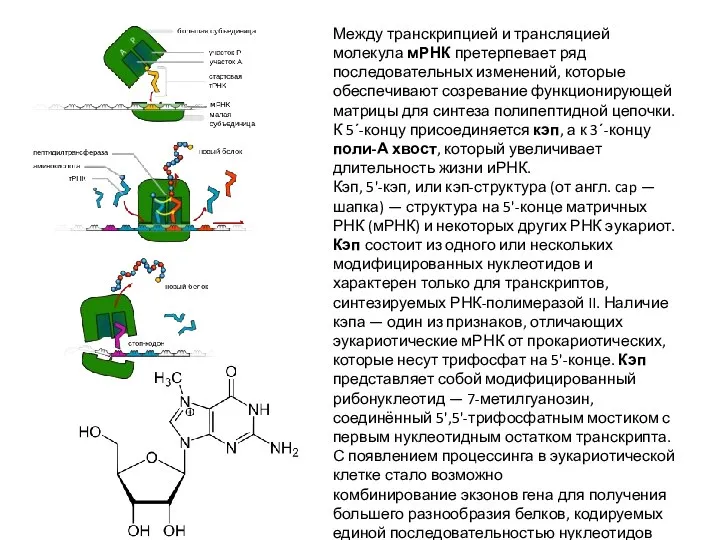
Кэп, 5'-кэп, или кэп-структура (от англ. cap — шапка) — структура на 5'-конце матричных РНК (мРНК) и некоторых других РНК эукариот. Кэп состоит из одного или нескольких модифицированных нуклеотидов и характерен только для транскриптов, синтезируемых РНК-полимеразой II. Наличие кэпа — один из признаков, отличающих эукариотические мРНК от прокариотических, которые несут трифосфат на 5'-конце. Кэп представляет собой модифицированный рибонуклеотид — 7-метилгуанозин, соединённый 5',5'-трифосфатным мостиком с первым нуклеотидным остатком транскрипта. С появлением процессинга в эукариотической клетке стало возможно комбинирование экзонов гена для получения большего разнообразия белков, кодируемых единой последовательностью нуклеотидов ДНК, — альтернативный сплайсинг.
Слайд 41Сплайсинг (от англ. splice — сращивать или склеивать концы чего-либо) — процесс
Сплайсинг (от англ. splice — сращивать или склеивать концы чего-либо) — процесс
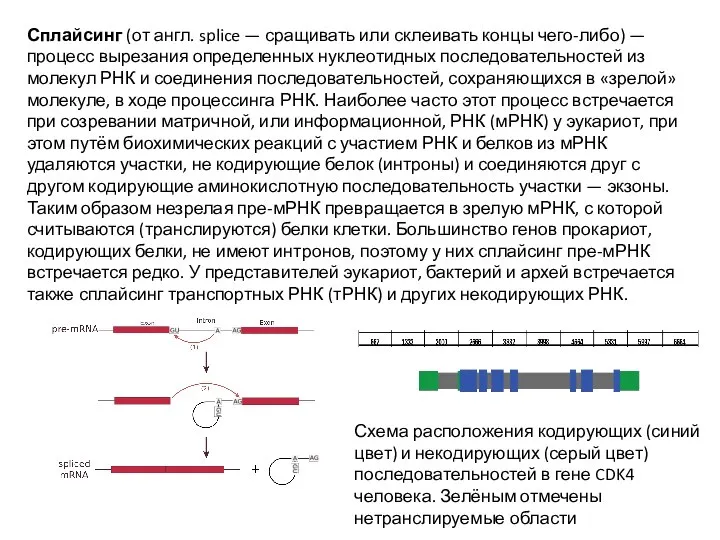
Схема расположения кодирующих (синий цвет) и некодирующих (серый цвет) последовательностей в гене CDK4 человека. Зелёным отмечены нетранслируемые области
Слайд 42Экзон [от английского ex(pressi)on — выражение, выразительность], участок гена (ДНК) эукариот, несущий генетическую
Экзон [от английского ex(pressi)on — выражение, выразительность], участок гена (ДНК) эукариот, несущий генетическую
![Экзон [от английского ex(pressi)on — выражение, выразительность], участок гена (ДНК) эукариот, несущий](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1165626/slide-41.jpg)
Альтернативный сплайсинг — процесс, позволяющий одному гену производить несколько мРНК и, соответственно, белков. Большинство генов в эукариотических геномах содержат экзоны и интроны. После транскрипции в процессе сплайсинга интроны удаляются из пре-мРНК. А вот экзон может включаться (или нет) в состав конечного транскрипта. Таким образом, с помощью альтернативного сплайсинга можно получить множество транскриптов, а, следовательно, и белков. Объединение различных сайтов сплайсинга позволяет индивидуальным генам экспрессировать множество мРНК, которые кодируют белки, порой, с антагонистическими функциями. Экзон одного варианта сплайсинга может оказаться интроном в альтернативном пути. Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка. Разные изоформы тропонина образуются в разных тканях и на определенных стадиях их развития. Предположено, что у эукариот альтернативный сплайсинг может быть важным эволюционным достижением: повысилась эффективность хранения информации. Недавно было показано, что у примерно 95 % мультиэкзонных генов человека наблюдается альтернативный сплайсинг
Слайд 43Трансляция
У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после
Трансляция
У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после


 Популяционная морфология и генетика. Актуальные направления исследований в популяционной генетике
Популяционная морфология и генетика. Актуальные направления исследований в популяционной генетике Мейоз
Мейоз Любимые дача, сад, огород, усадьба
Любимые дача, сад, огород, усадьба Аппарат Гольджи
Аппарат Гольджи Адаптация рецепторов
Адаптация рецепторов Ингибиторы пищеварительтных ферментов
Ингибиторы пищеварительтных ферментов Презентация на тему Своя игра по биологии
Презентация на тему Своя игра по биологии  Презентация на тему Обмен веществ в организме животных
Презентация на тему Обмен веществ в организме животных  Биология - наука о живой природе
Биология - наука о живой природе Вирусы и бактерии
Вирусы и бактерии Презентация на тему Тип Простейшие: класс Саркодовые, Жгутиконосцы, Инфузории
Презентация на тему Тип Простейшие: класс Саркодовые, Жгутиконосцы, Инфузории  Удивительные животные
Удивительные животные Регуляция двигательной деятельности - 1. Спинальные механизмы. Мотонейроны. Возбуждающие и тормозные интернейроны
Регуляция двигательной деятельности - 1. Спинальные механизмы. Мотонейроны. Возбуждающие и тормозные интернейроны Церамид. Фосфоглицеролипиды
Церамид. Фосфоглицеролипиды Цветок одуванчик
Цветок одуванчик Распознавание на таблицах органов и систем органов 8 класс
Распознавание на таблицах органов и систем органов 8 класс Энергетический обмен
Энергетический обмен Population statistics
Population statistics Клинические методы исследования животных
Клинические методы исследования животных Почему кровь красная?
Почему кровь красная? Тип Хордовые. Подтипы: Бесчерепные и Черепные, или Позвоночные. Класс: 7
Тип Хордовые. Подтипы: Бесчерепные и Черепные, или Позвоночные. Класс: 7 Отдел Моховидные. Класс Листостебельные (3)
Отдел Моховидные. Класс Листостебельные (3) Цветок – генеративный орган, его строение и значение
Цветок – генеративный орган, его строение и значение Андроцей + Гинецей
Андроцей + Гинецей Физиология нервной ткани
Физиология нервной ткани Путешествие в Беловежскую пущу
Путешествие в Беловежскую пущу Строение глаза
Строение глаза Наследование дифференцированного состояния клеток. Трансгенные и химерные организмы. 10класс
Наследование дифференцированного состояния клеток. Трансгенные и химерные организмы. 10класс