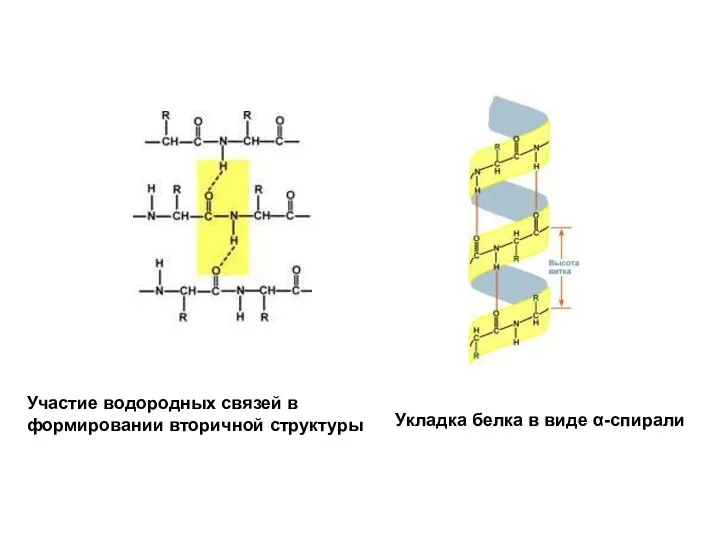
Слайд 2Участие водородных связей в формировании вторичной структуры
Укладка белка в виде α-спирали
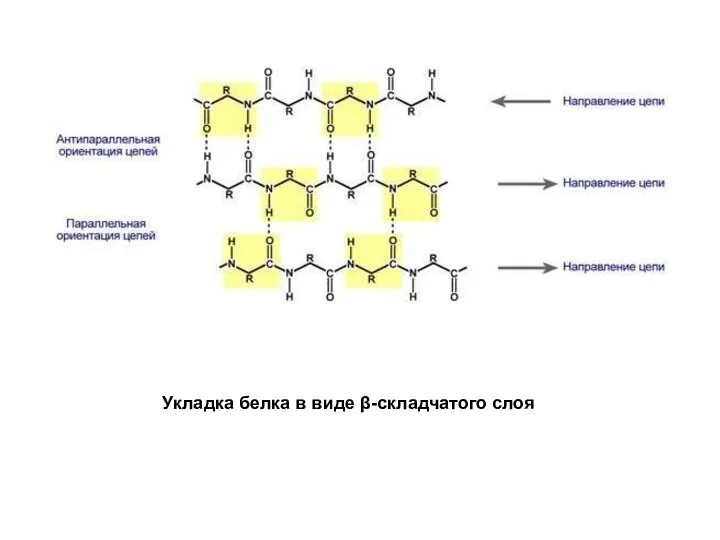
Слайд 3Укладка белка в виде β-складчатого слоя
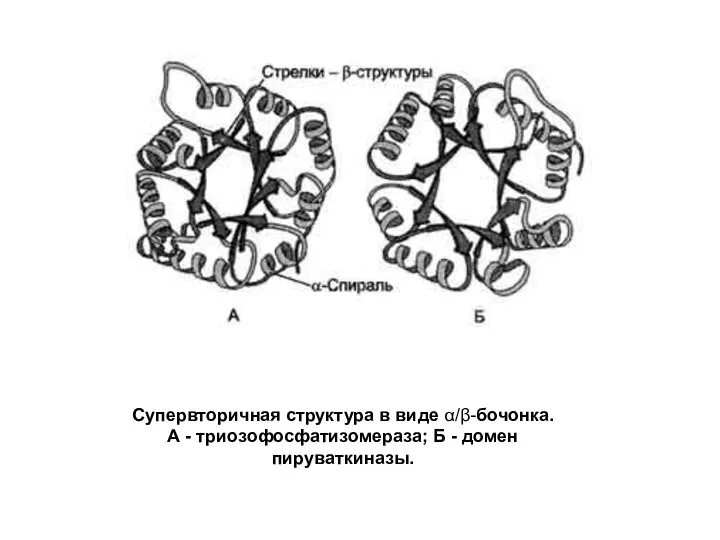
Слайд 4Супервторичная структура в виде α/β-бочонка. А - триозофосфатизомераза; Б - домен пируваткиназы.
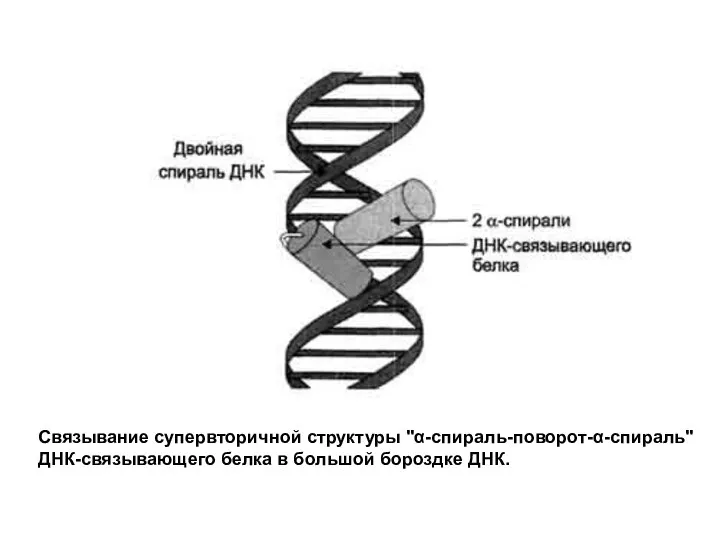
Слайд 5Связывание супервторичной структуры "α-спираль-поворот-α-спираль" ДНК-связывающего белка в большой бороздке ДНК.
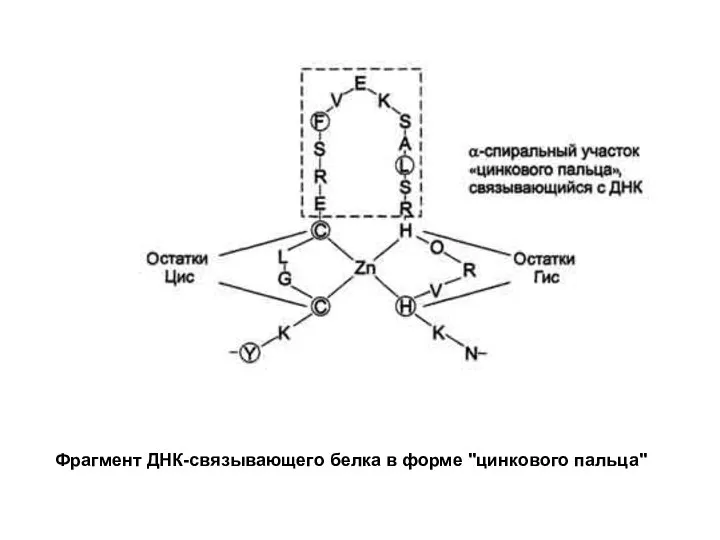
Слайд 6Фрагмент ДНК-связывающего белка в форме "цинкового пальца"
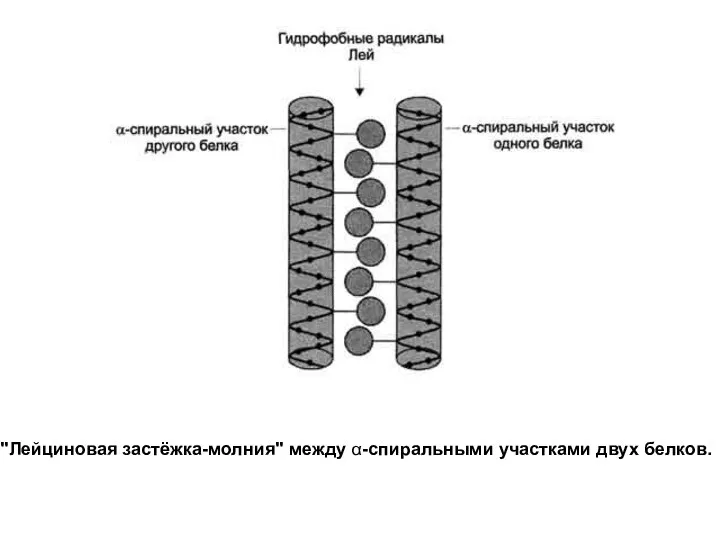
Слайд 7"Лейциновая застёжка-молния" между α-спиральными участками двух белков.
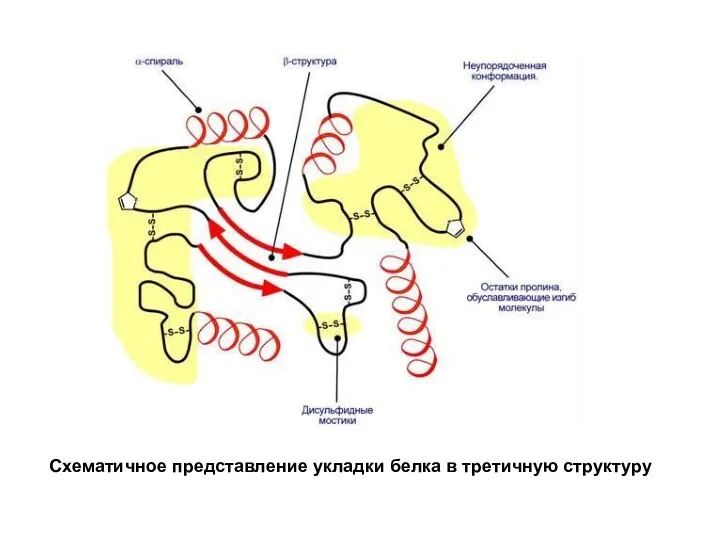
Слайд 8Схематичное представление укладки белка в третичную структуру
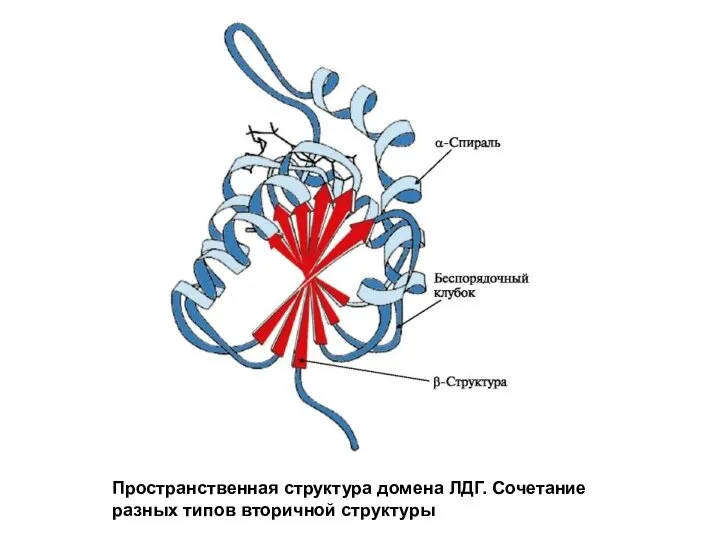
Слайд 9Пространственная структура домена ЛДГ. Сочетание разных типов вторичной структуры
Слайд 10Локализация гидрофобных и гидрофильных радикалов в молекуле белка
А - гидрофильный цитоплазматический белок;
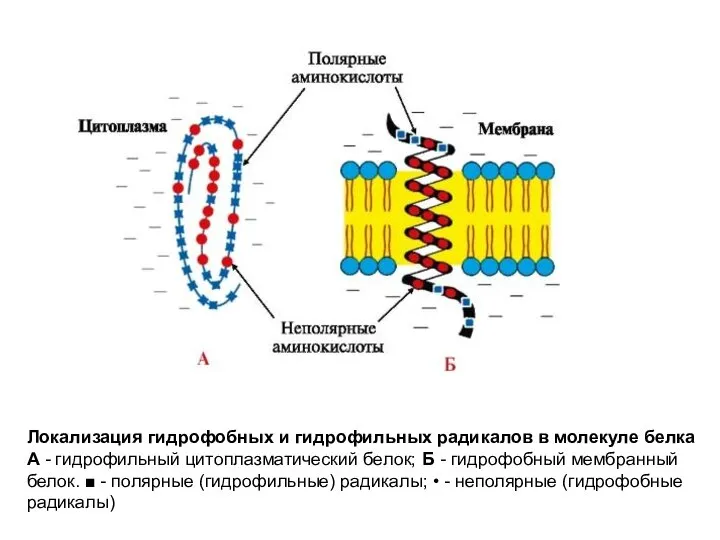
Б - гидрофобный мембранный белок. ■ - полярные (гидрофильные) радикалы; • - неполярные (гидрофобные радикалы)
Слайд 11Структурные уровни белковой молекулы
Четвертичная (IV) структура белка - пространственное взаиморасположение нескольких полипептидных
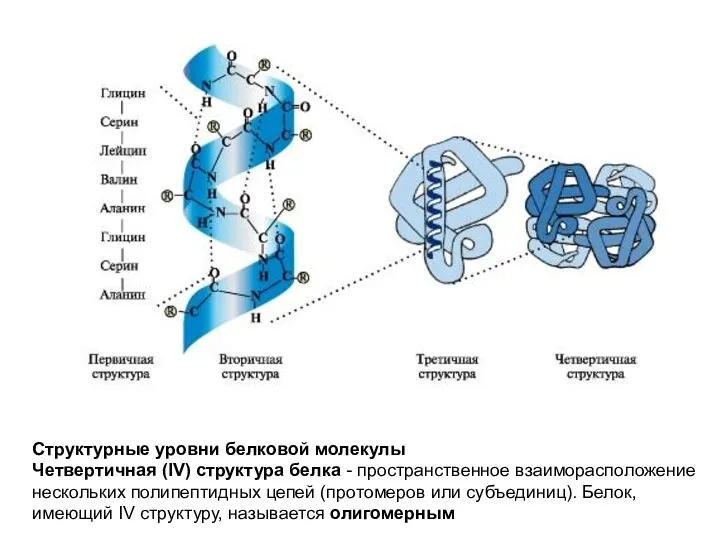
цепей (протомеров или субъединиц). Белок, имеющий IV структуру, называется олигомерным
Слайд 12Доме́н белка́ – элемент третичной структуры белка, представляющий собой достаточно стабильную и

независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. В белке домены выполняют какую-либо его функцию (например, цитоплазматический домен, трансмембранный домен и т.п.).
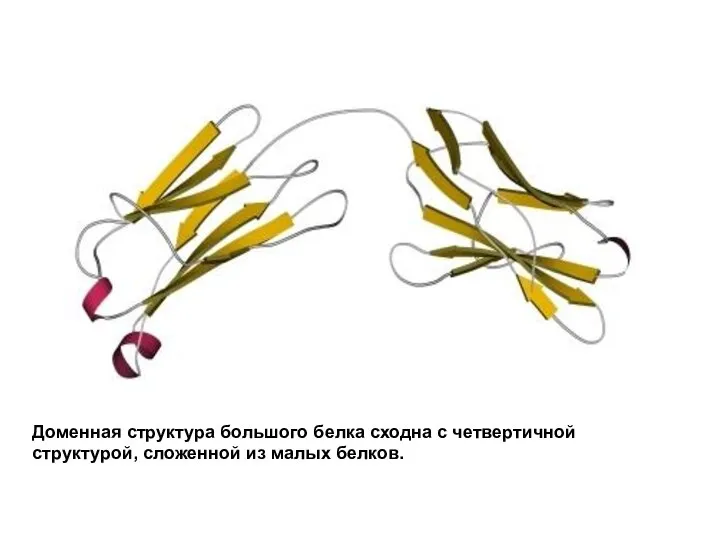
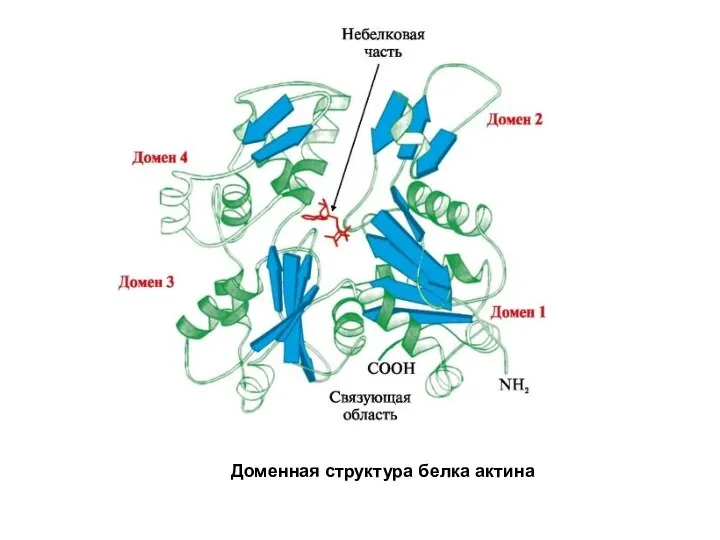
Слайд 13Доменная структура большого белка сходна с четвертичной структурой, сложенной из малых белков.
Слайд 18Заряд и растворимость альбумина (содержит много дикарбоновых аминокислот) при разных значениях рН
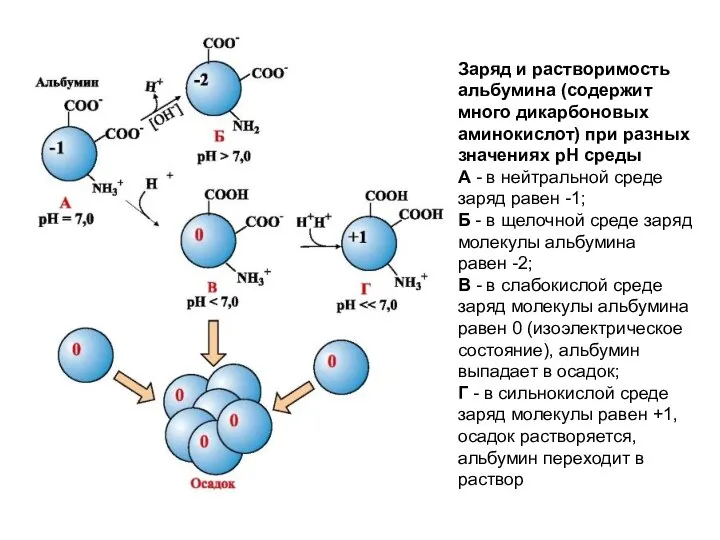
среды
А - в нейтральной среде заряд равен -1;
Б - в щелочной среде заряд молекулы альбумина
равен -2;
В - в слабокислой среде заряд молекулы альбумина равен 0 (изоэлектрическое состояние), альбумин выпадает в осадок;
Г - в сильнокислой среде заряд молекулы равен +1, осадок растворяется, альбумин переходит в раствор
Слайд 19Денатурация белковой молекулы (схема).
а - исходное состояние; б - начинающееся обратимое нарушение
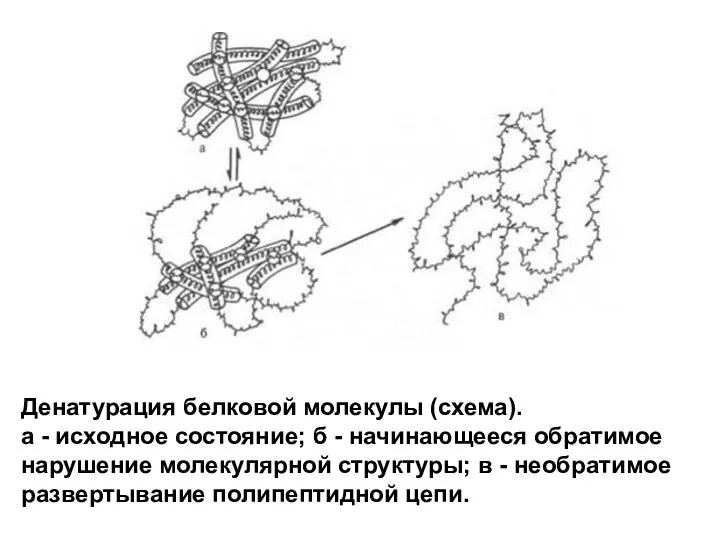
молекулярной структуры; в - необратимое развертывание полипептидной цепи.
Слайд 20Денатурация и ренативация рибонуклеазы
А - нативная молекула рибонуклеазы, в третичной структуре которой
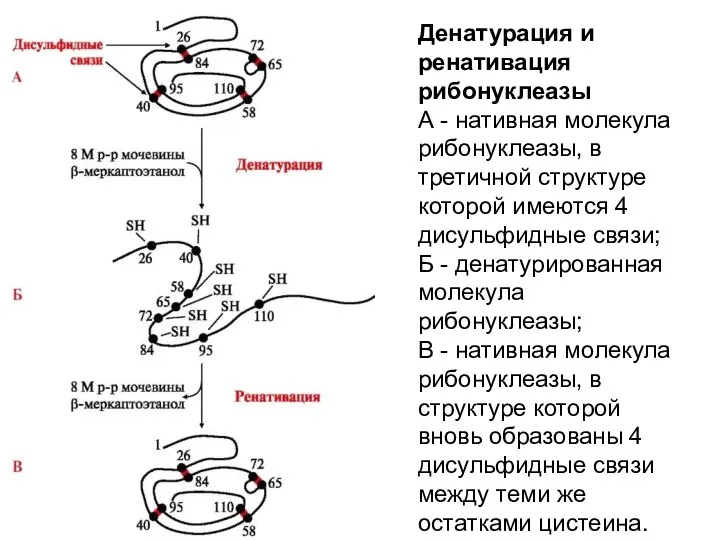
имеются 4 дисульфидные связи;
Б - денатурированная молекула рибонуклеазы;
В - нативная молекула рибонуклеазы, в структуре которой вновь образованы 4 дисульфидные связи между теми же остатками цистеина.


















 Строение тела человека (для дошкольников)
Строение тела человека (для дошкольников) Генетический анализ
Генетический анализ Медузы
Медузы Contractile Root
Contractile Root Презентация на тему Фотосинтез и Фоторедукция
Презентация на тему Фотосинтез и Фоторедукция  Хвостоног
Хвостоног Хищные млекопитающие. Часть 3. Семейство псовые (собачьи)
Хищные млекопитающие. Часть 3. Семейство псовые (собачьи) Защита растений в ландшафте
Защита растений в ландшафте Систематика живого мира
Систематика живого мира Les Éléphantidés
Les Éléphantidés Орех грецкий
Орех грецкий Презентация на тему Особенности строения и жизнедеятельности рыб
Презентация на тему Особенности строения и жизнедеятельности рыб  Методы исследования генетики человека (число и тема в тетрадь)
Методы исследования генетики человека (число и тема в тетрадь) Домашние птицы
Домашние птицы Презентация на тему Этапы формирования жизни на Земле
Презентация на тему Этапы формирования жизни на Земле  Prezentatsia_2
Prezentatsia_2 Исторический аспект возникновения экосистемы
Исторический аспект возникновения экосистемы Подцарство Одноклеточные
Подцарство Одноклеточные Кровь и кровеносная система человека
Кровь и кровеносная система человека Растение кирказон
Растение кирказон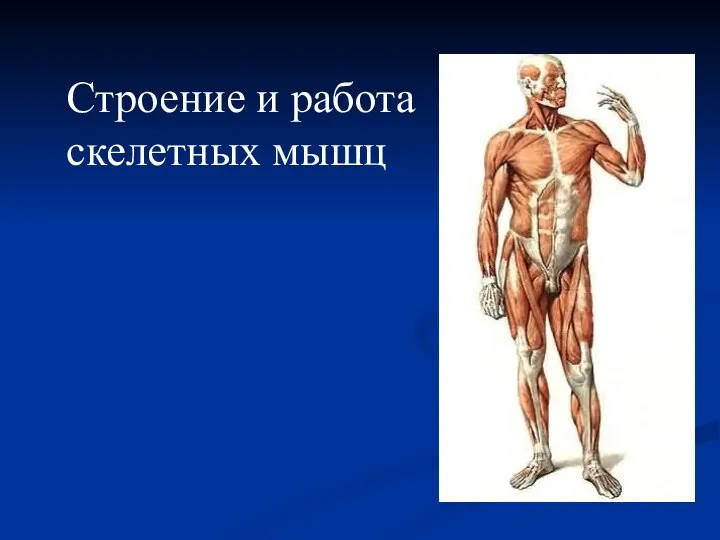 Строение и работа скелетных мышц
Строение и работа скелетных мышц Обобщающий урок по теме Класс Птицы в 7 классе
Обобщающий урок по теме Класс Птицы в 7 классе Регулирующие системы организма и их взаимодействие
Регулирующие системы организма и их взаимодействие Органические вещества клеток: углеводы, липиды, жиры, воска
Органические вещества клеток: углеводы, липиды, жиры, воска 9.1А –Био.молекулы. (Мол.био.)Углеводы
9.1А –Био.молекулы. (Мол.био.)Углеводы Многообразие грибов
Многообразие грибов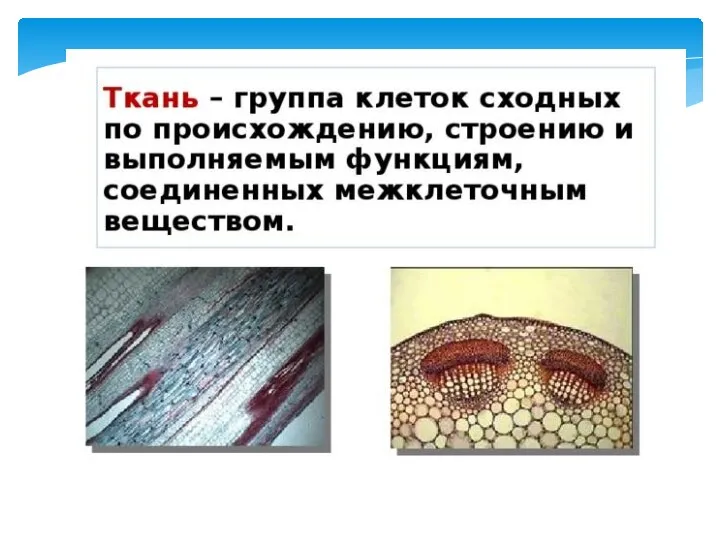 Ткани
Ткани Николай Коперник. Астроном
Николай Коперник. Астроном