Содержание
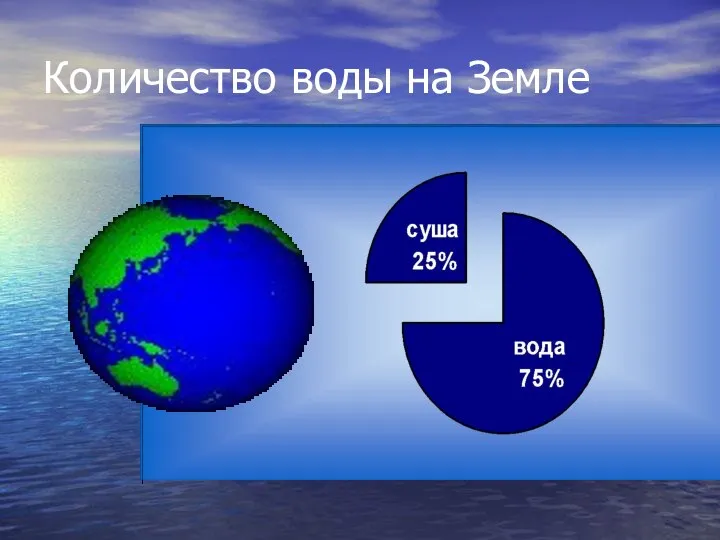
- 2. Количество воды на Земле
- 3. Состав гидросферы
- 4. Количество необходимой воды в современном производстве поистине колоссально: для изготовления 1 т кирпича надо израсходовать 1
- 5. Потребность сельского хозяйства в воде: 1 т урожая пшеницы поглощает 1500 т воды, риса – 4000
- 6. Формула воды Н2О Француз Антуан Лоран Лавуазье впервые доказал, что вода – сложное вещество, пропустив водяные
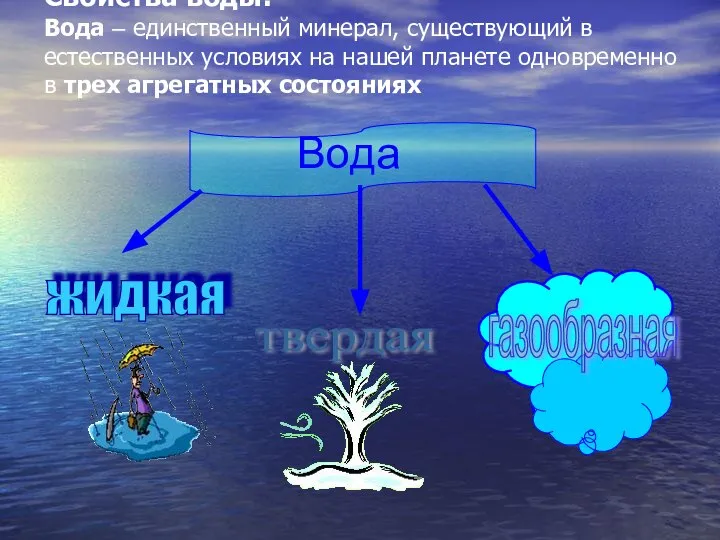
- 7. Свойства воды: Вода – единственный минерал, существующий в естественных условиях на нашей планете одновременно в трех
- 8. Вода прозрачна Бесцветна Без запаха Без вкуса (дистиллированная вода имеет горьковатый вкус) Дистиллированная вода не проводит
- 9. Вода обладает текучестью. Способна постоянно менять форму, принимая форму сосуда
- 10. Температура кипения воды-100°С (373 К) Температура замерзания (плавления) воды-0°С
- 11. Это интересно Вода является стандартом для определения некоторых физических величин: 1градус- сотая доля промежутка между температурами
- 12. Но оказывается у воды много необычных свойств (аномалий), которые не подчиняются общим закономерностям Аномалия 1. t°C
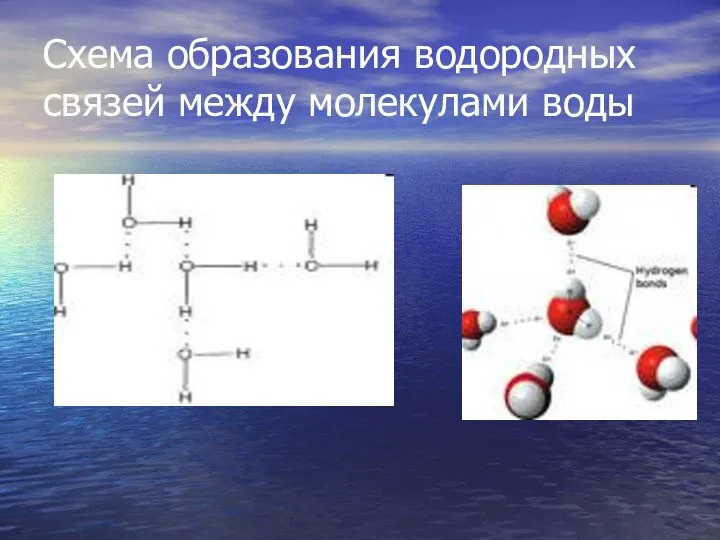
- 13. Схема образования водородных связей между молекулами воды
- 14. Аномалия 2. Известно, что при охлаждении вещества сжимаются, и только вода расширяется! Бутылка с водой, лопнувшая
- 15. Объем льда больше объема жидкой воды. Этот факт играет важную роль в процессе разрушения (выветривания) горных
- 16. Плотность льда меньше плотности жидкой воды, поэтому лед не опускается на дно и даже в сильные
- 17. Аномалия 3. Наличие водородных связей между молекулами воды затрудняет процесс ее испарения, поэтому вода обладает самой
- 18. Аномалия 4. Вода обладает высокой удельной теплоемкостью: в 4 раза больше, чем у горных пород и
- 19. Аномалия 5. Вода обладает самым высоким поверхностным натяжением из всех жидкостей, после ртути. Поверхность воды всегда
- 20. Жизнь многих насекомых связана с поверхностной пленкой: ВОДОМЕРКИ ЖИВУТ ТОЛЬКО НА ПОВЕРХНОСТИ ВОДЫ, НИКОГДА В НЕЕ
- 21. Аномалия 6. Вода -универсальный растворитель. Вода – самое распространенное вещество на Земле, но в то же
- 22. Морскую воду часто называют соленой. Под соленостью морской воды понимают массу (в граммах) сухих солей в
- 23. Минеральная вода содержит большое количество растворенных веществ и имеет целебные свойства Гидрокарбонатные воды снижают кислотность желудочного
- 24. Вода – среда и участник большинства химических процессов: Взаимодействует с активными металлами 2Na+2H2O→2NaOH+H2↑ Взаимодействует с некоторыми
- 25. Взаимодействует с основными оксидами с образованием щелочей СаО+Н2О→Са(ОН)2 Взаимодействует с кислотными оксидами (кроме SiO2) с образованием
- 26. Образует соединения – кристаллогидраты со многими веществами 5H2O+CuSO4→CuSO4x5H2O Вступает в реакции гидролитического разложения. Особенно эти реакции
- 28. Скачать презентацию






















 Дома, которые строят птицы
Дома, которые строят птицы Цепи питания
Цепи питания Предмет биологического краеведения. Исторический обзор
Предмет биологического краеведения. Исторический обзор Свойства биосферы
Свойства биосферы Питание бактерий и грибов
Питание бактерий и грибов Витамины. Классификация
Витамины. Классификация Para qué son Estes partes de cuerpo humano
Para qué son Estes partes de cuerpo humano Внешнее строение листа. Жилкование
Внешнее строение листа. Жилкование Волокнистые соединительные ткани. Контрольная диагностика
Волокнистые соединительные ткани. Контрольная диагностика Методы биоэкологии
Методы биоэкологии Презентация на тему Витамины 10 класс
Презентация на тему Витамины 10 класс 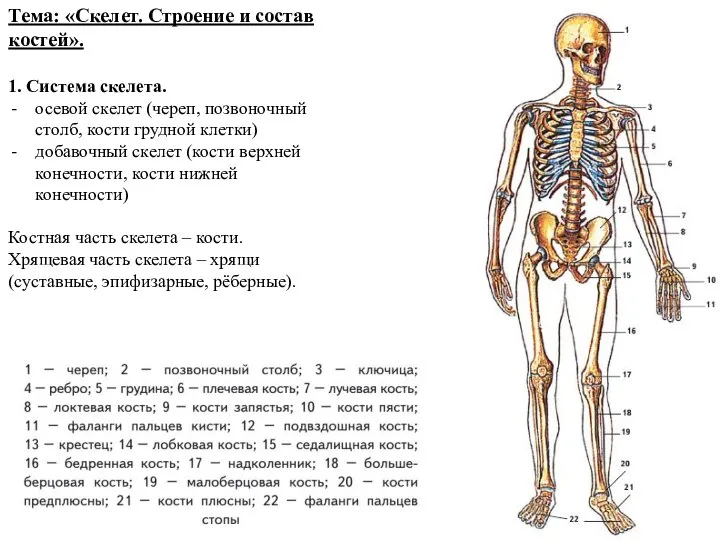 Скелет. Строение и состав костей
Скелет. Строение и состав костей Способы размножения ( 6 класс)
Способы размножения ( 6 класс) Регулятор позвоночного столба (РПС)
Регулятор позвоночного столба (РПС)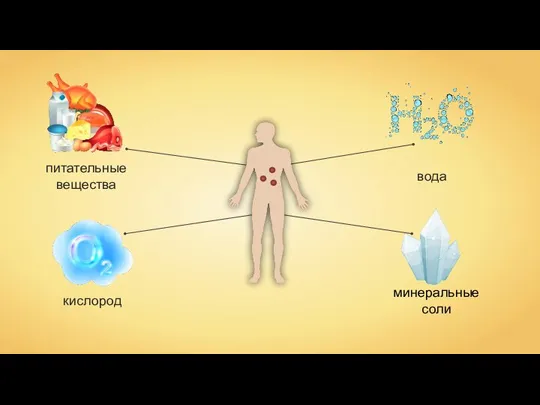 Пластический и энергетический обмен
Пластический и энергетический обмен Зрительный анализатор
Зрительный анализатор Глисты. Симптомы
Глисты. Симптомы Неклеточные формы жизни: вирусы
Неклеточные формы жизни: вирусы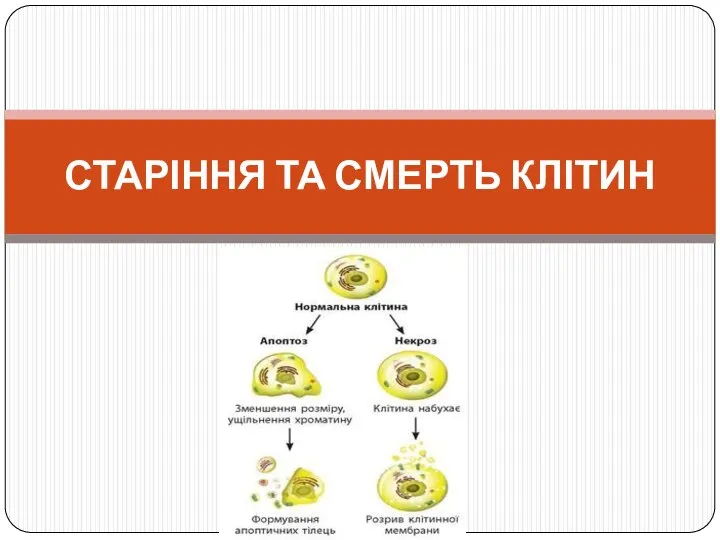 Старіння та смерть клітин
Старіння та смерть клітин Общая анатомия растений. Часть 4
Общая анатомия растений. Часть 4 Дыхательная система
Дыхательная система Шистосомоз. Географическое распространение
Шистосомоз. Географическое распространение Органы слуха у рыб: внутреннее ухо и боковая линия
Органы слуха у рыб: внутреннее ухо и боковая линия Анализаторы. Проверочная работа
Анализаторы. Проверочная работа Развитие насекомых
Развитие насекомых Введение в обмен веществ
Введение в обмен веществ Biological factors
Biological factors Презентация на тему Изучение химической природы кислорода, углекислого газа и гемоглобина
Презентация на тему Изучение химической природы кислорода, углекислого газа и гемоглобина