Содержание
- 2. ДАВЛЕНИЕ ГАЗА — сила, с которой давит газ, стремясь к расширению под действием теплового движения его
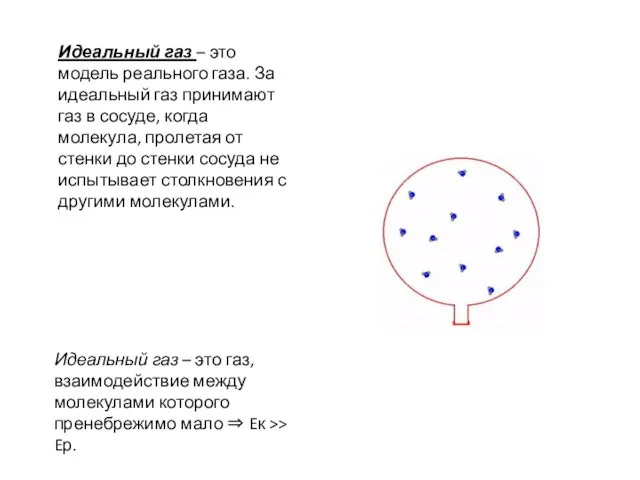
- 3. Идеальный газ – это модель реального газа. За идеальный газ принимают газ в сосуде, когда молекула,
- 4. Основное уравнение МКТ связывает макроскопические параметры (давление p, объём V, температура T, масса m) газовой системы
- 5. Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, объёмом и абсолютной температурой идеального газа,
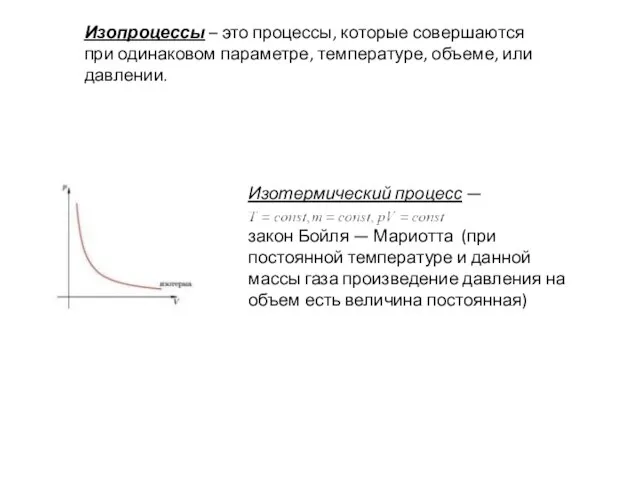
- 6. Изопроцессы – это процессы, которые совершаются при одинаковом параметре, температуре, объеме, или давлении. Изотермический процесс —
- 7. Изобарный процесс — — закон Гей-Люссака (при постоянном давлении для данной массы газа отношение объема к
- 8. Вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были
- 9. Источники: http://kaplio.ru/davlenie-gaza-uravnenie-mendeleeva-klapejrona-izoprotsessy/ https://studopedia.ru/9_73036_davlenie-gaza-uravnenie-sostoyaniya-idealnogo-gaza-uravnenie-mendeleeva-klapeyrona-izoprotsessi.html
- 11. Скачать презентацию






 Хронология проведения испытаний на четвертом энергоблоке ЧАЭС
Хронология проведения испытаний на четвертом энергоблоке ЧАЭС Поршневые компрессоры. Лекция №6
Поршневые компрессоры. Лекция №6 Презентация на тему Электромагнитное поле
Презентация на тему Электромагнитное поле  Определение показателя преломления стекла
Определение показателя преломления стекла Основы молекулярнокинетической теории газов. Тест
Основы молекулярнокинетической теории газов. Тест Методические указания к выполнению отчета по лабораторным работам
Методические указания к выполнению отчета по лабораторным работам Отчёт по учебной практике. Выполнение работ по профессии машинист холодильных установок
Отчёт по учебной практике. Выполнение работ по профессии машинист холодильных установок Давление. Задачи
Давление. Задачи Основы термодинамики. Тема № 4
Основы термодинамики. Тема № 4 Презентация на тему Инфракрасное и ультрафиолетовое излучения
Презентация на тему Инфракрасное и ультрафиолетовое излучения  Свойство волн
Свойство волн 6
6 Изобретение радио. Принципы радиосвязи
Изобретение радио. Принципы радиосвязи Физические задачи с литературным содержанием
Физические задачи с литературным содержанием Цепи периодического несинусоидального тока
Цепи периодического несинусоидального тока Основные понятия и задачи кинематики (продолжение)
Основные понятия и задачи кинематики (продолжение) Плотность. Способы измерения плотности
Плотность. Способы измерения плотности Исследовательская работа по физике
Исследовательская работа по физике Фазовые переходы. Термодинамика ТМП (Термоупругие мартенситные превращения)
Фазовые переходы. Термодинамика ТМП (Термоупругие мартенситные превращения) Зависимость спектральной плотности интенсивности излучения от частоты
Зависимость спектральной плотности интенсивности излучения от частоты Лекция № 8. Антенны классификация и основные виды антенн
Лекция № 8. Антенны классификация и основные виды антенн Осциллограф. Классификация
Осциллограф. Классификация Презентация на тему Выяснение условия равновесия рычага
Презентация на тему Выяснение условия равновесия рычага  Җылылык күренешләре
Җылылык күренешләре Определение проницаемости
Определение проницаемости Радиоактивность. Виды радиоактивного облучения
Радиоактивность. Виды радиоактивного облучения Аккумуляторная батарея
Аккумуляторная батарея «Своя игра» по Физике Автор Skyfury Sparkle
«Своя игра» по Физике Автор Skyfury Sparkle