Содержание
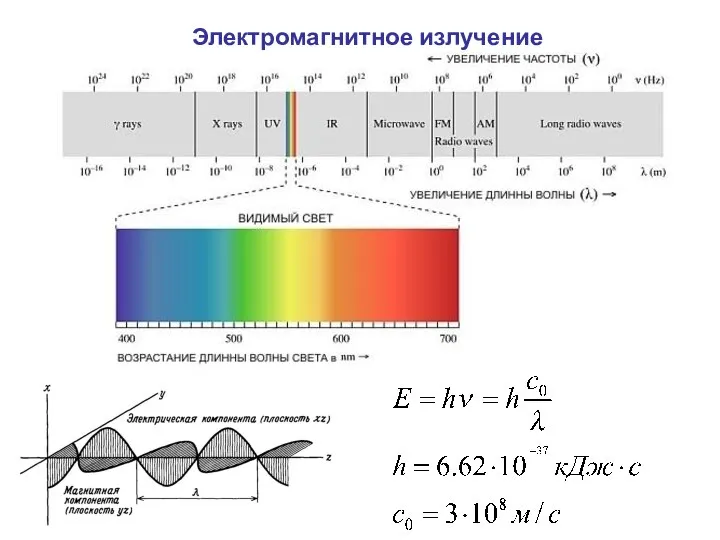
- 2. Электромагнитное излучение
- 3. Виды молекулярной спектроскопии
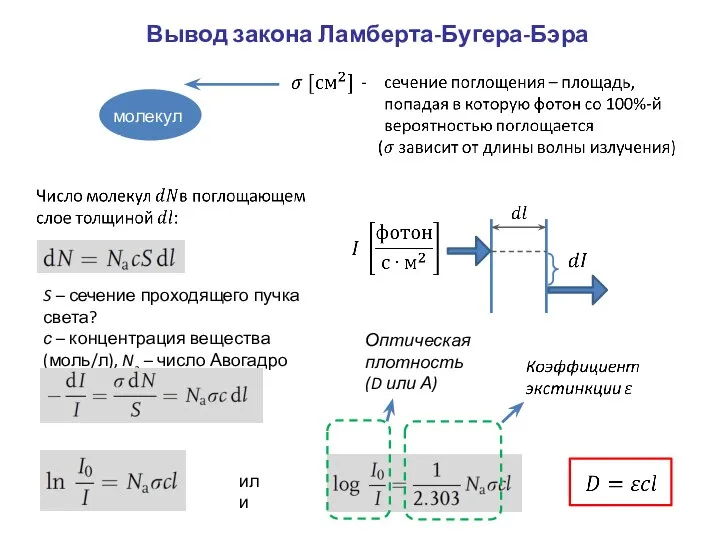
- 4. Вывод закона Ламберта-Бугера-Бэра молекула или Оптическая плотность (D или А)
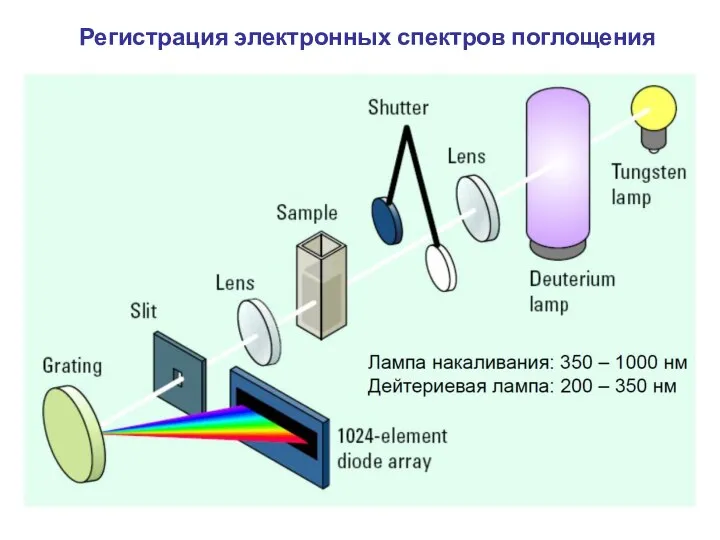
- 5. Регистрация электронных спектров поглощения
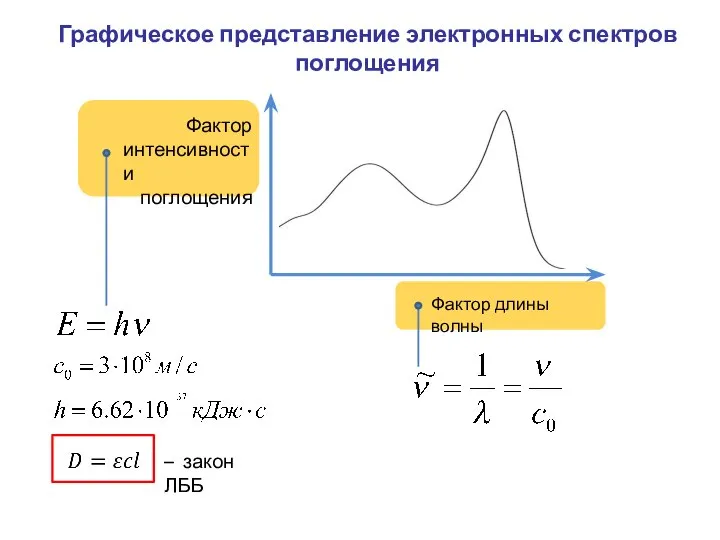
- 6. Фактор интенсивности поглощения Фактор длины волны Графическое представление электронных спектров поглощения
- 7. M ~100 г/моль ε ~ 10000 l = 1 см А = 0.3 – 0.9 Концентрация
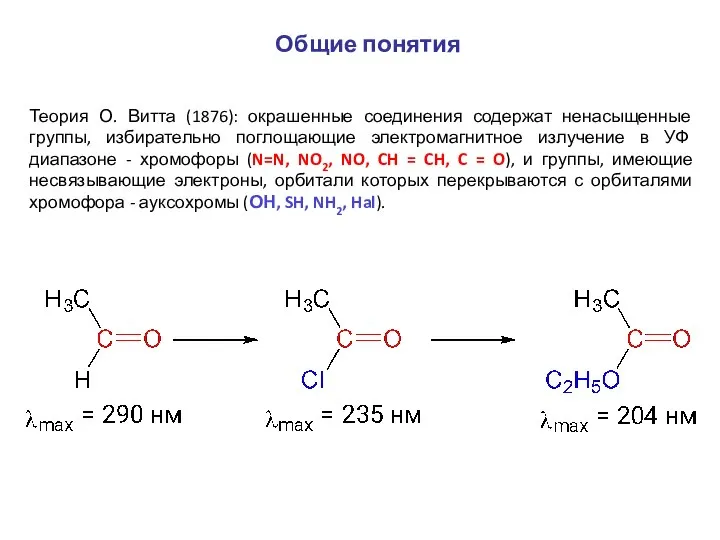
- 8. Общие понятия Теория О. Витта (1876): окрашенные соединения содержат ненасыщенные группы, избирательно поглощающие электромагнитное излучение в
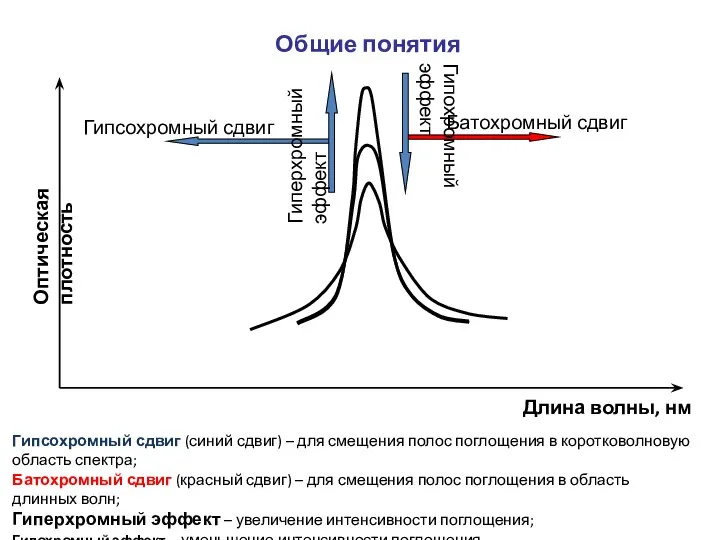
- 9. Гипсохромный сдвиг Батохромный сдвиг Гиперхромный эффект Гипохромный эффект Длина волны, нм Оптическая плотность Гипсохромный сдвиг (синий
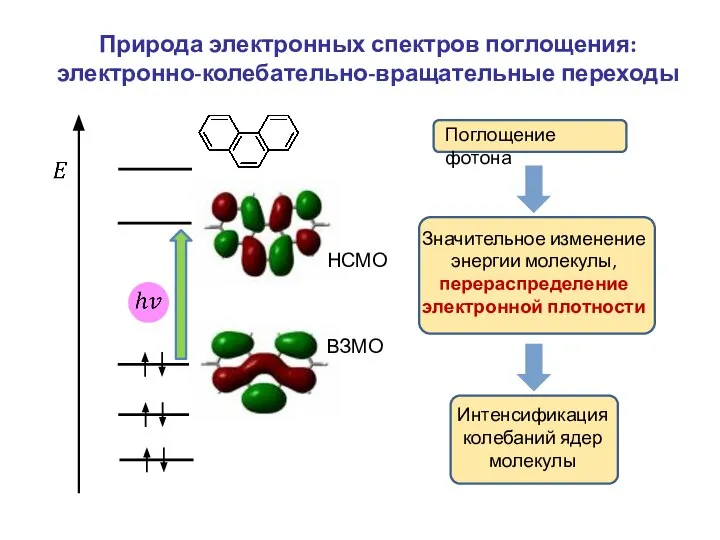
- 10. Природа электронных спектров поглощения: электронно-колебательно-вращательные переходы ВЗМО НСМО Поглощение фотона Значительное изменение энергии молекулы, перераспределение электронной
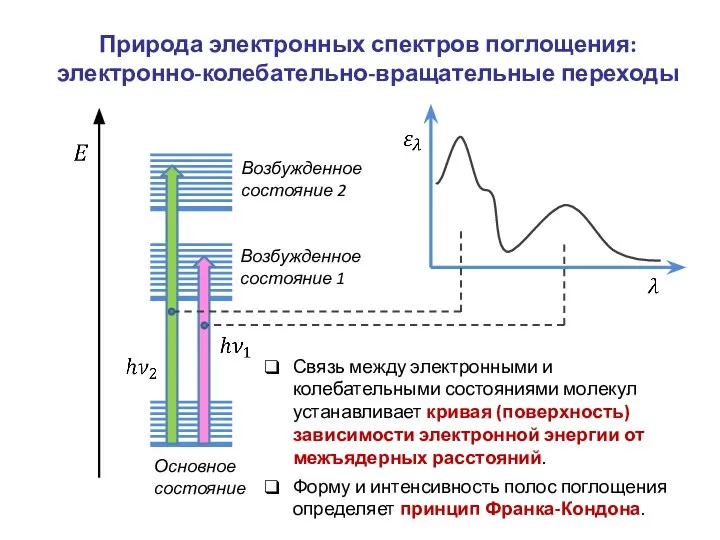
- 11. Природа электронных спектров поглощения: электронно-колебательно-вращательные переходы Основное состояние Возбужденное состояние 1 Возбужденное состояние 2 Связь между
- 12. Конфигурация электронно-колебательных уровней двухатомной молекулы
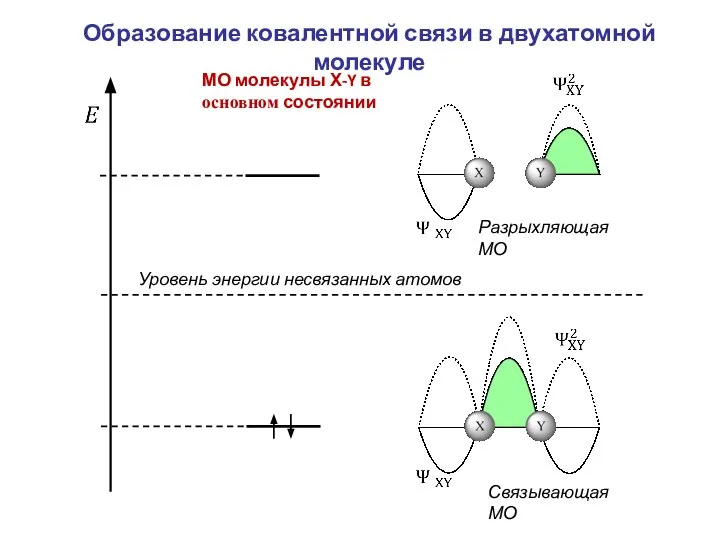
- 13. Связывающая МО Разрыхляющая МО Уровень энергии несвязанных атомов Образование ковалентной связи в двухатомной молекуле МО молекулы
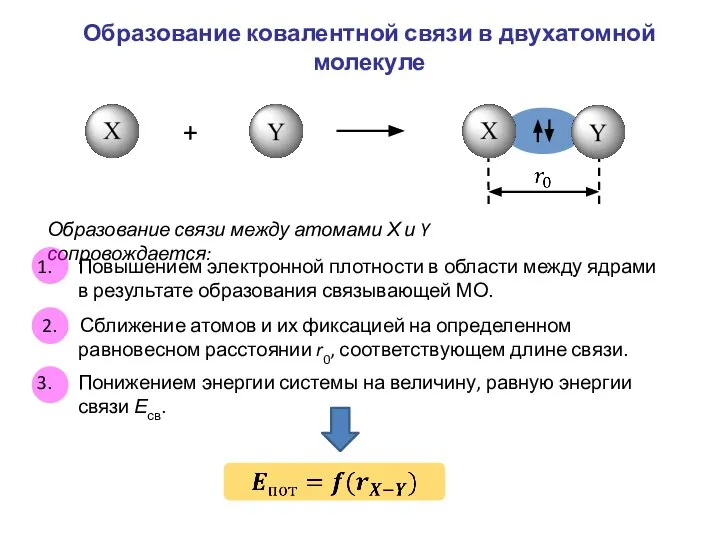
- 14. + Образование связи между атомами Х и Y сопровождается: Повышением электронной плотности в области между ядрами
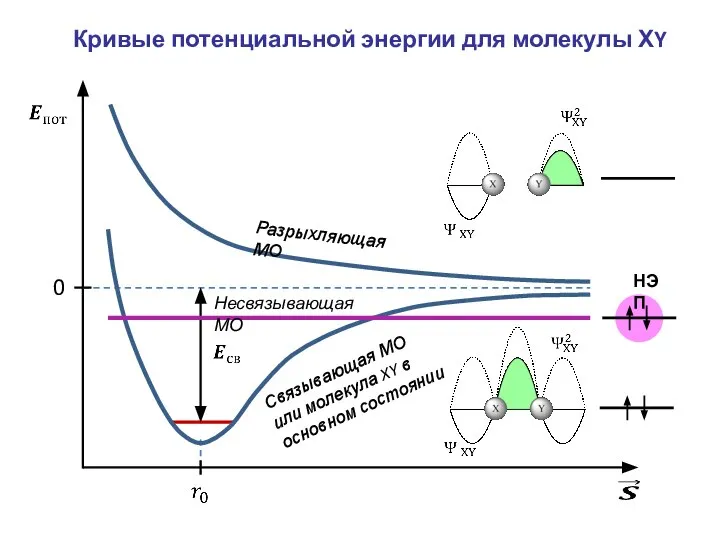
- 15. Кривые потенциальной энергии для молекулы ХY Связывающая МО или молекула XY в основном состоянии Разрыхляющая МО
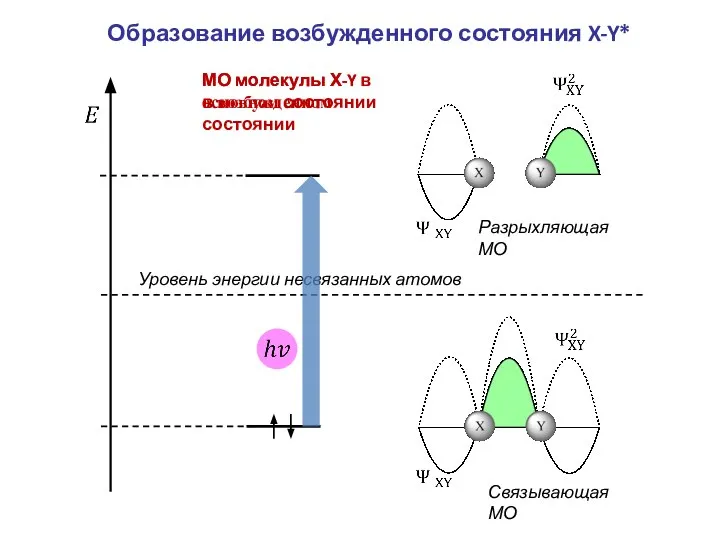
- 16. Связывающая МО Разрыхляющая МО Уровень энергии несвязанных атомов Образование возбужденного состояния X-Y* МО молекулы Х-Y в
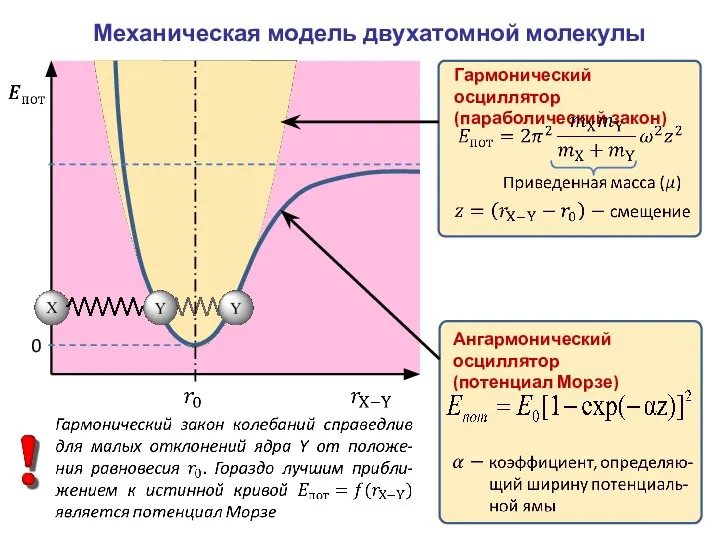
- 17. Механическая модель двухатомной молекулы 0 Гармонический осциллятор (параболический закон) Ангармонический осциллятор (потенциал Морзе)
- 18. Квантово-механическая модель двухатомной молекулы Потенциал Морзе Уравнение Шредингера для одномерного осциллятора: Результат решения (Уравнение Морзе):
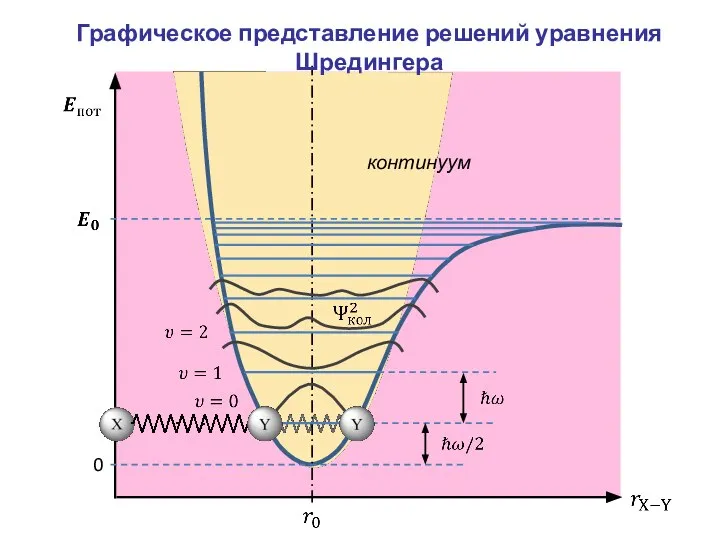
- 19. Графическое представление решений уравнения Шредингера
- 20. Принцип Франка-Кондона и форма полос поглощения в электронных спектрах
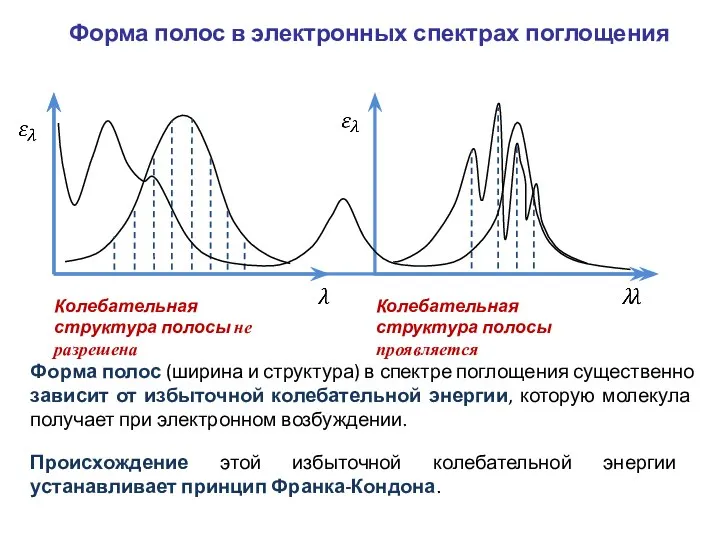
- 21. Форма полос в электронных спектрах поглощения Форма полос (ширина и структура) в спектре поглощения существенно зависит
- 22. Принцип Франка-Кондона Если процессы фотовозбуждения изображать как переход с одной потенциальной кривой на другую, то принцип
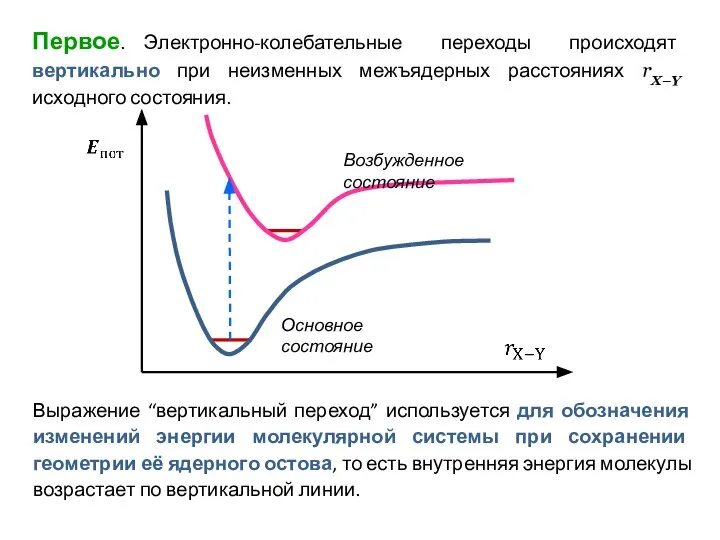
- 23. Первое. Электронно-колебательные переходы происходят вертикально при неизменных межъядерных расстояниях rX–Y исходного состояния. Выражение “вертикальный переход” используется
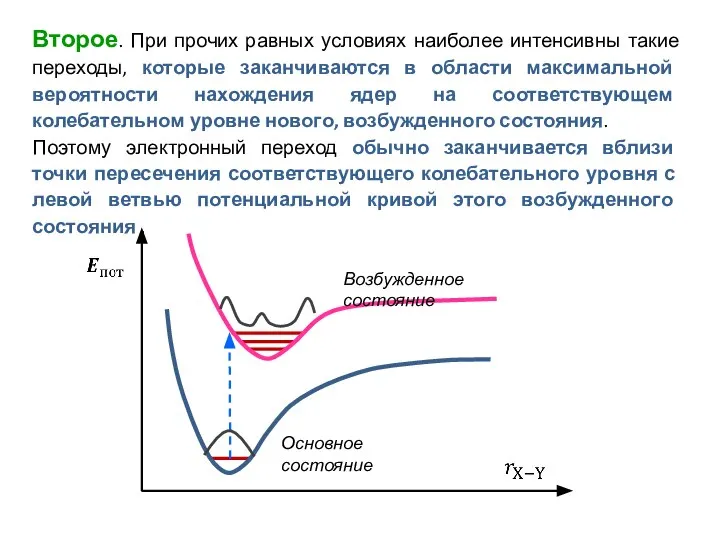
- 24. Второе. При прочих равных условиях наиболее интенсивны такие переходы, которые заканчиваются в области максимальной вероятности нахождения
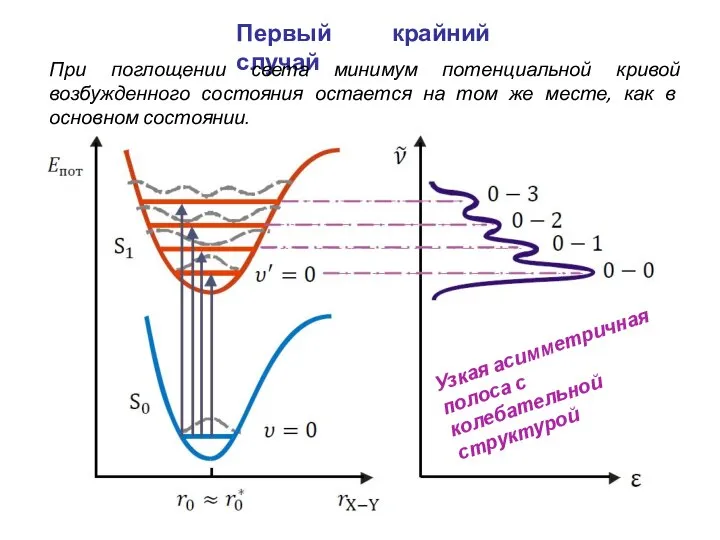
- 25. Первый крайний случай Узкая асимметричная полоса с колебательной структурой При поглощении света минимум потенциальной кривой возбужденного
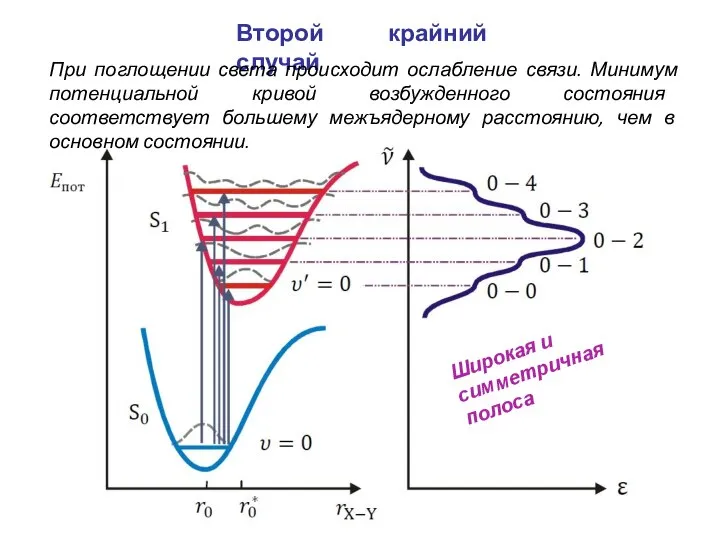
- 26. Широкая и симметричная полоса Второй крайний случай При поглощении света происходит ослабление связи. Минимум потенциальной кривой
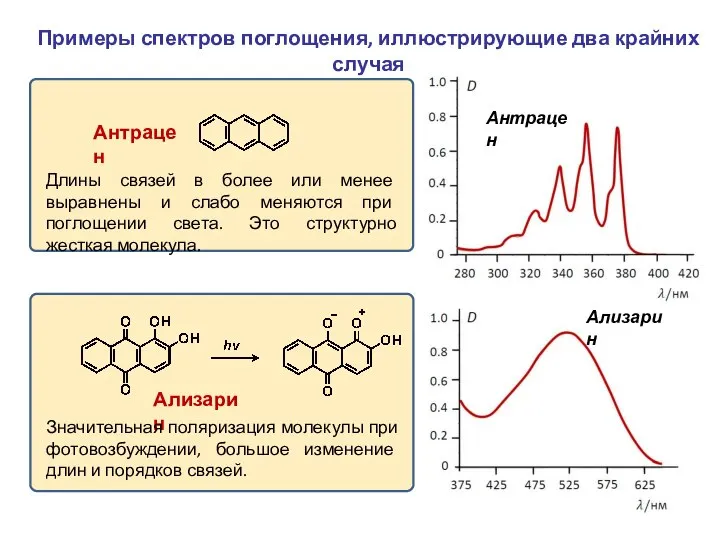
- 27. Примеры спектров поглощения, иллюстрирующие два крайних случая
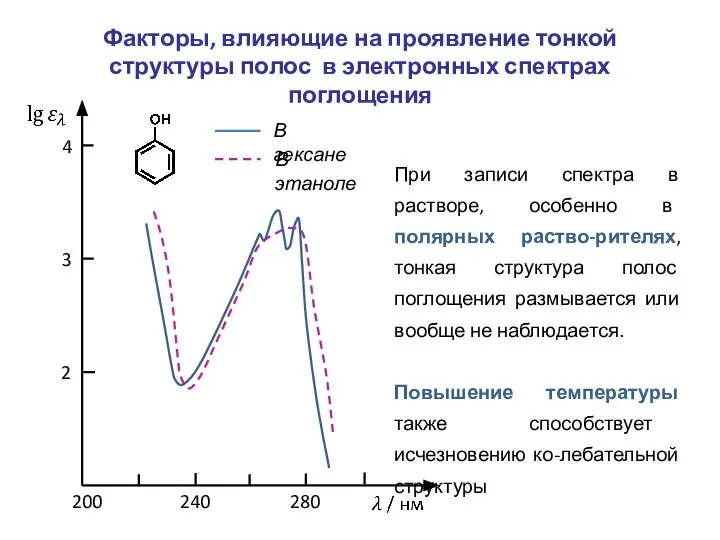
- 28. Факторы, влияющие на проявление тонкой структуры полос в электронных спектрах поглощения В гексане В этаноле При
- 29. Формирование МО и основные типы электронных переходов
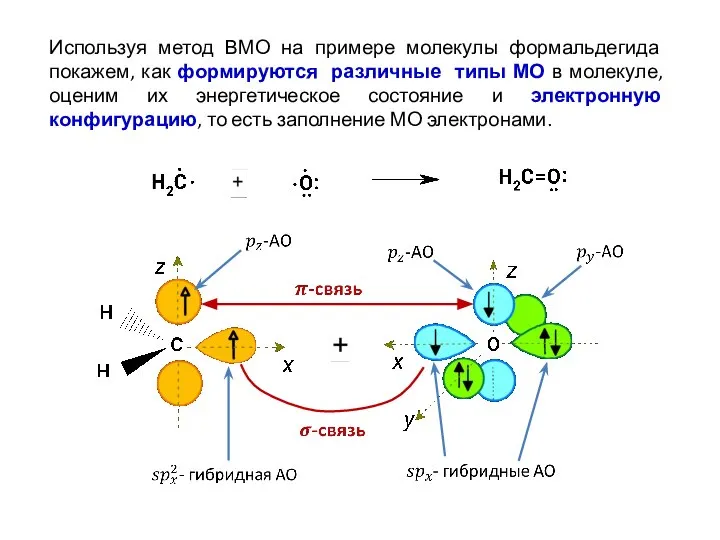
- 30. Используя метод ВМО на примере молекулы формальдегида покажем, как формируются различные типы МО в молекуле, оценим
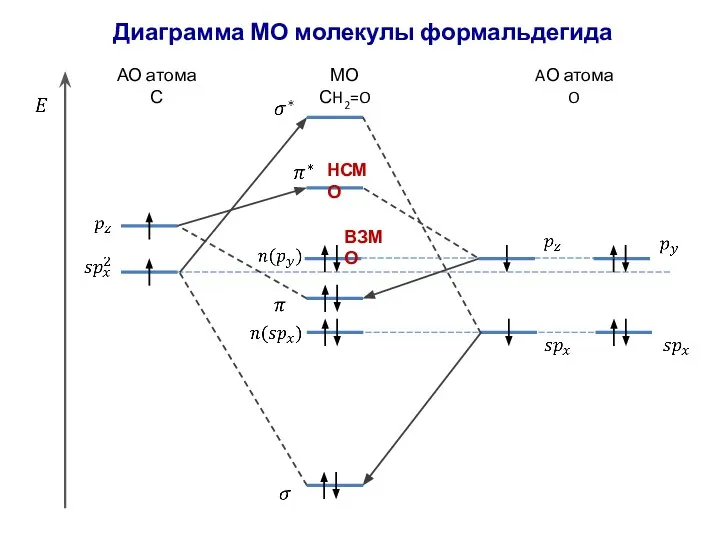
- 31. Диаграмма МО молекулы формальдегида АО атома С AО атома O МО СH2=O ВЗМО НСМО
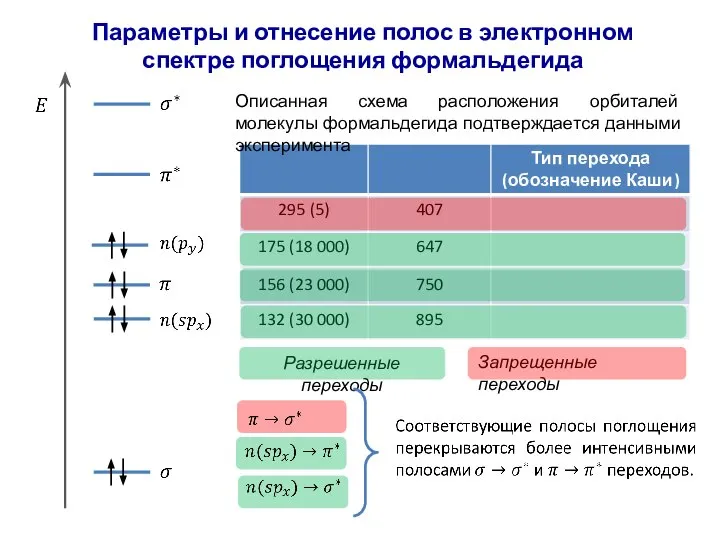
- 32. Параметры и отнесение полос в электронном спектре поглощения формальдегида Описанная схема расположения орбиталей молекулы формальдегида подтверждается
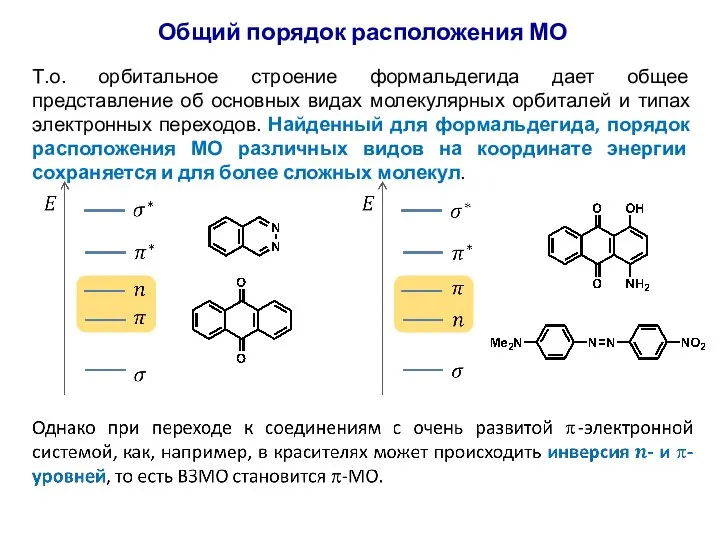
- 33. Общий порядок расположения МО Т.о. орбитальное строение формальдегида дает общее представление об основных видах молекулярных орбиталей
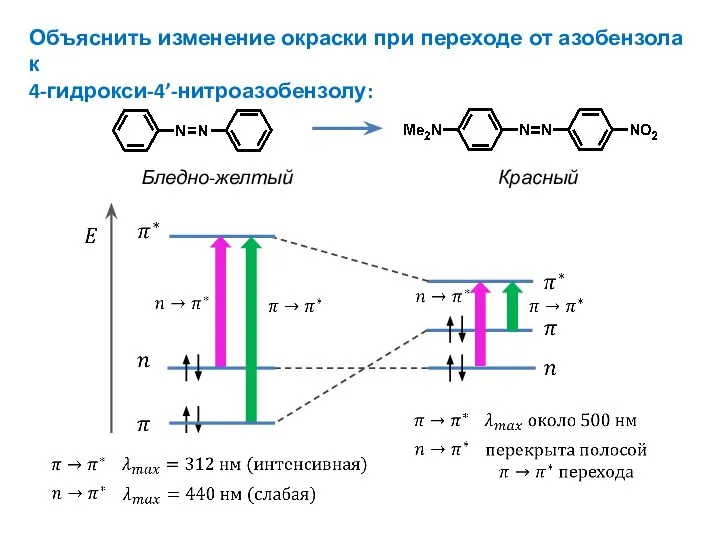
- 34. Бледно-желтый Красный Объяснить изменение окраски при переходе от азобензола к 4-гидрокси-4’-нитроазобензолу:
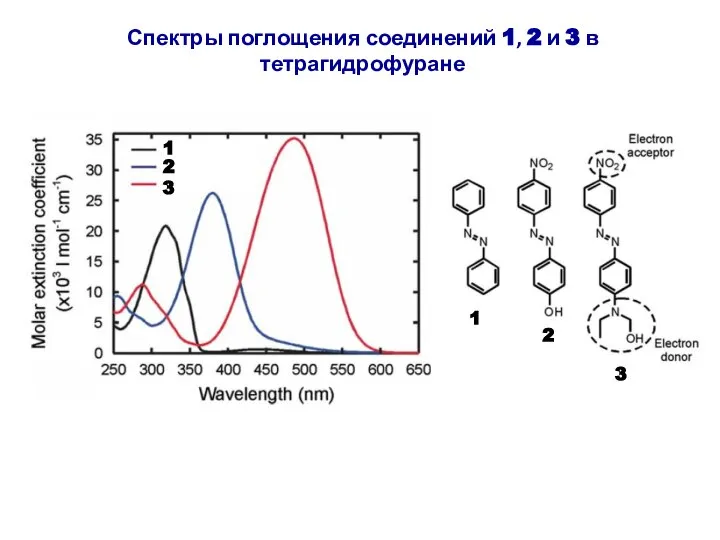
- 35. 1 2 3 1 2 3 Спектры поглощения соединений 1, 2 и 3 в тетрагидрофуране
- 36. Электронные конфигурации и электронные состояния
- 37. Электронная конфигурация – распределение электронов по орбиталям в системе Электронное состояние – те свойства системы, которые
- 38. Спин электрона
- 39. Спиновые характеристики многоэлектронной системы Для данной электронной конфигурации:
- 40. Система с замкнутой электронной оболочкой Система с незамкнутой электронной оболочкой (радикал, ион-радикал) Синглетное состояние (обозначается S)
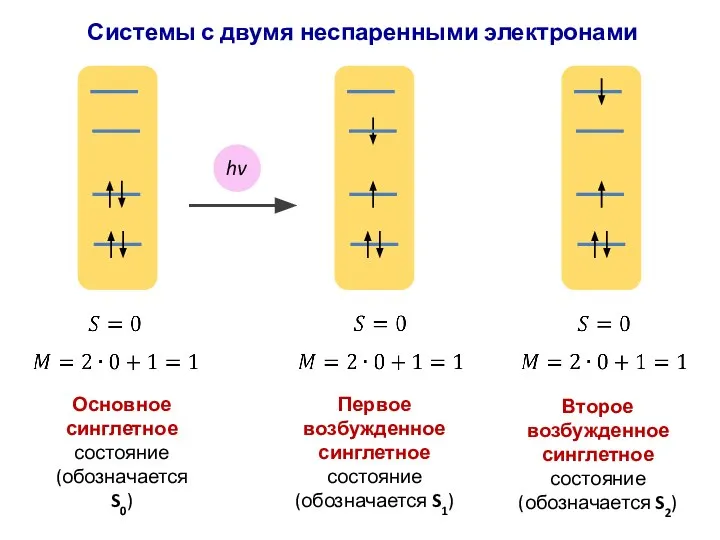
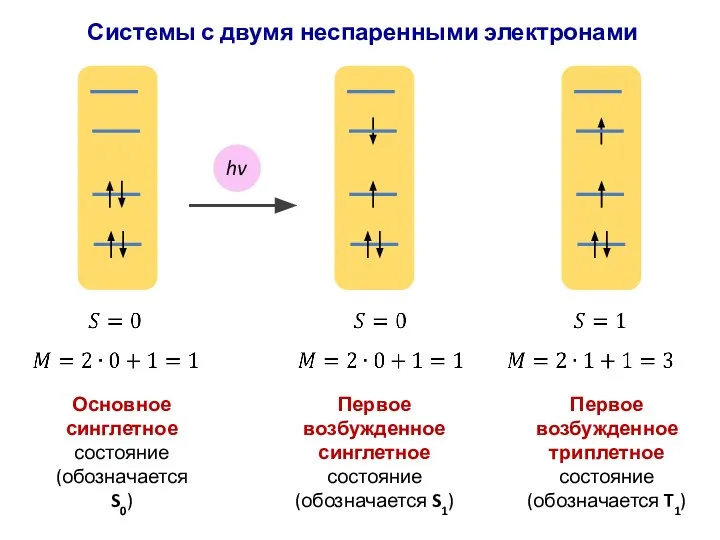
- 41. Основное синглетное состояние (обозначается S0) hv Первое возбужденное синглетное состояние (обозначается S1) Системы с двумя неспаренными
- 42. Основное синглетное состояние (обозначается S0) hv Первое возбужденное синглетное состояние (обозначается S1) Первое возбужденное триплетное состояние
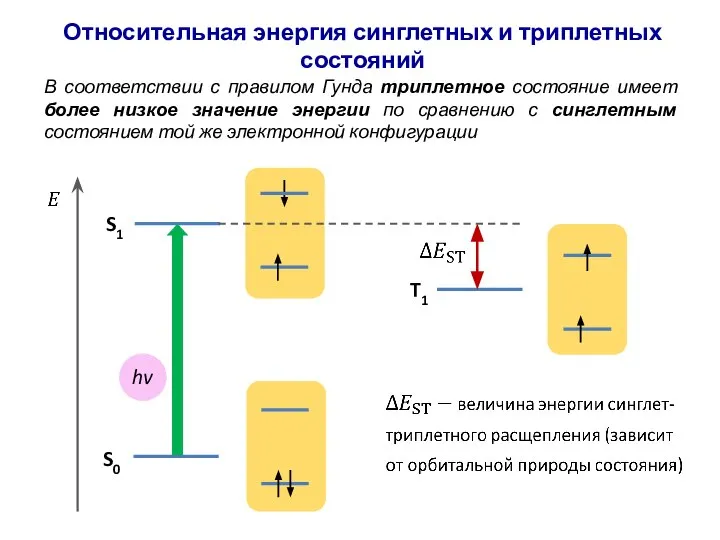
- 43. В соответствии с правилом Гунда триплетное состояние имеет более низкое значение энергии по сравнению с синглетным
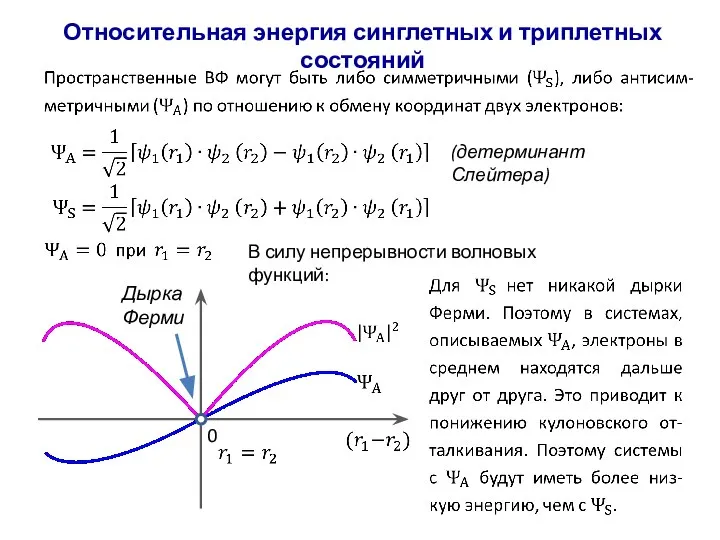
- 44. Относительная энергия синглетных и триплетных состояний В силу непрерывности волновых функций: 0 Дырка Ферми (детерминант Слейтера)
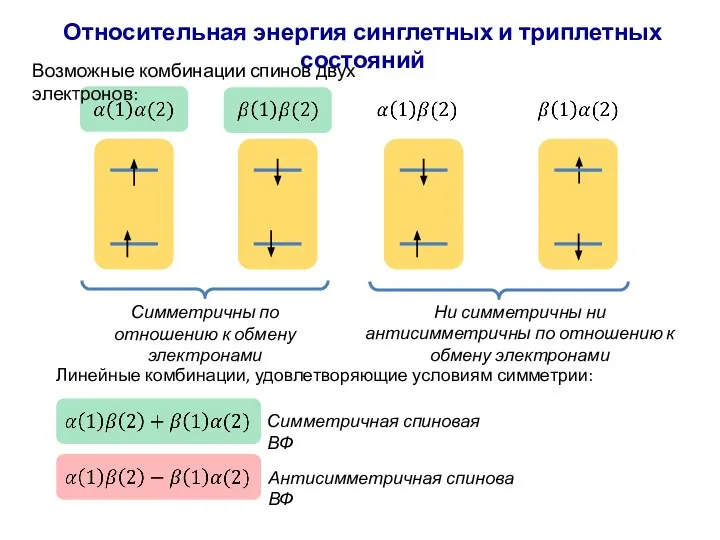
- 45. Относительная энергия синглетных и триплетных состояний Возможные комбинации спинов двух электронов: Симметричны по отношению к обмену
- 46. Относительная энергия синглетных и триплетных состояний Триплетная спиновая ВФ (симметричная) Синглетная спиновая ВФ (антисимметрияная) Поэтому у
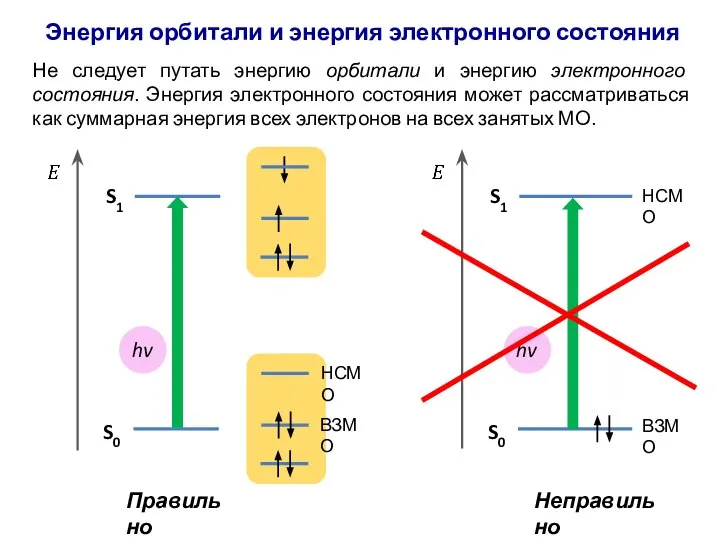
- 47. Энергия орбитали и энергия электронного состояния Не следует путать энергию орбитали и энергию электронного состояния. Энергия
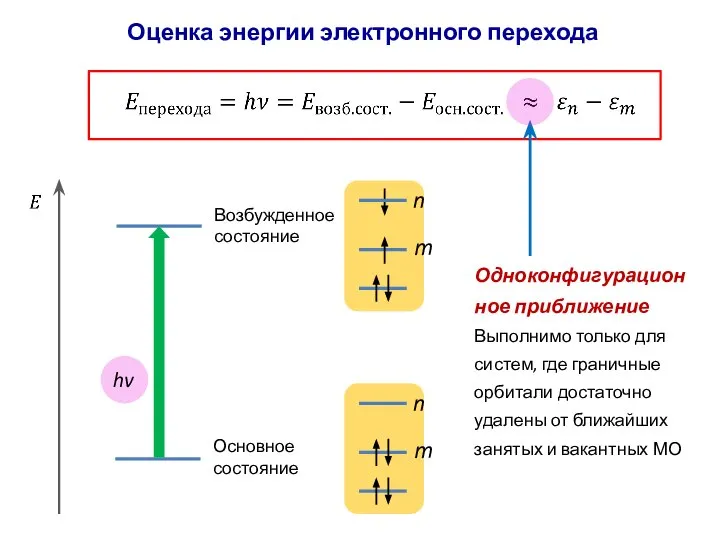
- 48. Оценка энергии электронного перехода hv m n Основное состояние Возбужденное состояние Одноконфигурационное приближение Выполнимо только для
- 50. Скачать презентацию













 Zakon_vsemirnogo_tyagotenia
Zakon_vsemirnogo_tyagotenia Объяснение изменений агрегатных состояний вещества на основе молекулярно-кинетических представлений
Объяснение изменений агрегатных состояний вещества на основе молекулярно-кинетических представлений Судың физикалық қасиеттері
Судың физикалық қасиеттері Механические колебания. Лекция 6
Механические колебания. Лекция 6 Магнитное поле. Действие магнитного поля на проводник с током
Магнитное поле. Действие магнитного поля на проводник с током Электромагнитные волны. Лекция 11
Электромагнитные волны. Лекция 11 Самокат. AM05787. Описание изменений ONR 20200213
Самокат. AM05787. Описание изменений ONR 20200213 Космология Ньютона. Часть 2. Физика космоса
Космология Ньютона. Часть 2. Физика космоса Лазерное излучение
Лазерное излучение Тормозное управление
Тормозное управление Муфты насоса
Муфты насоса Закон сохранения энергии
Закон сохранения энергии Физические величины и их измерение. Задания
Физические величины и их измерение. Задания Применение химии в радиоэлектронике
Применение химии в радиоэлектронике Ядерные взаимодействия. (Тема 2.1)
Ядерные взаимодействия. (Тема 2.1) Электрический заряд. Закон Кулона
Электрический заряд. Закон Кулона Распространение радиоволн
Распространение радиоволн Атом - сложная частица
Атом - сложная частица Геометрическая оптика
Геометрическая оптика Закон Снеллиуса (отражения) для монотипных волн
Закон Снеллиуса (отражения) для монотипных волн Применение спектрального анализа в криминалистике
Применение спектрального анализа в криминалистике Масса. Задачник
Масса. Задачник Законы сохранения в механике
Законы сохранения в механике Физика как наука. Методы познания
Физика как наука. Методы познания Траектория - прямая линия
Траектория - прямая линия Волшебница вода
Волшебница вода Ядерные реакции. Процесс столкновения микрочастицы с атомным ядром
Ядерные реакции. Процесс столкновения микрочастицы с атомным ядром Плотность вещества (7 класс)
Плотность вещества (7 класс)