Содержание
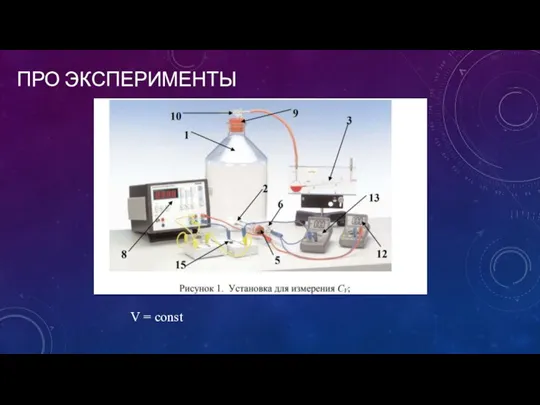
- 2. ПРО ЭКСПЕРИМЕНТЫ V = const
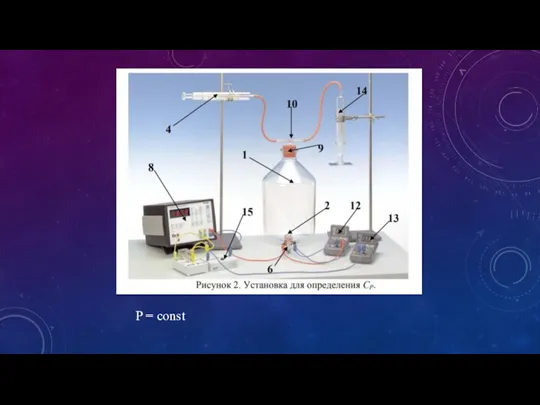
- 3. P = const
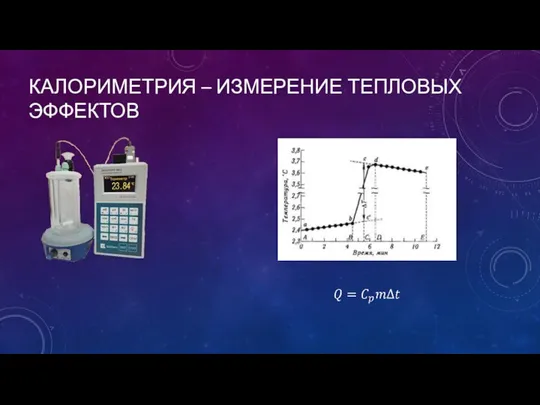
- 4. КАЛОРИМЕТРИЯ – ИЗМЕРЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ
- 5. ТЕРМОГРАВИМЕТРИЯ – ИЗМЕРЕНИЕ МАССЫ ПРИ НАГРЕВАНИИ
- 6. Задание: проверьте соответствие теории с экспериментом
- 7. САМОПРОИЗВОЛЬНОСТЬ CuSO4 + NaOH = Cu(OH)2 + Na2SO4 H2O = H2 + O2
- 8. КОНТРПРИМЕРЫ Ba(OH)2*8H2O + 2NH4Cl = BaCl2*2H2O + 2NH3 + 8H2O Растворение кристаллогидратов тоже самопроизвольное и эндотермическое
- 9. ЭНТРОПИЯ
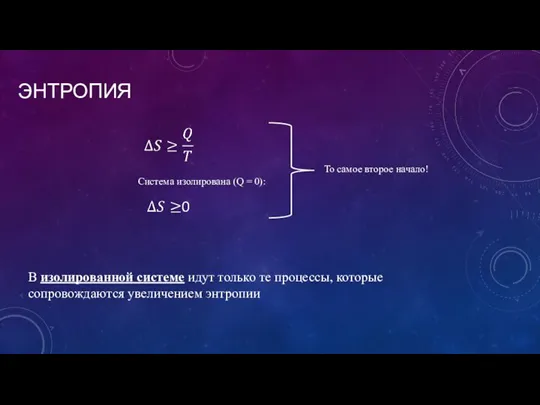
- 10. ЭНТРОПИЯ Система изолирована (Q = 0): То самое второе начало! В изолированной системе идут только те
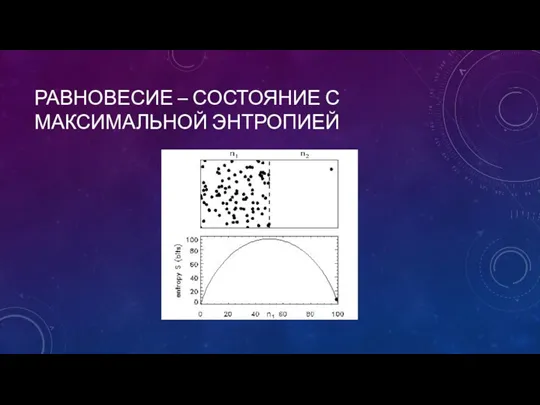
- 11. РАВНОВЕСИЕ – СОСТОЯНИЕ С МАКСИМАЛЬНОЙ ЭНТРОПИЕЙ
- 12. ЭНТРОПИЯ И ТЕРМОДИНАМИЧЕСКАЯ ВЕРОЯТНОСТЬ Микросостояния S = k*lnW W – термодинамическая вероятность (число возможных микросостояний)
- 13. ЗАЧЕМ ЭТО ХИМИКАМ? Q = ΔH (P = const) G = H – TS => ΔG
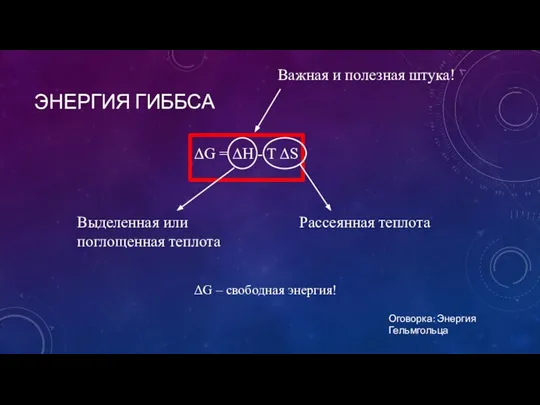
- 14. ЭНЕРГИЯ ГИББСА ΔG = ΔH - T ΔS Важная и полезная штука! Рассеянная теплота Выделенная или
- 15. САМОПРОИЗВОЛЬНОСТЬ Самопроизвольно идут те реакции, которые сопровождаются уменьшением внутренней энергии. H2O = H2 + O2 CuSO4
- 16. КРИТЕРИЙ САМОПРОИЗВОЛЬНОСТИ Оговорка: P, T = const
- 17. ТЕПЕРЬ О ТОМ, КАК СЧИТАТЬ Третье начало термодинамики Стандарт не нужен, можно измерить абсолютное значение. Энтропия
- 18. НУ ВЫ НАВЕРНОЕ УЖЕ ПОНЯЛИ
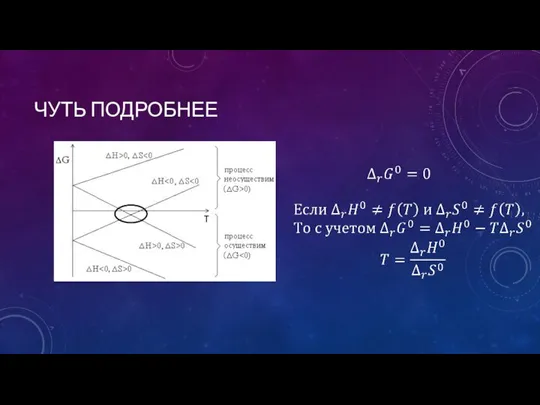
- 19. ЧУТЬ ПОДРОБНЕЕ
- 20. ЗАДАНИЕ: КАКАЯ ИЗ ЭТИХ РЕАКЦИЙ ПРОТЕКАЕТ САМОПРОИЗВОЛЬНО ПРИ 300К? И ПРИ КАКОЙ ТЕМПЕРАТУРЕ НАЧИНАЕТ ПРОТЕКАТЬ ВТОРАЯ?
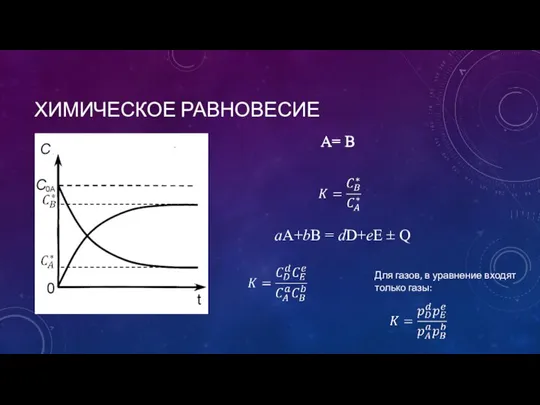
- 21. ХИМИЧЕСКОЕ РАВНОВЕСИЕ aA+bB = dD+eE ± Q A= B Для газов, в уравнение входят только газы:
- 22. КАК ОПРЕДЕЛИТЬ КОНСТАНТУ РАВНОВЕСИЯ
- 24. ПРИМЕРЫ ИСПОЛЬЗУЕМЫХ РАВНОВЕСИЙ: pH Расчет растворимостей
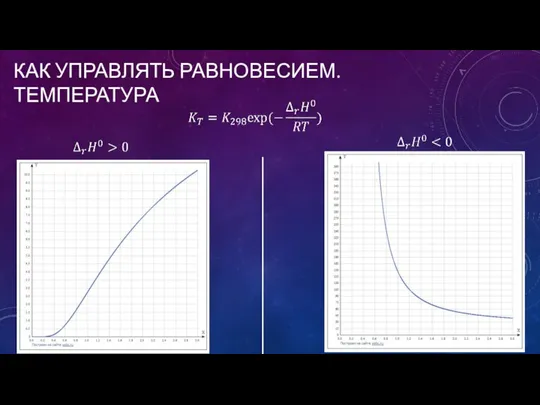
- 25. КАК УПРАВЛЯТЬ РАВНОВЕСИЕМ. ТЕМПЕРАТУРА
- 26. КАК УПРАВЛЯТЬ РАВНОВЕСИЕМ. ДАВЛЕНИЕ И ИНЕРТНЫЕ ПРИМЕСИ Задание: как сдвинуть равновесие вправа и влево в этих
- 28. Скачать презентацию
















 Правила и приёмы решения задач
Правила и приёмы решения задач Геометрическая оптика. Свет. Источники света
Геометрическая оптика. Свет. Источники света Энергия и работа. Удары. Лекция 3
Энергия и работа. Удары. Лекция 3 Матрица
Матрица Динамика. Законы Ньютона
Динамика. Законы Ньютона Презентация на тему Электрический ток в газах. Плазма
Презентация на тему Электрический ток в газах. Плазма  Лекция 4(ОИ) (студентам)
Лекция 4(ОИ) (студентам) Парабола и ее применение в жизни
Парабола и ее применение в жизни Силы трения между соприкасающимися поверхностями твердых тел
Силы трения между соприкасающимися поверхностями твердых тел Температура. Виды термометров
Температура. Виды термометров Электрическое сопротивление проводников. Единицы сопротивления. Закон Ома для участка цепи
Электрическое сопротивление проводников. Единицы сопротивления. Закон Ома для участка цепи Нефтегазовая и рудная геофизика. Сейсмические методы при изучении строения земной коры
Нефтегазовая и рудная геофизика. Сейсмические методы при изучении строения земной коры Обзор доказательств ложности утверждений о возможности самосовершенствования
Обзор доказательств ложности утверждений о возможности самосовершенствования Автомобильные субкультуры
Автомобильные субкультуры Методы измерения фокусных расстояний
Методы измерения фокусных расстояний Ускорение свободного падения на Земле и других планетах. 9 класс
Ускорение свободного падения на Земле и других планетах. 9 класс Кинематика в профессиональной деятельности
Кинематика в профессиональной деятельности Исследование радиального профиля параметров активной среды лазеров с разрядом в полом катоде
Исследование радиального профиля параметров активной среды лазеров с разрядом в полом катоде Flyer engine BYD 368
Flyer engine BYD 368 Проект Электромагнитный двигатель из батарейки
Проект Электромагнитный двигатель из батарейки Элементарные частицы
Элементарные частицы Электрический ток в металлах
Электрический ток в металлах Электромагнитные волны
Электромагнитные волны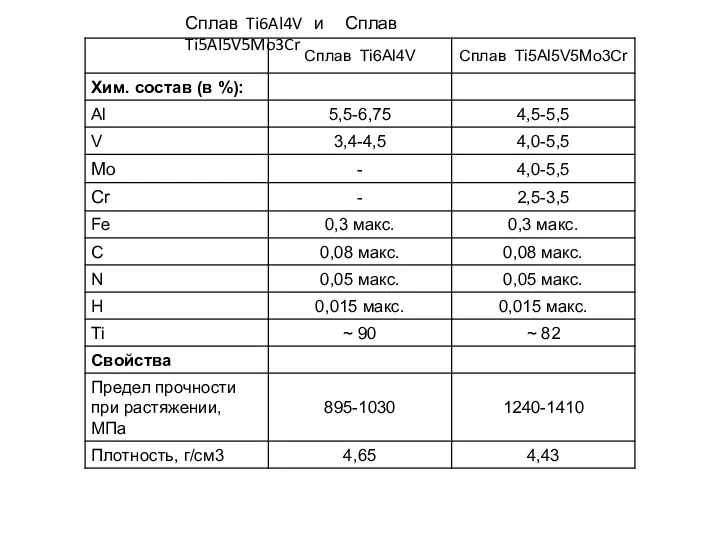 Сплав Ti6Al4V и сплав Ti5Al5V5Mo3Cr
Сплав Ti6Al4V и сплав Ti5Al5V5Mo3Cr Магнитные свойства материалов
Магнитные свойства материалов Презентация на тему Закон Паскаля
Презентация на тему Закон Паскаля  Внутренняя энергия и способы ее изменения
Внутренняя энергия и способы ее изменения Инфракрасное излучение в помощь школе
Инфракрасное излучение в помощь школе