Содержание
- 2. ЭЛЕКТРОЛИТЫ-вещества, обладающие ионной проводимостью; их называют проводниками второго рода – прохождение тока через них сопровождается переносом
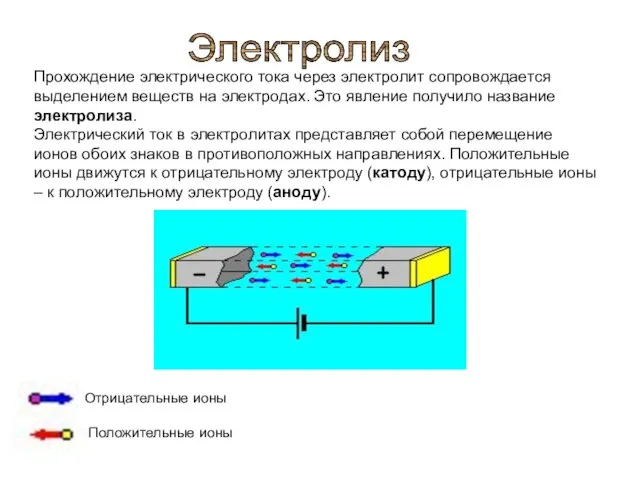
- 3. Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза. Электрический
- 4. Вольтамперная характеристика для электролитов. За счет явления поляризации график смещен. ЭДС поляризации имеет знак, противоположный знаку
- 6. Фарадей Майкл (22.IX.1791–25.VIII.1867) Английский физик и химик. Один из основателей количественной электрохимии. Установил (1833–1836) количественные законы
- 7. Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных
- 8. электролитическая диссоциация
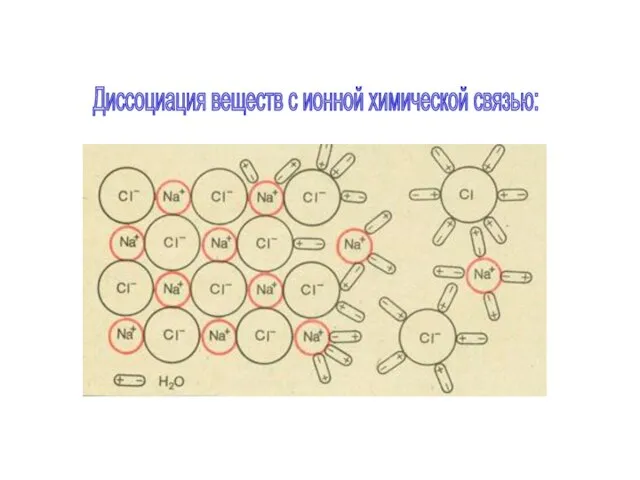
- 9. Диссоциация веществ с ионной химической связью:
- 10. Схема электролитической диссоциации на примере хлора и натрия
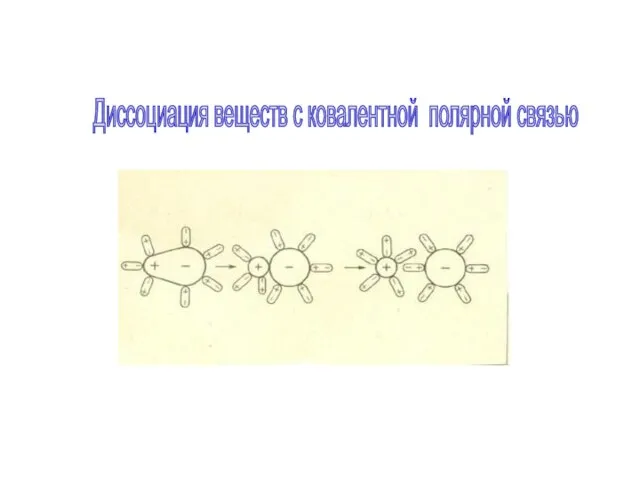
- 11. Диссоциация веществ с ковалентной полярной связью
- 13. Скачать презентацию






 Машина Голдберга
Машина Голдберга Автономные инверторы
Автономные инверторы Расчет измерительных преобразователей
Расчет измерительных преобразователей Насыщенный пар. Кипение. Влажность воздуха. Уроки физики в 10 классе
Насыщенный пар. Кипение. Влажность воздуха. Уроки физики в 10 классе Технологии беспроводной передачи энергии методом электромагнитной индукции
Технологии беспроводной передачи энергии методом электромагнитной индукции Зубчатые колеса
Зубчатые колеса Силы в природе
Силы в природе Деформація
Деформація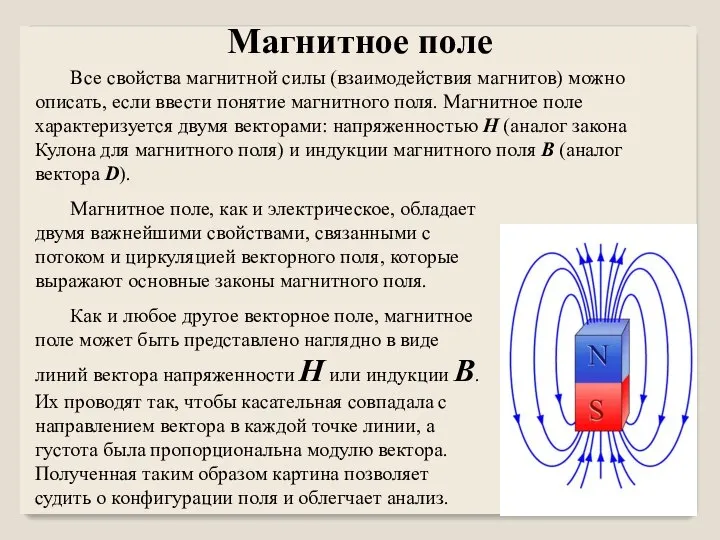 Магнитное поле
Магнитное поле Проектирование компрессорных установок горных предприятий. Занятие 7
Проектирование компрессорных установок горных предприятий. Занятие 7 Пространство, время, движение (Тема 1)
Пространство, время, движение (Тема 1) Энергия топлива. Удельная теплота сгорания топлива
Энергия топлива. Удельная теплота сгорания топлива Еволюція фізичної картини світу. Фізика і науково-технічний прогрес. Урок 98
Еволюція фізичної картини світу. Фізика і науково-технічний прогрес. Урок 98 Физическая природа изображений
Физическая природа изображений Физические и химические явления. 8 класс
Физические и химические явления. 8 класс Различные свойства вещества
Различные свойства вещества Формула бинома Ньютона. Свойства биноминальных коэффициентов
Формула бинома Ньютона. Свойства биноминальных коэффициентов Защита проекта. Мойка и увлажнитель воздуха
Защита проекта. Мойка и увлажнитель воздуха Применение физических законов при решении задач по астрофизике
Применение физических законов при решении задач по астрофизике Теория парамагнетизма
Теория парамагнетизма Электромагнитные колебания и волны
Электромагнитные колебания и волны Шагающая вода. Исследовательский проект
Шагающая вода. Исследовательский проект Презентация на тему Ультразвук
Презентация на тему Ультразвук  РЛС воздушного наблюдения антенно-волноводного тракта
РЛС воздушного наблюдения антенно-волноводного тракта Электрические цепи и их элементы
Электрические цепи и их элементы Оценка параметров движения при зондировании последовательностью оптических импульсов
Оценка параметров движения при зондировании последовательностью оптических импульсов Сказка про радио
Сказка про радио Методы получения вакуума
Методы получения вакуума